2024年の医薬系”特許的”な出来事を振り返ります。

2024年も残すところあとわずかとなりました。
2024年の医薬系”特許的”な世相を漢字一文字で表すとしたら、何を思い浮かべますか?

わたくしは、2024年こそ「和」だと思いますね。大きな話題となっていた裁定請求事件も和解に至りましたし、平和な世の中になってほしいです。2024年ノーベル平和賞も日本原水爆被害者団体協議会(日本被団協)に授与されましたし、今、平和に過ごすことができていることのありがたさを改めて感じた年でした。

確かに! ダサチニブやシタグリプチンの水「和」物に関連した問題も2023年末から2024年にかけて大いに盛り上がったしな。日本のパテントリンケージ運用と延長特許権効力の問題が同時に露呈したぞ!

さすがピポ先輩! 鋭いですね~。でも、2024年も「和」じゃないようですよ。
このブログは、製薬業界の舞台裏で繰り広げられている知的財産に関する事件を紹介しつつ、最新のトレンドを知的財産の視点で紐解きます。
ご興味あれば、ぜひ、当ブログ(https://www.tokkyoteki.com)とX(旧Twitter)(@tokkyoteki)のフォローをどうぞよろしくお願いします。

・・・ということで、いきなり発表しちゃいます。
2024年の医薬系”特許的”な世相を表す漢字一文字、”漢字・オブ・ザ・イヤー“は・・・
・
・
・

なるほどです。

神木隆之介さまの「介」?・・・ど、どういうことだ?

ピポ先輩~。「介」(すけ、かい)ですね。訓読みで「たす(ける)」とも読みますね。間にはさまる、間に入ってとりもつ、たすけるといった意味がありますよ。

そういえば、久光製薬の「介(すけ)の字貼り®」を2024年のブログ記事で紹介したな。しばしば腰痛で同社製品にはたいへんお世話になっているぞ。

AIでも腰痛になるんですか~。ピポ先輩~。

・・・
みなさまはどんな一文字を思い浮かべたでしょうか。
本記事では、「介」をテーマに、2024年を賑わせた医薬系”特許的”な出来事について、振り返ります。
1.仲介
(1)裁定請求の和解
特許権は特許発明を実施する独占排他的な権利を特許権者に与えるものですが、公共の利益が関わる場合、その特許発明の実施をしようとする第三者は例外的に経済産業大臣による通常実施権(いわゆる強制実施権)の設定を求めることできると法律で定められています(特許法第93条)。
そんな強制実施権の設定が日本史上初めて裁定されるのでは!?と注目されていた、自家iPS細胞由来網膜色素上皮細胞の製造に関する特許権に対して公共の利益に基づく通常実施権設定の裁定が請求された事件において、その審議体である発明実施部会の委員の立場にあった清水節氏(元・知的財産高等裁判所長)の「仲介」によって、2024年5月30日、ビジョンケア、ヘリオス、住友ファーマを含む当事者間での和解が成立したと発表されました。
この事件により、公共の利益と特許権者の権利をどのように調和させるかという課題とともに、そのような紛争に政府が介入することの難しさ、判断の基準の明確性や透明性など、多くの課題が浮き彫りとなりました。
請求人側(ビジョンケア)は、「公共性の高い特許発明については、それをより良く活用できる者による実施が認められなければならない」と主張しました。これに対して、特許権者側(ヘリオス)は、自らの研究開発への投資や将来的な競争力維持の観点から、強制的な実施権の設定には抵抗したと思われます。
本事件において特筆すべき点は、清水氏が、部会での審議とは別に非公開義務に反しない範囲内で、当事者間で合意を形成するための「仲介」役として重要な役割を果たしたことです。最終的に、強制実施権の設定は避けられ、特許権者と請求人が合意に達したことで、新たな治療技術の社会実装に向けた道筋がつけられました。しかし、清水氏による「仲介」によってやっと和解に漕ぎつくことができたことは、むしろ、裁定を行う政府による介入が最終的な和解に十分機能しなかったと見ることもできます。
後述する様々な出来事とも関連してきますが、医療分野に代表される公共の利益と知的財産とのバランスに関する問題は、ますます複雑化しています。公共の利益を知的財産権との関係でどのように考慮するのかといった政策的方向性や例外的な政府による介入の在り方などは本事件前からもっと公の場で具体的に議論されて然るべき課題であったところ、今回、ビジョンケアが裁定請求に踏み切ってこうして話題になったことはその議論を盛り上げる重要な一歩となったのかもしれません。
- 2024.07.02 ブログ記事: 公共の利益のための通常実施権を設定すべき旨の裁定請求 ⾃家iPS細胞由来の網膜色素上皮細胞の製造等に関してビジョンケア、ヘリオス、住友ファーマらが和解 ― 強制実施権設定の在り方と浮かび上がった課題 ―
(2)パンデミックと南北問題
公共の利益と知的財産権とのバランスという問題に関して、国際的な話題に目を向けると、2024年5月27日から6月1日までスイス・ジュネーブで開催されていた世界保健機関(WHO)の第77回年次総会(World Health Assembly)は、「WHOパンデミック協定」(WHO pandemic agreement)案の採択を見送ることを決定しました。ワクチン等の技術移転や公正な配分に関して、先進国と開発途上国との間で意見が対立したとみられ、加盟国間の交渉は最大1年延長されることとなりました。
COVID-19パンデミックの教訓を生かして、次に起きるかもしれない新たなパンデミックに国際社会としてどう対抗していくか知恵を絞り、国際的な枠組みを確立することが急務のはずですが、知的財産権の存在が悪者であるという立場の開発途上国側と、ワクチンや医薬品の開発推進・協業のエンジンである知的財産権は重要であってボランタリーなライセンスや供給に取り組んでいる(ラスト・ワン・マイル問題は知的財産権とは別に原因がある)という立場の先進国側とで世界は分断(いわゆる南北問題化)しており、紛争において和平を「仲介」するようなこの対立の「仲介」者となってくれる国も存在しないことから、国際機関での議論が停滞しています。
新たなパンデミックが起きたとき、国際社会は一枚岩となって対抗できるのでしょうか。
- 2024.06.16 ブログ記事: WHOパンデミック協定採択見送り 知的財産権放棄議論から意見対立は技術移転やワクチン、治療薬及び診断薬配分の仕組みへ

2.介入
(1)マーチ・イン・ライト
 公共の利益と知的財産権とのバランスという問題に関連して、米国での話題に目を向けてみましょう。
公共の利益と知的財産権とのバランスという問題に関連して、米国での話題に目を向けてみましょう。
米国では、バイデン政権が提案した「介入」権(March-in rights)の行使に関する薬価引下げ施策が各界からの大きな反発を招いています。
「介入」権とは、連邦政府が、公的資金で支援された研究開発成果に基づく特許に対して、特許権者の独占権を制限し、第三者にライセンスを付与できる権利のことです。この権利は、特許権者がその技術を適切に活用せず、公共の利益に供されていない場合に、政府により行使されます(35 U.S.C. §203)。これは、連邦政府が強制実施権を第三者に設定する権限のひとつといえます。
2023年12月7日、バイデン政権は、米国内での薬価高騰に対応するため、「介入」権を行使することで価格の引き下げを目指す方針を発表しました。この政策提案の背景には、米国の医薬品価格が他国に比べて非常に高いという現状があります。特に、公的資金で開発された医薬品が特許権者によって高価格で販売され続ける場合、公的資金が投入されたのに私的独占によって公共の利益が損なわれているのではないかとの見方があります。提案されたこの施策により、「介入」権の行使は、製薬企業に対して、薬価の引き下げを強制する圧力として機能する可能性があります。
しかし、製薬企業は、多額の投資と開発失敗リスクを伴う医薬品開発を行っており、特許権はその投資を回収し、次のイノベーションに向けた資金を確保するための重要な手段です。「介入」権の行使によって、特許から得られる収益が減少すれば、研究開発のインセンティブが低下し、革新的な医薬品の開発が阻害されるとの懸念があります。また、公的資金を頼りにする米国のアカデミアとの協業活動にもブレーキがかかり、その結果、米国のエコシステムは崩壊しかねません。
バイデン政権の提案は、薬価引下げのために政府がどのように「介入」できるかという新たな挑戦であり、特に公的資金が関与した場合の知的財産権の在り方を再定義する試みでもあります。この政策が実現すれば、薬価を抑えるための強力な手段となる可能性がありますが、同時に米国エコシステムや医薬品開発への深刻な影響がある可能性も慎重に議論されるべきです。
2025年に移行するトランプ政権で、この施策方針はどうなるのでしょうか。
- 2024.06.23 ブログ記事: バイデン政権による介入権(March-in rights)を行使する薬価引下施策の提案に各界から反発の声

(2)オレンジブック
 米国連邦取引委員会(Federal Trade Commission; FTC)は、2023年11月7日、米国食品医薬品局(Food and Drug Administration; FDA)の「オレンジブック(Orange Book)」に不適切に掲載されたとされる100件以上の特許について製薬企業10社に警告を行った後、2024年4月30日にも、その標的特許を300件以上に拡大し、監視の目を広げています。
米国連邦取引委員会(Federal Trade Commission; FTC)は、2023年11月7日、米国食品医薬品局(Food and Drug Administration; FDA)の「オレンジブック(Orange Book)」に不適切に掲載されたとされる100件以上の特許について製薬企業10社に警告を行った後、2024年4月30日にも、その標的特許を300件以上に拡大し、監視の目を広げています。
- 2024.04.30 FTC press release: FTC Expands Patent Listing Challenges, Targeting More Than 300 Junk Listings for Diabetes, Weight Loss, Asthma and COPD Drugs
このFTCの「介入」により、オレンジブックにはどのような特許が収載されるべきなのかについての議論が活発化するとともに、吸入デバイス特許のオレンジブック収載の適切性が争われている裁判の行方が注目されています。
オレンジブック(Orange Book)とは、FDAが発行する「Approved Drug Products with Therapeutic Equivalence Evaluations」の通称であり、「Drug Price Competition and Patent Term Restoration Act」(通称: ハッチ・ワックスマン法(Hatch-Waxman Act))に基づき、FDAが作成した出版物で、「Federal Food, Drug, and Cosmetic Act」(FD&C Act)に基づいて承認した医薬品を特定しています。また、オレンジブックには、承認取得者である先発医薬品企業が提出した各医薬品を保護するとされる特許が明記されています。
後発医薬品企業がハッチ・ワックスマン法に基づき後発医薬品の承認を取得するためには、後発医薬品企業は、簡略新薬承認申請(ANDA)とともに、オレンジブックに収載された特許の満了まで後発医薬品の発売を待つことを宣誓するか、或いはその特許が無効/権利行使不能であること又は後発医薬品がその特許を侵害しないことの証明(パラグラフIV証明)を提出しなければなりません。
後発医薬品企業のANDA行為に対して先発医薬品企業が特許権侵害訴訟(ハッチ・ワックスマン訴訟)を提起すれば、特許が有効かどうか/後発医薬品が侵害かどうか等の最終的な裁判所の判断を待つために、FDAにおける後発医薬品の承認手続きは自動的に30ヶ月間停止されることになります。
FTCが調査に動き出した背景には、先発医薬品企業が、オレンジブックに特許を不適切に収載することで、ハッチ・ワックスマン訴訟の提起により自動的に発動される30ヶ月間の承認停止措置の結果、後発医薬品の市場参入を遅らせ、市場競争を妨げているという疑いにあります。
しかし、先発医薬品企業の立場としては、オレンジブックへの特許収載義務を果たすために、問題の中心となっている投与デバイス特許のクレームは特許収載要件である「final dosage form」としての「drug product」に該当し得ると解釈する余地もあり得ることから、投与デバイス特許もオレンジブックに収載するという「保守的な態度」をとらざるを得ないということがあるかもしれません。
このようなFTCの「介入」の話題と並行して、喘息用吸入薬ProAir® HFA (albuterol sulfate)の後発医薬品を申請したAmneal社に対してTeva社が提起したハッチ・ワックスマン訴訟において、オレンジブックに収載されるべき特許の適切性が争われています。
この裁判では、Teva社はオレンジブックにProAir® HFA吸入デバイスに関する特許(US8,132,712等)を収載していたため、Teva社の特許権侵害の主張が引き金となって、Amneal社の後発医薬品の承認を30ヵ月間(2026年2月まで)停止する措置が発動されました。Amneal社は、Teva社が特許をオレンジブックに不適切に収載したため、Amneal社の後発医薬品の承認は停止されず早期に承認されるべきであり、Teva社の不適切な特許収載が競争を阻害したと主張しました。
オレンジブックに不適切に収載されたとして2023年末にFTCが製薬企業に警告した特許の中には、Teva社のProAir® HFA吸入デバイスに関して争点となっている5件の特許も含まれており、FTCは、Teva社がオレンジブックに不適切な特許を収載しているためその収載を削除するよう要請する旨のアミカスブリーフ(意見書)をこの訴訟で提出しました。
- 2024.03.22 FTC press release: FTC Files Amicus Brief in Asthma Inhaler Patent Dispute
- 2024.03.22 FTC: FEDERAL TRADE COMMISSION’S BRIEF AS AMICUS CURIAE
そして、2024年6月10日、ニュージャージー州連邦地方裁判所は、Teva社の特許収載は不適切であると判断しました。同地裁は、オレンジブックに収載すべき特許を定義した21 CFR§314.3(b)の 「drug product」及び「dosage form」の解釈を説明するための連邦官報告示(FDA, Final Rule, 68 Fed. Reg. 36676, 36680 (June 18, 2003))に含まれるFDAのガイダンス(21 CFR§314)の以下の記載に基づき、当該吸入デバイス特許は、承認された医薬品の “finished dosage form”をクレームしておらず、従って、オレンジブック収載要件を満たしていないと結論付けました(Teva v. Amneal: Case 2:23-cv-20964)。
事件は米国連邦巡回区控訴裁判所(U.S. Court of Appeals for the Federal Circuit; CAFC)に控訴されましたが(Teva v. Amneal, No. 2024-1936 (Fed. Cir. July 10, 2024))、2024年12月20日、CAFCは、オレンジブックに特許を収載するには、特許は少なくとも承認された医薬品の有効成分をクレームしていなければならないと判示し、地裁の判断を支持する判決を下しました。
“To summarize, our analysis of the numerous relevant statutory provisions and the relevant case law leads us to only one conclusion: To list a patent in the Orange Book, that patent must, among other things, claim the drug for which the applicant submitted the application and for which the application was approved. And to claim that drug, the patent must claim at least the active ingredient. Thus, patents claiming just the device components of the product approved in an NDA do not meet the listing requirement of claiming the drug for which the applicant submitted the application.”
FTCは、控訴審でも、Teva社がオレンジブックに不適切な特許を収載しているためその収載を削除するよう要請する旨のアミカスブリーフ(意見書)を提出しており、このCAFCによる判決言渡しと同日、この判決を歓迎する声明を発表しました。
- 2024.12.20 FTC press release: FTC Statement on Appellate Court Decision Ordering Delisting of Teva Inhaler Patents Decision vindicates previous FTC actions to promote affordable drugs, generic competition
- 2024.09.19 FTC press release: Teva Branded Pharmaceutical Products R&D, Inc., Norton (Waterford) Ltd., Teva Pharmaceuticals USA, Inc. v. FTC, et al.
- 2024.09.06 FTC: BRIEF FOR THE FEDERAL TRADE COMMISSION AS AMICUS CURIAE IN SUPPORT OF APPELLEES SUPPORTING AFFIRMANCE
FTCはオレンジブックへ収載されている特許の適切性について、その監視と「介入」を強めています。
一方、オレンジブックを管轄するFDAはというと、特許の専門知識を持っている組織ではないことから、承認取得者から提供される情報に基づいて淡々と特許をオレンジブックに収載しているようです(Orange Book Patent Listing Dispute List)。

特許の専門家でない厚生労働省がパテントリンケージで特許権侵害を判断している日本と何だか問題点が似ているな。その判断は、裁判所に頼るか、法律・規則で明確化するしかなさそうだな。
ProAir® HFA吸入デバイスに関する控訴審の結果は、吸入デバイスや注射デバイスといった投与デバイス技術による医薬品の開発への投資に大きな影響を与えるかもしれません。
- 2023.11. 25ブログ記事: FDAのOrange Book(オレンジブック)に不適切?に収載された100件以上の特許、製薬企業10社にFTCが警告

(3)分割出願
欧州においても、特許の分割出願戦略に対して欧州委員会が「介入」した事件が話題になりました。
2024年10月31日、欧州委員会は、Teva社の大ヒット医薬品である多発性硬化症治療薬コパキソン(Copaxone®)と競合する安価な後発医薬品の市場参入を遅らせるために優越的地位を濫用したとして、Teva社に対して4億6,260万ユーロの制裁金を科すと発表しました。
- 2024.11.04 ブログ記事: 欧州委員会がTeva社に制裁金 多発性硬化症治療薬コパキソンの分割出願制度濫用と競合製品への誹謗中傷行為を理由に
分割出願は、製品保護のために必要な特許戦略の重要な手続きのひとつですが、分割出願の行き過ぎた戦略的活用を「Divisionals game」だとして問題視する意見があります。
今回の欧州委員会の「介入」は、特許法の手続きとして許される分割出願の戦略的活用であっても、競争法的観点から「黒」である境界線を理解しておくことの重要性を示すものといえます。
欧州委員会の判断の詳細はまだ公開されていませんが、特許権者は、後発医薬品参入を遅らせようとする特許戦略が、規則に則った手続きであっても、この境界線を理解しておかないと、後になってから大変なことになりますので、細心の注意を払う必要があります。
(4)臨床試験
医学・薬学分野において「介入」とは、研究目的で人の健康に関する様々な事象に影響を与える要因の有無や程度を制御する行為を指します。新しい治療法や薬の有効性・安全性を科学的に検証する目的で行われる臨床試験は、「介入」を伴う研究の一種です。
その臨床試験を実施する者には、臨床試験の透明性を約束するため、臨床試験を開始する前に、臨床試験のプロトコル(試験実施計画書)に関する情報を公開データベースに登録することが求められています。このプラクティスは、製薬企業にとって、順守すべきものであると同時に、当該臨床試験に基づく医薬用途発明に係る特許出願戦略にも大きな影響を及ぼします。
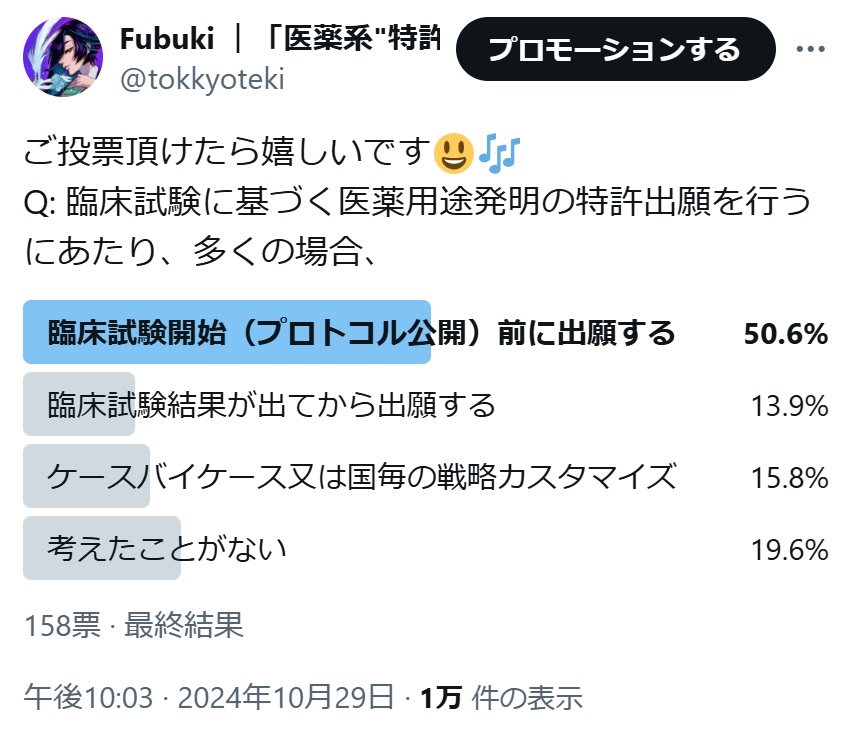
2024年8月7日、臨床試験に基づく医薬用途発明について、どのようなタイミングで特許出願に踏み切るかということに示唆を与えてくれる知財高裁判決が言い渡されました(知財高裁令和5年(行ケ)10019)。
デュピルマブのアトピー性皮膚炎患者における有効性を確認する臨床試験結果に基づく医薬用途発明に係るリジェネロン及びサノフィの特許に対する無効審判を請求した科研製薬が、進歩性欠如の無効理由として挙げた引用文献は、本件特許の明細書に実施例としてその結果が記載されていた、臨床試験情報データベース(ClinicalTrials.gov)に登録されたデュピルマブの臨床試験(フェーズ2)のプロトコル(試験実施計画書)でした。
本事件は、臨床試験プロトコルの公開が特許性に与える影響を踏まえ、臨床試験に基づく医薬用途発明について、臨床試験開始前に出願すべきか、それとも試験結果が得られてから出願すべきか、というジレンマを考察しながら出願戦略を組み立てるケーススタディとして良い題材といえます。
アトピー性皮膚炎患者を対象としたデュピルマブの有効性を確認する臨床試験プロトコルの公開と、臨床試験結果に基づく特許出願の関係性について整理し、本件訴訟における裁判所の判断や欧米の審査状況を見ていくと、各国の特許制度における新規性・進歩性、記載要件、臨床試験プロトコルの公開がもたらす影響、さらには企業のビジネス戦略や市場における競争環境も重要な要素であり、それら観点を総合的に考慮しつつ、ビジネス的観点から最適な出願戦略を構築する必要があることがわかります。
臨床試験開始時点でのプロトコル公開によるリスクをどのように管理し、どのようなタイミングで出願を行っていくか、どのような内容を明細書に組み込んでいくかについて、知財部門は開発部門と連携して、臨床試験の計画段階から出願戦略を練り上げることが求められます。早い段階から各部門が連携し、迅速かつ的確な対応が不可欠であり、このような総合的な視点を持ったアプローチが、医薬品ビジネスにおける成功の鍵となります。
- 2024.10.28 ブログ記事: 2024.08.07 「科研製薬 v. リジェネロン/サノフィ」 知財高裁令和5年(行ケ)10019 ― 臨床試験結果に基づく医薬用途発明の特許出願のジレンマ:臨床試験プロトコル公開のインパクト

なお、この判決を踏まえて、X(旧twitter)にて以下の質問をポストしたところ、多くの回答を頂きました。ありがとうございます。

医薬系特許関係者しか知らないかもしれない質問に、よくこれだけ票が集まったな。

興味深い結果ですね~、ピポ先輩。
3.お節介?
(1)米国からの圧力
 米国通商代表部(United States Trade Representative; USTR)が公表した2024年スペシャル301条報告書(2024 Special 301 Report)の中で、日本が2021年から実施している医薬品の毎年薬価改定の透明性と予測可能性の欠如、これは予想以上に多くの医薬品に適用されており、先進医療機器と革新的医薬品の価格設定と償還政策についてのステークホルダーからの有意義な意見の反映に関して、透明性の面で日本が不十分であると、ステークホルダーが懸念を表明し続けていることが記述されました。
米国通商代表部(United States Trade Representative; USTR)が公表した2024年スペシャル301条報告書(2024 Special 301 Report)の中で、日本が2021年から実施している医薬品の毎年薬価改定の透明性と予測可能性の欠如、これは予想以上に多くの医薬品に適用されており、先進医療機器と革新的医薬品の価格設定と償還政策についてのステークホルダーからの有意義な意見の反映に関して、透明性の面で日本が不十分であると、ステークホルダーが懸念を表明し続けていることが記述されました。
日本の医薬品産業の問題点への指摘の中で、特に、知的財産制度に直接関連した懸念事項として、昨年に引き続き、パテントリンケージ、特許権存続期間延長登録制度、医薬品データ保護制度に関する問題点を指摘する声が多く挙がっています。
米国でも、自国のパテントリンケージとして機能しているオレンジブックの収載特許の適切性が問題となっているのに、日本のパテントリンケージの運用を指摘するのは少し「お節介」と思われるかもしれません。しかし、日本版パテントリンケージの運用に課題が多くあることは確かです。
- 2024.05.29 ブログ記事: 米国通商代表部(USTR) 2024年スペシャル301条報告書(2024 Special 301 Report) ― 日本の薬価制度に言及 ステークホルダーからはデータ保護、パテントリンケージ、特許延長の不確実性にも懸念の声 ―

(2)パテントリンケージの専門家
2023年のエリブリン事件判決(ブログ記事参照: 2023.05.10 「ニプロ v. エーザイ」 知財高裁令和4年(ネ)10093 特許権侵害差止請求権等の不存在確認請求控訴事件(エリブリンメシル酸塩事件) - 法治主義に反する状況? 問われる日本版パテントリンケージ制度 -)が契機となって、現行の運用のままでは後発医薬品の承認審査過程で厚生労働省が特許権侵害を判断することは困難であることから、厚生労働省はパテントリンケージの運用改善に向けてとうとう動き出しました。
2024年7月25日に開催された厚生科学審議会(医薬品医療機器制度部会)において、「後発医薬品等の承認審査におけるパテントリンケージ制度の運用改善」が議題として取り上げられました。
- 2024.07.25 ブログ記事: 厚生科学審議会(医薬品医療機器制度部会) パテントリンケージ制度の運用改善について議論 医薬品特許の専門家への意見照会制度の導入検討へ

厚生労働省は、後発医薬品の承認審査に際し、いわゆる「二課長通知」に基づいて先発医薬品の特許との関係性を確認しています(パテントリンケージ制度。2021.03.08 ブログ記事参照: 日本のパテントリンケージの現状の課題とその解決に向けた提案)。しかし、特許権の効力範囲に関する裁判例や確立した学説が少ないため、当事者間で見解の相違が生じることがあり、司法判断を参照せずに特許との関係性を確認することが難しいケースがあります。このような背景から、今回の厚生科学審議会において、厚生労働省医薬局(事務局)より、以下の事項を検討するための研究班を設置し、医薬品特許や薬事規制に詳しい学識経験者の協力を得て、関連する国内外の文献情報や裁判例、学説等を調査・分析することが提案されました。
- 後発品(特にバイオ後続品)の承認審査で考慮される、先発品の「物質特許」及び「用途特許」の定義・範囲
- 特許抵触の有無を確認するための手続きや後発品の承認可否判断の基準
- 医薬品特許の専門家の意見を反映させる仕組み
また、この調査研究の成果をもとに、バイオ後続品も含めたパテントリンケージ制度の改善のため、承認審査において考慮すべき特許の範囲等を明確化した上で、専門家への意見照会制度の導入について、検討を進めることとしてはどうかということも提案されました。
中立的な立場として「専門家への意見照会制度」を導入する案が示されましたが、裁判所による司法判断ではない以上、不公平感・不透明感を払拭できるとは思えません。また、そもそも二課長通知のもとでパテントリンケージが運用されていること自体に行政法上の問題があるとの指摘もあります(興津 征雄 「パテント・リンケージをめぐる行政法上の問題点──医薬品承認制度と特許権保護の交錯」 『市場・国家と法』: 中里実先生古稀祝賀論文集(増井良啓 [ほか] 編/有斐閣 2024年8月) p593-626)。
日本版パテントリンケージの運用には様々な検討課題が存在します(2023.09.18 ブログ記事(2023.10.31追記)参照: 【アンケート】パテントリンケージとして運用されている二課長通知の問題点は何だと思いますか?及び『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p262-266)。
中でも「二課長通知に基づく判断過程・判断理由は、公表されないだけでなく、当事者にも伝えられないため、透明性が欠如していること、公平性が担保されていない」という大きな問題点が、不正競争防止法の虚偽告知該当性の観点から浮き彫りになった事件がありました。後発メーカーのサムスンが、アイリーア®のバイオ後続品が特許権を侵害するとバイエル(先発メーカー)が厚労省に情報提供した行為は不正競争行為に該当すると主張して、その告知行為の差止めの仮処分を求めた事件です。
- 2024.11.23 ブログ記事: 2024.10.28 「サムスン v. バイエル」東京地裁令和6年(ヨ)30029 ― パテントリンケージにおける特許権者による情報提供と不競法の虚偽告知該当性 ―

東京地裁は、バイエルの情報提供は虚偽の回答に該当するとしつつも、パテントリンケージ制度の趣旨目的に照らして著しく相当性を欠くものではないと判断し、サムスンの申立てを却下しました(この事件はパテントリンケージの観点だけでなく、用途発明の無効論と侵害論の視点からも非常に興味深い題材でした)。
パテントリンケージのプロセスにおいては、後発医薬品の承認申請者である後発メーカーには説明の機会が与えられる一方で、先発メーカーには後発医薬品が承認申請された事実すら知らされません。その結果、先発メーカーは、後発医薬品がいつ承認されるのか、また厚生労働省により特許が適切に考慮されているのかを知るすべもなく、ただ成り行きを見守るしかありません。このように、両者の意見提出機会の偏りが、公平性を欠いているのではないかと疑問視される制度の根幹的な問題となっています。
他方で、パテントリンケージの誤った発動は、後発医薬品の市場浸透に遅れを生じさせ、結果として、患者さんの利益を損ねることになりかねません。
医薬品の安定供給という公共の利益に直結するパテントリンケージの発動判断は、極めて重要かつ慎重に行われるべきものです。
厚生労働省からは「専門家への意見照会制度」を運用改善の落としどころにしようとする意図を感じますが、「専門家」が何の責任も問われない単なる「お節介」な存在でしかない運用になるのではないかと危惧しています。
今後の議論において、日本版パテントリンケージが、国際協定を順守するものとして、公正且つ明確であって日本にとってより良い制度に改善されるよう議論が活発化することを期待したいと思います。
4.介在
(1)知財高裁が意見募集した論点
 例えば、進歩性有無の判断には構成の容易想到性や効果の顕著性の有無といった一定の論理が「介在」することによって、その結論が導かれます。
例えば、進歩性有無の判断には構成の容易想到性や効果の顕著性の有無といった一定の論理が「介在」することによって、その結論が導かれます。
では・・・医療は産業か否か、特許権の効力は医療関連行為に及ぶのか否か、特許権の効力は体内現象にも及ぶのか否か、組み合わせ医薬用途発明は方法なのか物なのか・・・という各判断の狭間には明確な論理が「介在」するのでしょうか。
2024年6月24日、知財高裁は、その第1部に係属中の令和5年(ネ)第10040号損害賠償請求控訴事件(原審:東京地裁令和4年(ワ)第5905号)について、広く一般からの意見募集を実施すると発表しました.。
本件は、特許第5186050号に係る特許権の特許権者である控訴人が、医師である被控訴人が血液豊胸手術のために用いる薬剤を製造する行為は、特許発明の実施行為(生産)に当たるとして、民法709条に基づき、損害賠償金1億円及び遅延損害金の支払を求めた事案です。
ブログ記事「2023.03.24 「東海医科 v. A」 東京地裁令和4年(ワ)5905 ― 体外と体内の狭間、組み合わせの物と方法の狭間、医療と産業の狭間で ―」(医薬系特許的判例ブログ年報 2023, p106-131)では、「被告行為は、A剤とB剤を別々に投与するものだったとしても、『A剤とB剤を含有する組成物』をクレームとする本件特許発明に係る特許権を侵害する」との主張に踏み込むための理屈を立てることは可能なのか、本件特許発明がどのようなクレームであったなら、被告行為が特許権の侵害であると問える可能性を高めることができただろうかについての雑感を述べています。
時間的・空間的プロセスという方法的要素を含む医薬用途発明を無理やり「物」というカテゴリーに書き換えさせることを出願人に強いている現在の特許法の解釈と運用は、真の発明の内容とクレームに基づく権利の及ぶ範囲との間で「ねじれ」を生んでいます。
医療行為に該当する方法の発明は特許適格性がないと判断した東京高裁判決から20年以上を経て、医療技術も大きく発展してきた現在において、本当に、特許法上「医療」と「産業」の発展を相容れないまま放置し続けても良いのでしょうか。
知財高裁の判決内容に期待しましょう。
- 2024.06.24 ブログ記事: 知的財産高等裁判所が第三者意見を募集 ― 体外と体内の狭間、組み合わせの物と方法の狭間、医療と産業の狭間の問題に注目か? ―
5.厄介?
(1)AIによる着想
2024年5月16日、東京地裁は、人工知能(AI)が自律的に生み出した発明に対して特許が認められるかという問題に対し、「特許法の発明者はあくまで自然人(人間)に限られる」との判断を下しました。
この裁判は、現代における知的財産の領域で「厄介」な問題を提起しています。AIの進化に伴い、人間による着想の介入なしにAIが独自に創作物を生み出すことができるようになってきましたが、現在の特許法では、特許を受ける権利を持つのは発明者である「自然人」とされており、AIはその対象外です。この点について、裁判所は、特許法の枠組みが人間の発明を前提として設計されており、AIが発明者として認められるためには新たな法制度の検討議論が必要であると述べました。
- 2024.05.16 ブログ記事: 2024.05.16 「A v. 特許庁長官」 東京地裁令和5年(行ウ)5001 ― 発明者は自然人に限られる。AI発明をめぐる実務上の懸念に対し立法論の検討が期待されると付言 ―

2024年ノーベル賞が物理学賞(「人工ニューラルネットワークによる機械学習を可能にする基礎的発見と発明」)に続いて化学賞も「タンパク質の計算による設計・構造予測」というAI関連研究に贈られたことは、現代の技術革新はもはやAIを抜きに考えることができないことを象徴しているように思えます。
そんなAIがもたらす技術革新が急速に進む現代では、AIによる技術貢献が増加し、知的財産権との関係がますます複雑になっていると考えられ、法律の枠組みがその進歩に追いつけず、企業がAIの創作物を適切に保護できないという「厄介」な状況に直面する場合があり得ます。この状況に対処するためには、AIがもたらす社会経済的な影響を考慮に入れた産業政策も含めた立法による新たな制度設計が必要かもしれませんが、国際的な制度の調和も必要であり、慎重な議論が求められます。
AIを活用した創作の保護の在り方や知的財産権侵害リスクに対する懸念増加を受けて、「AIと著作権に関する考え方について」(2024年3月15日:文化庁)、「AIを利活用した創作の特許法上の保護の在り方に関する調査研究」(2024年4月22日:特許庁)及びAI時代の知的財産権検討会「中間とりまとめ」(2024年5月:内閣府知的財産戦略推進事務局)が公表されました。
米国でも、AIと発明者との関係についての議論に前進がありました。米国特許商標庁(USPTO)は、2024年2月12日、AIが関与する特許の発明者に関する詳細なガイダンスを公表し、翌13日に連邦官報(Federal register)へ掲載しました。このガイダンスは、AIが発明の創作に関与した場合に、発明者をどのように決定すべきかを示しています。また、USPTOは、このガイダンスの公表とともに、審査官や出願人の理解をさらに助けるために、ガイダンスがどのように適用されるかの仮想事例を掲載しており、その仮想事例のひとつとして、Developing a Therapeutic Compound for Treating Cancer (Example 2)が示されています。これは、医薬品分野においてAI活用により創作される方法発明や化合物発明の発明者の認定に参考になると思われます。
- 2024.02.13 ブログ記事: USPTO、人工知能(AI)が関与する特許の発明者(inventorship)に関する詳細なガイダンスを公表

USPTOのウェブサイト(AI-related resources)には、AIの使用に関連する問題について、USPTOが現在提供しているガイダンスやトレーニング資料の一覧が掲載されています。また、そこにはAI使用に関連する米国特許審判部(PTAB)の決定等もリストアップされています。
(2)製造方法の侵害立証困難性と侵害回避容易性
特許権者にとって、製造方法の発明に係る特許権に基づいて権利行使する際には、二つの「厄介」な問題があります。ひとつは、被疑侵害者の侵害行為を立証するのは困難な場合が多いことです。例えば、製造方法の発明に係る特許権の侵害を立証する場合に、必要な証拠は被疑侵害者側に偏在しているという特殊性があります。
もうひとつの「厄介」な問題は、一般に、製造方法に関する特許権は技術的範囲が限定されているため、第三者に回避されやすく、製品の独占的地位を確保するのが難しい場合が多いことです。
2024年には、製造方法の発明に係る特許権侵害訴訟で、この後者の「厄介」な問題に関連して、特許権者にとって明暗が分かれた二つの事件の判決が言い渡されました。
その事件のひとつは、ノベルジン®の錠剤の製造方法の発明に係る特許権に基づき、ノーベルファーマが沢井製薬に対して後発医薬品の製造販売差止を求めていた訴訟です。2024年9月26日、東京地裁は、ノーベルファーマの請求を棄却しました。争点は、沢井製薬の製造方法が特許発明の構成要件「(乾燥して造粒物を得る工程における)品温が40℃未満」を充足するか否かでした。東京地裁は、沢井製薬から提出された製造指図記録書等からすると、沢井製薬の製造方法は品温が41℃以上になることが認められるから構成要件を充足しないと判断し、ノーベルファーマの請求を棄却しました。ノーベルファーマにとっては、この1℃の差に涙を呑む判決となりました。
- 2024.09.26 ブログ記事: ノーベルファーマ、「ノベルジン®(酢酸亜鉛水和物)」の後発医薬品を製造販売する沢井製薬に対する特許権侵害差止請求訴訟で敗訴(東京地裁)
- 2024.12.05 ブログ記事: 2024.09.26 「ノーベルファーマ v. 沢井製薬」 東京地裁令和5年(ワ)70178 ― ノベルジン®(酢酸亜鉛水和物錠)後発医薬品の製法は「(乾燥して造粒物を得る工程における)品温が40℃未満」を充足するか

もうひとつの事件は、テリボン®に関する凍結乾燥製剤の製造方法の発明に係る特許権に基づき、旭化成ファーマが沢井製薬に対して後発医薬品の製造販売差止及び本件特許権侵害行為による損害賠償の支払いを求めていた訴訟です。2024年9月26日、大阪地裁は、沢井製薬に対して、沢井製品を本件特許権の方法で製造、販売又は販売の申出をしてはならないこと、沢井製品を廃棄すること、賠償金等を支払うことを命じる判決を言い渡しました。
- 2024.12.07 ブログ記事: 2024.09.26 「旭化成ファーマ v. 沢井製薬」 大阪地裁令和4年(ワ)3344 ― 引用文献に明示されていない酸化抑制の構成を相違点と認定し、内在理論に基づいた容易想到性を否定した事例 ―
こちらの事件は、製造方法の発明(の構成)を「効果」と思える構成により特定していたことが、特許権者の勝訴に結び付きました。しかし、引用文献に明示されていないが必然的に内在する効果の構成が新規性・進歩性を否定しない一方で、第三者の行為において内在する構成が技術的範囲に含まれると判断されるのだとしたら、矛盾しているようにも見えます。このような視点を整理し、特許制度の透明性や特許性や権利侵害についての予見可能性を高める観点から議論の余地があるのではないかと思われました。
6.紹介
(1)医薬品データ保護制度
「知的財産推進計画 2024」の策定に向けた検討に役立てるため知的財産戦略本部によるパブリック・コメント募集に対して、医薬品の臨床試験データを保護する制度(医薬品データ保護制度)の法制度化が必要であることについて意見を提出しました。
- 2024.03.26 ブログ記事: 「知的財産推進計画 2024」の策定に向けた意見 ― 医薬品の臨床試験データを保護する制度(データ保護制度)の法制度化を要望 ―

韓国では、2024年2月20日、「医薬品データ保護制度」を新設する薬事法の一部改正法(法律第20328号)が公布され、2025年2月21日から施行するという最新動向も意見書の中で「紹介」したうえで、日本がグローバルスタンダードから遅れをとっている現状は、国際的な競争力の低下だけでなく、国民の健康へのアクセスにおいても不利益をもたらしており、再審査制度から独立したデータ保護制度の創設は、イノベーションを促進し、最終的には国内の公衆衛生向上と経済発展につながる重要事項であることを訴えました。
- 2024.03.21 ブログ記事: 韓国薬事法改正 医薬品の再審査制度を廃止し、イノベーティブ医薬品創出を促進する臨床試験資料保護制度(データ保護制度)新設へ 後れを取る日本

日本製薬工業協会や日本知的財産協会からもほぼ同じ内容について意見が提出されましたが、結局、知的財産推進計画2024に、「医薬品データ保護制度の創設」は検討課題として盛り込まれませんでした。
TRIPS協定(第39条(3))、日英包括的経済連携協定(第14章B7第14.42条)や日EU経済連携協定(第14章B7第14.37条)においても、臨床試験データを保護することが定められていますが、実は、この医薬品データ保護制度を規定する法律は、日本に存在しません。
日本政府は再審査制度が医薬品データ保護制度に相当するとの立場のようですが(2016.11.02 内閣官房TPP政府対策本部「TPPに関するQ&Aの公表」。CPTPPでは医薬品データ保護条項は凍結。)、そもそも再審査制度は、医薬品の品質、有効性及び安全性を再確認する制度(薬機法第14条の4)であって、製造販売業者に一定期間の調査等報告義務を課すものです。医薬品データ保護の必要性を趣旨とするものとは全く異なります。
日本では、趣旨が異なる「再審査制度」が、法律の裏付けもないまま公然と「医薬品データ保護制度」であるかのように運用され続けている歪な状況が放置されています。
日本を除く主要国・地域では、自国・自地域の公衆衛生の発展を促進するために、医薬品データ保護制度をしっかりと法制化しているにもかかわらず、日本にはそのような新薬開発にインセンティブを与える制度が法整備されていないことからも、ライフサイエンス産業の発展と公衆衛生の発展の両面を推進することが期待される政策において、日本は、残念ながら後進国であると言わざるを得ません。
日本製薬工業協会や日本知的財産協会、そして、これら国内産業界からだけでなく、PhRMA(米国研究製薬工業協会)等の海外の製薬産業界からも、日本での「医薬品データ保護制度」の法制化が以前から強く要望されています。
産業界からの要望を待つのではなく、政府もイニシアチブをとって議論を進めてほしいと思います。
(2)医薬系特許的判例ブログ年報
最後は、本の「紹介」です。
2024年5月31日、「医薬系特許的判例ブログ年報2023」を発行しました!
本書は、2023年に当ブログで注目された記事をピックアップし、書籍用に編集したものです。
当ブログの内容を一度書籍にしてみたいという自己満足のために出版社を介さず直接印刷所に依頼し製本した非売品ですが、国立国会図書館に納本され、閲覧可能な書籍として保管されました(国立国会図書館書誌ID 033498748)。
そして、2024年版も2025年春には発行して「紹介」できればと考えています。

ひょっとして、今年の漢字に「介」を選んだのは、この本を「紹介」したかったから?

出来事を振り返ると、2024年の漢字はやはり「介」で納得ですよ!

「介」といえば、久光製薬の「介(すけ)の字貼り®」を2024年のブログ記事で紹介したな。しばしば腰痛で同社製品にはたいへんお世話になっているぞ。

ボケてるんですか~ピポ先輩~。最初にも同じこと言ってましたよ~。ピポ先輩がボケて「介護」が必要になったら、私が「介抱」してあげますからね~、ピポ先輩!

・・・

7.元旦記事のお知らせ
本記事では、「介」をテーマに、「仲介」、「介入」、「お節介」、「介在」、「厄介」、「紹介」というキーワードから、2024年を賑わせた医薬系”特許的”な出来事について、振り返りました。
こうして2024年を振り返ってみて、みなさまはどのようなことを感じられましたでしょうか。
この一年の振り返りに、本記事を楽しんでいただけたなら幸いです。
ぜひ、当ブログ(https://www.tokkyoteki.com)とX(旧Twitter)(@tokkyoteki)のフォローも何卒よろしくお願いします。
・・・
最後にお知らせです。
新春「医薬系特許的判例」クロスワードパズルを、2025年元旦にブログ記事としてアップする予定です。
2025年の縁起を担いで、最速で正解のご連絡をいただいた方には「一番福」🧧の称号が勝手に付与されます。
医薬や特許が専門ではないという方も、最後のヒントで必ず解るようになっていますので、ぜひ、お気軽にチャレンジしてくださいね♪
こたつに入って、みかんを食べながら、ぜひお楽しみください。

それでは、みなさま、良いお年をお迎えください。
※前年(2023年)の振り返り記事と前回2024新春クロスワードパズルはこちら。
アシスタントたち:
Robot icons created by Freepik – Flaticon; Robot icons created by Freepik – Flaticon: Robot cat icons created by Freepik – Flaticon






コメント
>パテントリンケージのプロセスにおいては、後発医薬品の承認申請者である後発メーカーには説明の機会が与えられる一方で、先発メーカーには後発医薬品が承認申請された事実すら知らされません。
これは例外のない事実ではありません.
先発メーカーにパテントリンケージに関する問い合わせが厚労省に成されることがあります.条件やそう変更となった時期?はわかりませんが...
根本的な問題は厚労省によるブラックボックス的で安定していない運用自体であり,それによって発生することがある,先発による反論機会がないこと「がある」こと,ではないと認識しています.
情報とコメントありがとうございます
「根本的な問題は厚労省によるブラックボックス的で安定していない運用自体」、確かに根幹となる問題は仰るとおり、その点ですね。ご指摘ありがとうございます。
4.介在
(1)知財高裁が意見募集した論点
に関しまして、
2024年12月25日、知的財産高等裁判所(以下、「知財高裁」)は、令和5年(ネ)第10040号損害賠償請求控訴事件(原審:東京地裁令和4年(ワ)第5905号)を、新しい大合議事件として指定した旨をそのウェブサイトにて発表しました(知的財産高等裁判所 ウェブサイト: 新しい大合議事件の指定について)。
https://www.ip.courts.go.jp/hanrei/g_panel/index.html