Summary
本件は、ノーベルファーマが、酢酸亜鉛水和物錠の製造方法に関する特許権を沢井製薬が侵害していると主張し、沢井製薬の製品(ノーベルファーマの先発医薬品ノベルジン®の後発医薬品)の製造・販売の差止め及び廃棄を求めた事案である。
争点は、沢井製薬の製造方法が特許発明の構成要件「(乾燥して造粒物を得る工程における)品温が40℃未満」を充足するか否かであった。
東京地裁は、沢井製薬から提出された製造指図記録書等からすると、沢井製薬の製造方法は品温が41℃以上になることが認められるから構成要件を充足しないと判断し、ノーベルファーマの請求を棄却した。
また、裁判所は、傍論として、特許法104条に基づく製造方法の推定も成立しないと言及した。
一般に、製造方法に関する特許権は技術的範囲が限定されているため、第三者に回避されやすく、製品の独占的地位を確保するのが難しい場合がある。沢井製薬による後発医薬品の市場参入により、ノベルジン®のマーケットシェアはかなり浸食されていると推測される。
1.背景
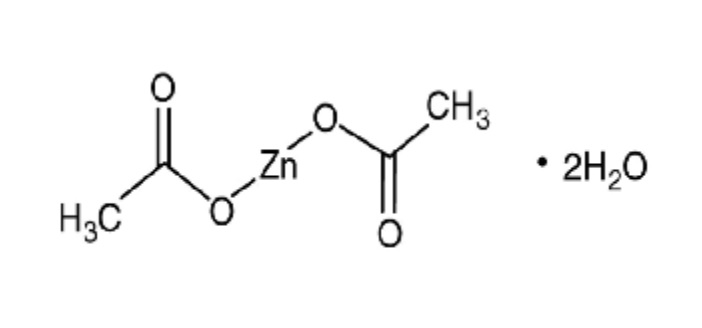 本件(東京地裁令和5年(ワ)70178)は、ノーベルファーマ(原告)が、「酢酸亜鉛水和物錠及びその製造方法」に関する特許権(特許第6716464号及び特許第6768984号)を沢井製薬(被告)が侵害していると主張し、沢井製薬の酢酸亜鉛錠25mg「サワイ」及び酢酸亜鉛錠50mg「サワイ」(以下、「被告医薬品」)の製造・販売の差止め及び廃棄を求めた事案である。
本件(東京地裁令和5年(ワ)70178)は、ノーベルファーマ(原告)が、「酢酸亜鉛水和物錠及びその製造方法」に関する特許権(特許第6716464号及び特許第6768984号)を沢井製薬(被告)が侵害していると主張し、沢井製薬の酢酸亜鉛錠25mg「サワイ」及び酢酸亜鉛錠50mg「サワイ」(以下、「被告医薬品」)の製造・販売の差止め及び廃棄を求めた事案である。
被告医薬品は、ノーベルファーマが製造・販売する先発医薬品「ノベルジン®」(ノベルジン®錠25mg及びノベルジン®錠50mg)の後発医薬品に該当する。
ノベルジン®は、酢酸亜鉛水和物(Zinc Acetate Hydrate)を有効成分とし、2008年1月25日にウィルソン病治療薬として承認、同年4月に販売が開始された。さらに、2017年3月24日に低亜鉛血症への適応追加が承認され、2021年1月22日には小児低亜鉛血症用の新用量が承認された。
ノベルジン®の再審査期間は以下のとおり満了しており、現時点におけるノベルジン®の独占期間は、同薬を保護する特許権に依存する状況にある。
- ウィルソン病(肝レンズ核変性症) :10年間(満了年月:2018年1月)
- 低亜鉛血症:5年10ヵ月間(満了年月:2023年1月)
本件発明1及び2(以下、「本件発明」)は、錠剤の製造方法に関するものであり、それらの特許権の存続期間満了日はいずれも2035年12月2日である。現時点で、無効審判請求はされていない。
(1)本件特許1(特許第6716464号)の特許請求の範囲の請求項1の記載
(2)本件特許2(特許第6768984号)の特許請求の範囲の請求項1の記載
沢井製薬は、ノベルジン®の後発医薬品である被告医薬品の製造販売承認(ウィルソン病)を2023年2月15日に取得し、同年6月7日に低亜鉛血症の適応追加承認も受けたうえで、同月16日に薬価収載、同年8月4日から製造販売を開始した。
本件における争点は、被告医薬品を製造するにあたって沢井製薬が採用する方法(以下、「被告方法」)が本件発明の構成要件である「乾燥して造粒物を得る工程」における「品温が40℃未満」を充足するか否かである。
具体的には、被告方法の製造工程には全体で40℃を超える部分が含まれるため、「乾燥して造粒物を得る工程」の終期がいつであるかが争われた。
ノーベルファーマは、「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」(この時点までの乾燥を「必要な乾燥」といい、その後の乾燥は「余分な乾燥」という)であると主張し、一方、沢井製薬は「乾燥を終了した時点」であると主張した。
2.裁判所の判断
東京地方裁判所民事第40部(以下、「裁判所」)は、被告方法は本件発明の技術的範囲に属さず、ノーベルファーマの請求には理由がないとして請求を棄却する判決を下した。
1 原告の請求をいずれも棄却する。
2 訴訟費用は原告の負担とする。
(1)争点1-2: 「品温が40℃未満」の該当性
本件で中核となる争点は、「乾燥して造粒物を得る工程」の終期がいつであるかという点であった。
これについて、ノーベルファーマ(原告)は、「乾燥して造粒物を得る工程」の終期とは「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」である旨主張した(原告はこの時点までの乾燥を「必要な乾燥」といい、これ以降の乾燥を「余分な乾燥」として区分している)。
しかし、裁判所は、被告方法について、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を満たしていないと判断した。
「そこで検討するに、本件明細書に係る前記認定事実によれば、本件明細書の記載(【0010】、【0033】等)を踏まえると、本件発明の課題は、酢酸亜鉛水和物中の結晶水が消失して無水物に転移することを防ぐことにあり、その課題の解決手段としては、乾燥工程における品温を40℃未満とするものであると認めるのが相当である。そして、「乾燥」とは、一般的に熱を与えるなどして不要の液体分を取り除くことを意味するものであり(甲9、10)、本件明細書においても、上記と異なる意味で使用されているところはない。
そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであり、その終期とは、文字どおり、全ての乾燥が終了した時点であると解するのが相当である。
これを原告の上記主張についてみると、原告は、乾燥には「必要な乾燥」と「余分な乾燥」に区分され、「余分な乾燥」では40℃を超えることが許容される趣旨をいうものである。
しかしながら、本件発明の構成要件及び本件明細書を精査しても、原告が自認するように、「必要な乾燥」と「余分な乾燥」に区分されるという原告の解釈を裏付ける記載や示唆は一切なく、上記の間にある「打錠用粉体に適した造粒物を得るために必要な状態まで溶媒が除去された時点」という原告主張に係る概念も、本件発明の構成要件及び本件明細書に一切記載されておらず、それ自体明確性を欠くことに鑑みても、原告の主張は、その根拠を欠くものというほかない。
かえって、原告の主張によれば、「余分な乾燥」では40℃を超えることが許容されることになるから、乾燥工程における品温を40℃未満とする本件発明の課題解決手段に明らかに抵触するものとなり、本件明細書によれば本件発明の課題を解決できないことになる。そうすると、原告の主張は、本件発明の課題解決手段を正解しないものといえる。
したがって、原告の主張は、採用することができない。
・・・
前記認定事実によれば、被告医薬品の医薬品製造販売承認書には「乾燥終点における製品温度は《50℃》以下とする」と記載されており、被告医薬品に係る製造指図記録書においては、いずれも、品温41.0℃以上で乾燥終了との指示がされていることからすると、被告方法における「乾燥して造粒物を得る工程」では、品温が41℃以上になることが認められる。そうすると、「乾燥して造粒物を得る工程」とは、乾燥させる全ての工程を意味するものであるから、被告方法は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を充足するものとはいえない。」
(2)争点1-1: 特許法104条に基づく推定の可否
裁判所は、前記のとおり、被告方法は「乾燥して造粒物を得る工程」における「品温が40℃未満」という構成要件を満たしていないと認定しているため、特許法104条に基づき被告医薬品が本件発明の製造方法によって生産されたと推定できるか否か(争点1-1)は本件の結論に影響しない。
しかし、当事者双方の主張経過に鑑み、裁判所は補足的に説示し、被告医薬品について特許法104条に基づく本件発明の製造方法による生産の推定は成立しないとも判断した。
「前提事実及び前記認定事実によれば、本件発明の優先日前に出された本件ニュースリリースには、「NPC-02(酢酸亜鉛)ウイルソン病治療剤ノベルジン®錠25mg及び50mgの製造販売承認(剤形追加)を取得」という記載があるところ、本件ニュースリリース前から原告によって販売されているノベルジンカプセル25mg及び50mgは、ウィルソン病治療剤(銅吸収阻害剤)であり、酢酸亜鉛水和物を有効成分とするカプセル剤である。そして、前記認定事実によれば、剤形追加に係る医薬品とは、既承認医薬品等と有効成分、投与経路、効能・効果及び用法・用量は同一であるが、剤形又は含量が異なる医薬品をいうことからすると、本件ニュースリリースに係る医薬品は、ウィルソン病治療剤(銅吸収阻害剤)であり、酢酸亜鉛水和物を有効成分とする酢酸亜鉛錠であるものと認められる。
これらの事情の下においては、本件ニュースリリースに係る医薬品は、本件発明により生産される物と同一のものといえるから、本件ニュースリリースの掲載により同医薬品の存在が対外的に公表されているといえる。そうすると、本件発明により生産される「物」は、本件発明の優先日前の時点において、当業者がその物を製造する手がかりが得られる程度に知られたものであったと認めるのが相当である。
したがって、被告医薬品は、特許法104条に基づき、本件発明に係る製造方法により生産したものと推定することはできない。
・・・
これに対し、原告は、本件ニュースリリースでは、①「酢酸亜鉛」が「酢酸亜鉛水和物」なのか「酢酸亜鉛無水和物」なのかも判別することができず、②「賦形剤」、「結合剤」、「崩壊剤」を含むかどうかも明らかではなく、③上記にいう「その物を製造する手がかり」とは、本件発明に係る製造方法に他ならない旨主張する。
しかしながら、①本件ニュースリリースの記載からすれば、本件ニュースリリースに係る医薬品はノベルジン®カプセル25mg及び50mgの剤形追加であるから、上記医薬品と同様に、酢酸亜鉛水和物を有効成分としていることは明らかであり、②前記認定事実によれば、錠剤の製造においては、有効成分のみで錠剤を形成することは通常あり得ず、賦形剤、結合剤及び崩壊剤が含まれ得ることは、技術常識であるといえ、③原告の主張の実質は「物」のみならず「製造方法」までも公然と知られていたことを要する趣旨をいうものであり、独自の見解というほかなく、原告の上記主張は、いずれも前記認定を左右するに至らない。したがって、原告の主張は、いずれも採用することができない。」
3.コメント
(1)特許法104条
裁判所は、被告方法は本件発明の構成を充足しないと判断したことで、特許法104条による推定の可否(争点1-1)を判断する必要はなかったわけであるが、「念のため」判断した。
特許法104条が争点となることは近年において珍しい。
特許法が化合物それ自体についての発明を特許することができない発明として規定されていた時代に、証明責任の転換を図って新規化合物開発のインセンティブを保つ目的で制定されたのが104条の大きな意義であったようだが、化合物自体の発明が認められるようになった現代において、同条が活用されることは少なくなった。
むしろ104条は、被疑侵害者が秘匿しておきたい生産方法を開示させ知得する目的で利用する濫用の危険性を抱えており、その適用は慎重にすべきであるとの課題が提起されている(参考: 吉田広志 「特許法104条の生産方法の推定に関する現代的解釈」 パテント Vol.76, No.1, p90-101 (2023))。
第104条 物を生産する方法の発明について特許がされている場合において、その物が特許出願前に日本国内において公然知られた物でないときは、その物と同一の物は、その方法により生産したものと推定する。
ノーベルファーマとしては、被告方法において「40℃未満」で乾燥している証拠を得るために、104条の適用を主張したのだろう。
しかし、裁判所は、「本件発明により生産される「物」は、本件発明の優先日前の時点において、当業者がその物を製造する手がかりが得られる程度に知られたものであったと認めるのが相当である」と説示して、104条に基づく推定を否定した。
本判決で説示された104条の「公然知られた」物の解釈については、2022.02.09 「大塚製薬 v. AMC」 令和2年(ネ)10059 特許権侵害差止請求控訴事件において知財高裁が説示した「その物が特許法104条の『公然知られた』物に当たるといえるには,基準時において,少なくとも当業者がその物を製造する手がかりが得られる程度に知られた事実が存することを有するというべき」との基準に沿うものであり、104条についての適用可否を判断してきたそれ以前の裁判例とも整合していそうである。
(2)沢井製薬による特許回避
沢井製薬が、本件発明の「40℃未満」という構成要件から逃れることができたのは偶然ではないはずだ。
ノーベルファーマの本件特許1(特許第6716464号)及び本件特許2(特許第6768984号)の審査経過は以下の時系列を辿っている。
- 国際出願PCT/JP2015/083941(国際出願日は2015年12月2日、国際公開日は2016年6月9日)は、日本での国内書面手続きを経て(特願2016-562663、再公表発行日: 2017年9月14日)、審査請求がなされ、拒絶理由通知に対する意見書とともに、請求項1については以下のように補正する手続補正書が提出された(2019年9月26日)。
(1)酢酸亜鉛水和物(C4H6O4Zn・2H2O)、賦形剤、崩壊剤及び溶媒の混合物を造粒した後乾燥して造粒物を得る工程、(2)該造粒物を打錠して素錠を得る工程を含み、前記工程(1)における品温が40℃未満であることを特徴とする、
酢酸亜鉛水和物錠の製造方法。
- 再度の拒絶理由に対して、請求項を1から3だけにする補正を行い、特許査定を得て(2000年5月)、特許第6716464号として登録に至った(登録日は2020年6月12日、発行日は2020年7月1日)。
- 上記特許出願から2020年6月8日にされた分割出願(特願2020-099061)の特許請求の範囲は、以下のような請求項1及びそれに従属する他の請求項であった(出願公開日は2020年8月27日)。
- こちらの分割出願も拒絶理由通知を受けたものの、「前記工程(1)における品温が40℃未満であることを特徴とする」構成は変わることなく、特許査定を得て(2020年9月)、特許第6768984号として登録に至った(登録日は2020年9月25日、発行日は2020年10月14日)。
- さらにもうひとつの分割出願(特願2019-176266、出願日は2019年9月26日)も存在したが(公開日は2019年12月19日)、拒絶理由通知(2020年9月)及び拒絶査定(2021年3月)のいずれにも応答せず、拒絶査定が確定した。
一方、沢井製薬の被告医薬品の医薬品製造販売承認書(承認日は2023年2月15日)には「乾燥終点における製品温度は《50℃》以下とする」と記載されており、また、証拠として提出された以下の資料:
- 被告医薬品の治験薬に係る製造指図記録書(甲8)(作成日は2020年9月)
- プロセスバリデーションに係る製造指図記録書(乙31、37)(作成日は2022年10月)
- 被告医薬品の販売開始直前期の製造指図記録書(乙38)(作成日は2023年6月)
においては、いずれも、品温41℃以上で乾燥終了との指示がされていた。
以上のように、本件特許の審査経過と沢井製薬の製造指図記録の時期を照らしあわせてみると、沢井製薬は、「品温が40℃未満」を必須とする構成で本件特許1(特許第6716464号)が登録されたこと(2020年7月)及びそれからの分割出願もその構成を備えた請求項であったこと(公開2020年8月)を見届けた上で、その構成に該当しない「品温が41℃以上」に達するようにする被告医薬品の治験薬に係る製造指図記録書(甲8)を作成(2020年9月)、つまりその製造条件による治験薬の製造を進めたのではないかと容易に想像できる。
少なくとも被告医薬品のプロセスバリデーションに係る製造指図記録書(乙31、37)の作成時(2022年10月)には、本件特許は新たな分割出願も存在せず、審査に係属中の出願は無かったことから、「品温が41℃以上」に達しさえすれば、本件発明の技術的範囲には属さないとの判断のもと、被告方法により製造される被告医薬品の承認申請作業を進めていたと想像できる。
沢井製薬は、本件において、「被告方法において、乾燥終点における品温を41℃以上50℃以下と定めているのは、本件発明が定める『品温が40℃未満である』を単に1度上回ったという消極的な理由によるものだけでなく、平衡含水率まで水分を除去し、乾燥の目的を最大限達成するという積極的な技術的意義を有する者である」と主張している。
沢井製薬は、「乾燥して造粒物を得る工程」における「品温が40℃未満」という本件特許の構成要件を充足することがないように品温を41℃以上まで達するように定める一方で、酢酸亜鉛水和物中の結晶水が消失しないように品温を50℃以下に製造プロセスを決定しており、本件特許の審査経過を注意深く監視しながらも、その範囲を回避するための技術的な検討も努力されたのだろう。

本件発明は「40℃未満」で乾燥するのに対して、被告方法は「41℃以上」まで乾燥・・・。41℃に達するまでには40℃未満での乾燥時間もあるわけだから、原告の悔しさも分からんでもないが・・・

ピポ先輩~。特許法第70条では「特許発明の技術的範囲は、願書に添付した特許請求の範囲の記載に基づいて定めなければならない。」と規定していますからね。その範囲を超えて保護したかったのなら、超える範囲も保護できるような明細書の記載や特許請求の範囲の工夫が必要だったのかもしれませんね。

・・・
(3)ノーベルファーマによる後発医薬品対抗策
ノーベルファーマは、この判決を不服として、知財高裁に控訴することを発表している(2024.09.26 ノーベルファーマ press release: ウィルソン病治療剤(銅吸収阻害剤)・低亜鉛血症治療剤「ノベルジン®錠25mg、同 50mg」(以下、ノベルジン)に関する特許権侵害訴訟の知的財産高等裁判所への控訴について)。
しかし、被告医薬品(酢酸亜鉛錠25mg「サワイ」及び酢酸亜鉛錠50mg「サワイ」)は2023年8月4日から製造販売されており、しかも、沢井製薬の酢酸亜鉛顆粒5%「サワイ」(こちらは錠剤ではないため本件とは無関係)も2024年2月に承認されて同年6月から販売開始に至っているため、ノベルジン®のマーケットシェアはこれら後発医薬品によってかなり浸食されていると推測される。
参考: 沢井製薬 press release
- 2023.02.15 ジェネリック医薬品3成分10品目の製造販売承認を取得
- 2023.06.07 酢酸亜鉛錠25mg/50mg「サワイ」 -「効能又は効果」「用法及び用量」追加承認取得のお知らせ-
ノーベルファーマは、これら後発医薬品の市場参入への対抗策として、ノベルジン®のオーソライズド・ジェネリック(AG)を市場に投入したが、それらの発売時期は、沢井製薬の後発医薬品の発売から4ヵ月ほど後になってしまった。
参考: ノーベルファーマ press release
- 2023.04.19 「ノベルジン」特許に関する特許権侵害訴訟の提起について
- 2023.06.23 ウィルソン病治療剤(銅吸収阻害剤)・低亜鉛血症治療剤「ノベルジン®」のオーソライズド・ジェネリック医薬品に関するライセンス契約の締結について
- 2023.08.15 ウィルソン病治療剤(銅吸収阻害剤)「ノベルジン®」ダイト株式会社によるオーソライズド・ジェネリック(AG)製造販売承認取得のお知らせ(ダイト株式会社が承認申請を行い、ウィルソン病(肝レンズ核変性症)を効能又は効果とする製造販売承認を取得)
- 2023.12.06 ウィルソン病治療剤(銅吸収阻害剤)『ノベルジン®』ダイト株式会社によるオーソライズド・ジェネリック(AG)『効能又は効果』の追加承認取得のお知らせ(「低亜鉛血症」を効能又は効果とする追加承認を取得)
- 2023.12.08 ダイト株式会社によるオーソライズド・ジェネリック(AG) 酢酸亜鉛錠 25mg・同 50mg「ノーベル」新発売のお知らせ
- 2024.02.15 ウィルソン病治療剤(銅吸収阻害剤)/ 低亜鉛血症治療剤 ダイト株式会社によるオーソライズド・ジェネリック(AG)酢酸亜鉛顆粒 5%「ノーベル」製造販売承認取得のお知らせ
- 2024.06.14 ウィルソン病治療剤(銅吸収阻害剤)/ 低亜鉛血症治療剤 ダイト株式会社によるオーソライズド・ジェネリック(AG)酢酸亜鉛顆粒 5%「ノーベル」発売のお知らせ

ノーベルファーマの2023年12月期 事業報告書によると、ノベルジン®の後発医薬品の参入は実績に大きく影響したようです。2023年度のノーベルファーマの売上高合計は 19,027 百万円。その内、ノベルジン製品群(ノベルジン、ノベルジン顆粒、ノベルジンAG)は9,396 百万円であり、49.6%を占めます。

2024年12月期の業績もノベルジン®の後発医薬品の影響を大きく受けることが見込まれ、減収減益を予想しているようである・・・

ノベルジン®を守る特許として、製法発明に関するものしかない・・・となると、やはり回避策を講じられやすいので、ノーベルファーマにとっては、かなり厳しい戦いですね~ピポ先輩。


コメント