2024年7月16日、欧州統一特許裁判所(Unified Patent Court、以下「UPC」)の中央部(ミュンヘン支部)は、Amgen社の特許EP3666797B1が進歩性を欠くとして無効との判決を下しました。
問題となったのは、機能的に表現された抗PCSK9抗体クレームです。
参照: Sanofi v. Amgen, Registry number ACT_459505/2023 UPC_CFI_1/2023)
高コレステロール血症治療剤、具体的には抗PCSK9抗体製剤において、特許権者であるAmgen社(製品名: Repatha®)と、特許無効を主張したSanofi社(製品名: Praluent®)は、競争関係にあります。
この判決は、統一特許裁判所協定(Agreement on a Unified Patent Court: UPCA)に加盟するEUの17加盟国(オーストリア、ベルギー、ブルガリア、デンマーク、エストニア、フィンランド、フランス、ドイツ、イタリア、ラトビア、リトアニア、ルクセンブルク、マルタ、オランダ、ポルトガル、スロベニア、スウェーデン)全てにおいて、特許が無効となるセントラルアタック(central revocation)を認めた医薬分野における初の事例です。
特許権者であるAmgen社はこの判決に対して控訴することができます。
Claim 1.
A monoclonal antibody or an antigen-binding fragment thereof for use in
treating or preventing hypercholesterolemia or an atherosclerotic disease related to elevated serum cholesterol levels;
or for use in reducing the risk of a recurrent cardiovascular event related to elevated serum cholesterol levels;
wherein the monoclonal antibody or the antigen-binding fragment thereof binds to the catalytic domain of a PCSK9 protein of the amino acid sequence of SEQ ID NO: 1, and prevents or reduces the binding of PCSK9 to LDLR.
UPCは、PCSK9を標的とする高コレステロール血症治療薬の開発に関心を持つ当業者であれば、Lagace et al. 2006(先行文献)の教示から出発し、その教示に従うことで、PCSK9とLDLRとの相互作用を阻害するPCSK9に対する抗体を開発し、結果的に請求項に係る主題に自明な方法で到達するであろうと判断しました。
The skilled person would arrive at antibodies falling under the claim
8.66 Defendant argued (in an auxiliary way) that even if the skilled person would have started a research program to develop antibodies against PCSK9, the result would not inevitably have led to one that is within the scope of claim 1 (par. 301 et seq. DtCC, par. 2 reply in the CC dated 21 March 2024).
8.67 As a preliminary point, the Central Division is of the opinion that for assessing inventive step it is not the question whether the skilled person would inevitably, i.e. invariably each and every time they are set out on a particular course of action based on the prior art, arrive at the same result (falling within the scope of the claim or not). Rather, it is sufficient (but also necessary) for denying inventive step that the skilled person would without inventive contribution arrive at a result which is covered by the claim. In the present case, ending up with antibodies that fall under the scope of the claims of the Patent, including antibodies that bind to the catalytic domain of PCSK9, was obvious.
8.68 It is not in dispute that at the priority date, the skilled person generally knew how to generate (monoclonal) antibodies to a given protein target and that such antibodies could be screened functionally for their ability to inhibit the interaction between the target and another protein such as a receptor in an appropriate assay. The skilled person would have realised that making antibodies and setting up the screening methods may require considerable time and resources, but to do so does not constitute an “undue burden” in patent law terms. Accordingly, the Patent mentions in par. [0201]-[0210] several methods to generate (monoclonal) antibodies. These methods include phage display technology, hybridoma technology and the use of transgenic mice. It is also not in dispute between the parties that these methods were known and routine at the priority date (cf. the technical background section above and E6, par. 39-41).
8.69 It is furthermore not in dispute that the catalytic domain of PCSK9 could not be expressed and purified in isolation. According to the Defendant, the entire PCSK9 protein can be used as an antigen to immunize the transgenic mice as demonstrated in the Patent (292 et seq. R, also see 64 Case summary). Accordingly, the skilled person would have used the whole PCSK9 protein as an antigen to obtain anti-PCSK9 antibodies in following Lagace’s suggestion to develop antibodies against PCSK9 that block the interaction between LDLR and PCSK9.
8.70 After generating antibodies against PCSK9 using any of the above methods (whereby the Central Division reiterates that the claims are not limited to any particular method of generating antibodies), the next step will be to screen antibodies to confirm binding to PCSK9 and for their activity to block the interaction of PCSK9 and the LDLR. As mentioned above, it is not in dispute that these steps of finding selecting antibodies that bind to a particular target and are functionally active were, as such, routine steps and that the skilled person at the priority date (and long before) was in a position to carry out these without undue burden. See e.g. the Defendant in par. 350 DtCC (in the context of sufficiency of disclosure) comparing EPO Technical Board of Appeal case T431/96 to the present case:
“6. The written description of how hybridomas secreting a monoclonal antibody with the desired features have been produced consists basically of the sequence of the widely known routine technical steps where all that is normally called for is perseverance. As the said monoclonal antibody is characterised by its reactivity/non-reactivity with given products (cf. claim 1), this being readily testable in an assay, the skilled person seeking to reproduce the invention will have to produce monoclonal antibodies by routine methods and test them singly in an assay. This may possibly involve some tedious and time-consuming work, but nothing out of the ordinary since the techniques for the production and selection of hybridomas were common routine techniques at the priority date of the patent in suit (i.e. 17 March 1983).”
クレームに表現された抗体の取得に相当な時間及び労力を要したとしても、それだけで法律上の「過度な負担(undue burden)」を満たすとは限りません。
抗原が既知であり、当業者が技術常識に基づくルーチンなステップを踏むことで抗体を取得できる場合、その抗原に対する抗体を広範に包含する機能的に表現された抗体クレームは進歩性を欠くとされる可能性があります。
この判決で注目すべき点は、UPCがSanofi社の製品Praluent®をも包含すると思われるAmgen社の本件抗体クレームを無効と判断したことで、UPCミュンヘン支部で並行して審理されている同特許に基づく侵害訴訟(ACT_459916/2023)の結論に大きな影響が出てくると思われることです。

UPCを介して特許侵害訴訟(central enfoecement)を提起しているんだね
また、機能的に表現された抗体クレームに対する特許性判断のアプローチが、同特許に対応する米国特許についてのアプローチとは異なる点であったことも注目すべき点と思われます。
米国では同じ結論(無効)に至ったものの、その理由として実施可能性を欠くと判断されました(ブログ記事 「【速報】2023.05.18 「Amgen v. Sanofi」 米国最高裁No. 21–757 - Amgenの抗PCSK9抗体特許 実施可能要件非充足を理由に無効としたCAFC判決を米国最高裁も支持 -」参照。さらに機能的に表現された抗体クレームが争われた別事件に関してブログ記事「機能的表現抗体クレイムの終焉か ―Amgen事件米国最高裁判決を受けBaxalta社の抗体特許を無効とする判決(Baxalta v. Genentech CAFC 2022-1461)―」参照)。

機能的に表現された抗体クレームによる特許を取得したい出願人にとって、米国では実施可能要件を満たすために当業者の技術常識に基づいて過度な負担なくクレームに包含されるそれら抗体を取得できると主張することが、欧州UPCでは、先行文献に基づいて過度な負担なくクレームに包含されるそれら抗体を取得できる、すなわち、自ら進歩性を否定することを認めているかのような、特許性主張のジレンマに陥る可能性があります。
米国でも欧州(UPC)でも、機能的に表現された抗体クレームが実施可能要件または進歩性のいずれもクリアすることは非常に困難といえますが、それでも特許取得にチャレンジする出願人は、米国と欧州(UPC)で特許性の主張の力点を使い分ける戦術が必要でしょう。
さらに、同特許に対応する日本特許についても、日本ではサポート要件を満たさないとした判決が出ています(ブログ記事 「2023.01.26 「リジェネロン v. アムジェン」 知財高裁令和3年(行ケ)10093 ―「参照抗体と競合する」抗体クレームのサポート要件充足性と発明特定事項の意義―」参照)。
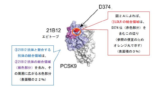
欧州においても、機能的に表現された抗体クレームの特許性には高いハードルがあるということが明らかとなりました。UPCの判断の一貫性については、今後の判決の蓄積を待つ必要があるでしょう。
この決定を受けて、UPCミュンヘン支部で並行して審理されている同特許に基づく侵害訴訟(ACT_459916/2023)がどのように進展するか注目されます。



コメント