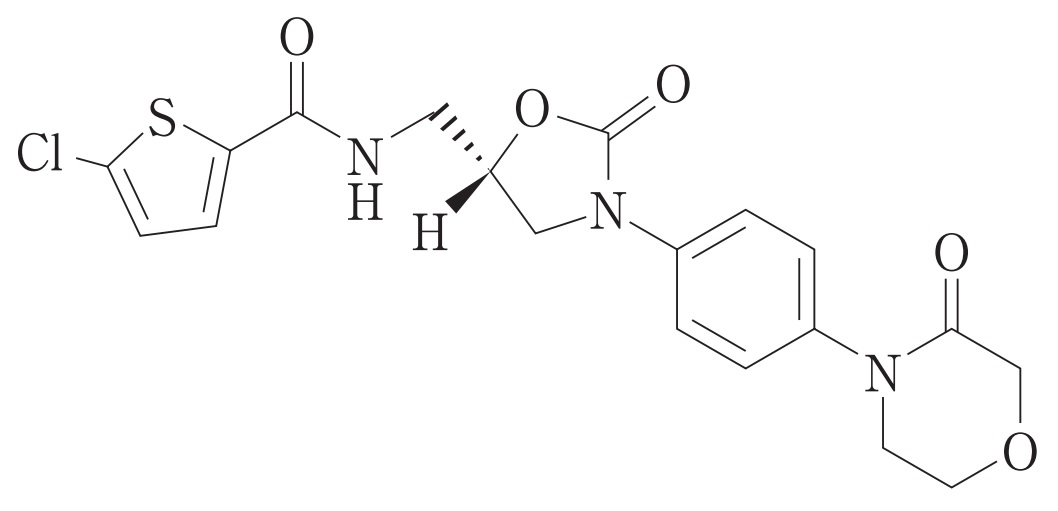
2024年7月29日、バイエル薬品より「リバーロキサバンに関する特許権について」の謹告文が掲載されました(2024.07.29 日刊薬業 【謹告】リバーロキサバンに関する特許権について)。
この謹告文は、2020年12月4日(過去記事)、2021年6月28日(過去記事)、2022年2月1日(過去記事)、2023年7月22日(過去記事)の謹告と同様に、リバーロキサバンを有効成分とする製品の製造、販売、輸入等を計画している後発医薬品メーカーに対して、特許権侵害行為をしないよう注意喚起するものです。
「当社は、リバーロキサバンを有効成分とする製品を保護する特許として、日本特許第4143297号、同第4852423号、同第5147703号、同第5311742号、および同第5416408号の5件の特許を保有しており、そのうち同第4143297号、同第4852423号および同第5311742号については、特許延長登録を取得済みです。当社は、これら特許および特許延長登録は有効であると共に、実効性があるものと確信しております。とくに、有効成分リバーロキサバンにかかる特許第4143297号の特許存続期間は5年延長されております点には是非ご留意ください。」
1.リバーロキサバン
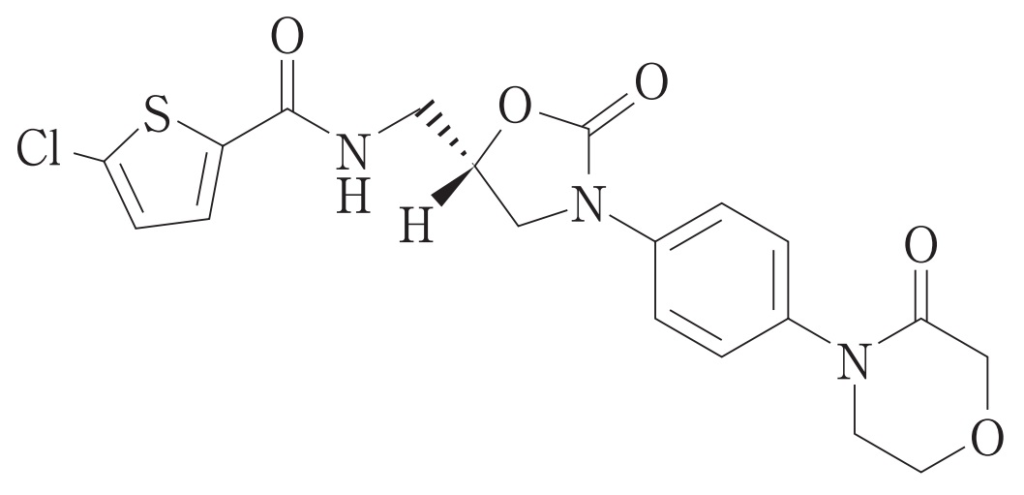 リバーロキサバン(rivaroxaban)は、Bayer社で開発された選択的直接作用型第Ⅹa因子阻害剤イグザレルト®(Xarelto®)の有効成分です。
リバーロキサバン(rivaroxaban)は、Bayer社で開発された選択的直接作用型第Ⅹa因子阻害剤イグザレルト®(Xarelto®)の有効成分です。
イグザレルト®(Xarelto®)は、Bayer社の主力製品で、2020年には同社による世界売上高は4,515M€となりました(Bayer 2020 Annual report)。また、イグザレルト®(Xarelto®)は、2020年世界で最も売れた医薬品(トップ5)のひとつといわれています(AnswersNews 更新日2021.06.21 2020年 世界で最も売れた医薬品は)。
承認ヒストリー
国内では、以下のとおり、バイエル薬品が、イグザレルト®の効能又は効果或いは製剤について承認を得てきました。
- 2012年1月18日、普通錠10mg及び15mg、「成人:非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」
- 2015年9月24日、普通錠10mg及び15mg、「成人:静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制」
- 2015年9月28日、細粒分包10mg及び15mg、「成人:非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」
- 2015年12月2日、細粒分包10mg及び15mg、「成人:静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制」
- 2020年8月6日、口腔内崩壊(OD)錠10mg及び15mg、「成人:非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」及び「成人; 静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制」
- 2021年1月22日、普通錠10mg及び15mg、細粒分包10mg及び15mg、OD錠10mg及び15mg、ドライシロップ小児用51.7mg及び103.4mg、「小児:静脈血栓塞栓症の治療及び再発抑制」
- 2022年6月20日、普通錠2.5mg、「成人:下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制」
- 2023年11月24日、普通錠2.5mg、普通錠10mg、細粒分包10mg、OD錠10mg、ドライシロップ小児用51.7mg及び103.4mg、「小児:Fontan手術施行後における血栓・塞栓形成の抑制」
再審査期間
以下のとおり、「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」及び成人の「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」について、再審査期間は終了しています。
- 「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」(SPAF)及び「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」(成人 VTE)
8 年(2012 年 1 月 18 日~2020 年 1 月 17 日)(終了) - 「静脈血栓塞栓症の治療及び再発抑制」(小児 VTE)
4 年(2021 年 1 月 22 日~2025 年 1 月 21 日) - 「下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制」(PAD)
4 年(2022 年 6 月 20 日~2026 年 6 月 19 日) - 「Fontan 手術施行後における血栓・塞栓形成の抑制」(小児 Fontan 手術後)
4 年(2023 年 11 月 24 日~2027 年 11 月 23 日)
2.物質特許に係る延長特許権の存続期間
謹告文では、
「とくに、有効成分リバーロキサバンにかかる特許第4143297号の特許存続期間は5年延長されております点には是非ご留意ください。」
と強調されていますが、その物質特許第4143297号に係る特許権の存続期間について5年の延長を得ることができているのは、2015年9月24日にイグザレルト®普通錠10mg/15mgが「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」の効能又は効果の承認に基づいて取得した延長登録です。
実際、同特許に係る特許権の存続期間は、以下のとおり、効能又は効果と製剤毎に短冊状に延長されています。
そして、現在、同特許については、普通錠10mg/15mgの「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」の効能又は効果についての承認に基づいて延長された存続期間以外の延長期間は全て満了しています。
- 非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制
・普通錠10mg/15mg: 2020.12.11+3y6m28d延長(現在、延長期間満了)
・細粒分包10mg/15mg: 2020.12.11+1y8m7d延長(現在、延長期間満了)
・OD錠10mg/15mg: 2020.12.11+1y6m21d延長(現在、延長期間満了) - 深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制
・普通錠10mg/15mg: 2020.12.11+5y延長
・細粒分包10mg/15mg: 2020.12.11+1y10m11d延長(現在、延長期間満了)
・OD錠10mg/15mg: 2020.12.11+1y6m21d延長(現在、延長期間満了)
3.後発医薬品は8月に承認か?
再審査期間が終了した「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」の効能又は効果について、この8月中旬に、とうとうオーソライズドジェネリック(AG)以外での後発医薬品の承認がされるのでしょうか。物質特許第4143297号以外も謹告文には複数の特許(製剤製法発明、原薬製法発明、製剤発明、結晶発明に関する)が挙げられていますが、後発医薬品はこれらを回避したものであるという可能性は大いにあり得ます。
さらに、同じく再審査期間が終了した成人の「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」の効能又は効果について、細粒分包又はOD錠の後発医薬品の承認もあり得るのでしょうか。普通錠での承認に基づいて延長された物質特許に係る特許権の効力が製剤違いの後発医薬品にも及ぶのかどうかという議論がありますが、厚生労働省がその効力を判断できるとは思えません。そのような状況で、厚生労働省が裁判所の判断を待つことなく、物質特許が存在するにもかかわらずパテントリンケージを解除してしまう(承認する)のか、延長期間が満了するまでパテントリンケージを発動しつづける(承認しない)のか・・・(パテントリンケージについては、ブログ記事「日本のパテントリンケージの現状の課題とその解決に向けた提案」をご参照ください)。

2022年2月17日付のミクスOnline「バイエルホールディング イグザレルト後発品はAG 子会社が承認取得」によると、バイエルホールディング100%子会社のバイエル薬品販売が2022年2月15日に承認を取得したイグザレルト®の初の後発医薬品は、バイエルホールディングがAGであること明らかにしたとのことです。
後発医薬品の参入に備え、バイエル薬品側は、AGを市場投入して対抗する準備は万全のようです。
4.過去ブログ記事



コメント
2024年8月15日、イグザレルト®(リバーロキサバン)にとうとうAG以外の後発医薬品(6社)が承認された。
https://www.mhlw.go.jp/hourei/doc/tsuchi/T240815I0010.pdf
これを受け、バイエルも第一三共エスファと組んでAGの情報提供活動を開始。
2024.08.19 バイエル ホールディング/第一三共エスファ press release: オーソライズド・ジェネリック「リバーロキサバン『バイエル』」の情報提供を 第一三共エスファが開始
「両社の国内販売提携に基づき、バイエル ライフサイエンスが厚生労働省より製造販売承認を取得した選択的直接作用型第Ⅹa因子阻害剤(経口抗凝固薬)リバーロキサバン錠10mg「バイエル」/同15mg「バイエル」およびリバーロキサバンOD錠10mg「バイエル」/同15mg「バイエル」の情報提供活動を第一三共エスファが本日開始したことをお知らせします。本剤は、イグザレルトⓇ錠10mg/15mg、イグザレルトⓇOD錠10mg/15mg(一般名:リバーロキサバン)のオーソライズド・ジェネリック(以下「AG」)です。」
https://www.daiichisankyo-ep.co.jp/news/post-53.html
2024年12月5日、イグザレルト®(リバーロキサバン)の後発医薬品(AGを含む7社18品目)が薬価収載官報告示されました。
先発品が5つの適応に対して、AGは2つの適応、それ以外の後発医薬品の適応は1つの適応(特許延長期間が満了した「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」)となっているようです。
(ミクスOnline https://www.mixonline.jp/tabid55.html?artid=77563より)