1.2024年スペシャル301条報告書(2024 Special 301 Report)
 スペシャル301条報告書(Special 301 report)とは、1974年米国通商法182条(IDENTIFICATION OF COUNTRIES THAT DENY ADEQUATE PROTECTION, OR MARKET ACCESS, FOR INTELLECTUAL PROPERTY RIGHTS)に基づき、知的財産の保護と執行の世界的な状況について米国議会が義務付けている年次レビューの結果を反映したものであり、知的財産の保護と執行の適切性と有効性について問題のある国を、問題の大きな順から「優先国(priority foreign country)」、「優先監視国(priority watch list)」、「監視国(watch list)」の3段階に指定しています。
スペシャル301条報告書(Special 301 report)とは、1974年米国通商法182条(IDENTIFICATION OF COUNTRIES THAT DENY ADEQUATE PROTECTION, OR MARKET ACCESS, FOR INTELLECTUAL PROPERTY RIGHTS)に基づき、知的財産の保護と執行の世界的な状況について米国議会が義務付けている年次レビューの結果を反映したものであり、知的財産の保護と執行の適切性と有効性について問題のある国を、問題の大きな順から「優先国(priority foreign country)」、「優先監視国(priority watch list)」、「監視国(watch list)」の3段階に指定しています。
このうち「優先国(priority foreign country)」については調査及び当該国との協議を行い、改善が見られない場合には対抗措置をとることができると規定されています。
2024年4月25日、米国通商代表部(United States Trade Representative; USTR)は「2024年スペシャル301条報告書(2024 Special 301 Report)」を公表しました。
- 2024.04.25 USTR press release: USTR Releases 2024 Special 301 Report on Intellectual Property Protection and Enforcement
2024年スペシャル301条報告書には、USTRが100を超える貿易相手国について調査した結果が詳述されており、いわゆる「THE 2024 SPECIAL 301 LIST」に挙げられた国は以下のとおりとなります。
USTRは7カ国を優先監視リストに掲載し、知的財産の保護、執行、または知的財産に依存する米国人の市場アクセスに関して、その国に深刻な問題が存在することを示しました。
例えば、中華人民共和国では、知的財産の保護と執行に関して多くの深刻な懸念が残っており、ステークホルダーは、改正された特許法、著作権法、刑法に加え、技術移転、企業秘密、悪意ある商標、模倣品、オンライン海賊版、地理的表示といった長年の問題について、引き続き懸念を表明していること等に言及、 米国は引き続き、米中経済貿易協定に基づく中国の約束の履行状況を注意深く監視しているとのことです。
また、知的財産と公衆衛生に関して、米国は、知的財産権の貿易関連の側面に関するWTO協定(TRIPS協定)およびドーハ宣言の規定と整合的な方法で強制実施権を付与する貿易相手国の権利を引き続き尊重していること、また、TRIPS協定が、加盟国の領域内における公衆衛生上の緊急事態やその他の極めて緊急な状況において、さらなる柔軟性を規定していることも認識していることも述べています。
昨年(2023年)のスペシャル301条報告書についてはブログ記事「米国通商代表部(USTR) 2023年スペシャル301条報告書(2023 Special 301 Report) - 日本の薬価制度やパテントリンケージ、特許延長制度等の問題にステークホルダーから懸念の声 -」をご参照ください。

2.日本の薬価制度の透明性・予測可能性の欠如への懸念に言及
日本については、監視国としてリストには挙げられていませんが、報告書の中で、日本が2021年から実施している医薬品の毎年薬価改定の透明性と予測可能性の欠如、これは予想以上に多くの医薬品に適用されており、先進医療機器と革新的医薬品の価格設定と償還政策についてのステークホルダーからの有意義な意見の反映に関して、透明性の面で日本が不十分であると、ステークホルダーが懸念を表明し続けていることが述べられています(以下に該当部分を抜粋)。

革新的な医薬品等として創出された知的財産の価値が日本において適切に扱われていないという問題は、米国製薬企業だけが抱いているものではなく、もちろん日本国内製薬企業にとっても重要な死活問題ですよね。
Pharmaceutical and Medical Device Innovation and Market Access
Among other examples, USTR engagement in the past year included:
- Engaged with Japan on the importance of providing regular and sufficient opportunities for the private sector to provide public comments concerning Japan’s medical pricing and reimbursement rules;
・・・
The IP-intensive U.S. pharmaceutical and medical device industries have expressed concerns regarding the policies of several trading partners, including, Australia, Brazil, Canada, China, Colombia, Japan, Korea, Mexico, New Zealand, Russia, Saudi Arabia, and Türkiye, on issues related to pharmaceutical innovation and market access. Examples of these concerns include the following:
- While stakeholders welcomed the 2023 drug pricing reform package abolishing the price maintenance premium (PMP) and adding premiums to incentivize the early introduction of innovative drugs in Japan, they continue to express concerns about Japan’s shortcomings in terms of transparency, especially with regard to including meaningful stakeholder input regarding pricing and reimbursement policies for advanced medical devices and innovative pharmaceuticals. Other concerns raised by stakeholders relate to a reported lack of meaningful stakeholder input in the development of a health technology assessment system, as well as a lack of transparency and predictability associated with Japan’s implementation in April 2021 of annual repricing for drug reimbursement, which applies to a larger-than-expected range of products.
3.提出された意見書
連邦官報の公示(The Federal Register notice)に対応して提出された意見書(45の非政府関係者と16の外国政府から提出が含まれている)は、www.regulations.gov(docket number: USTR-2023-0014)で一般公開されています。
- 2023.12.06 Federal Register notice (USTR-2023-0014): Request for Comments and Notice of a Public Hearing Regarding the 2024 Special 301 Review
- Posted comments: https://www.regulations.gov/document/USTR-2023-0014-0001/comment
これらパブコメの公開資料は、世界中の知的財産の保護と執行の適切性と有効性について、様々なステークホルダーがどのような事項に懸念を抱いているのか、また海外政府がどのように考えているのかを知ることができるとても良い参考資料集ともいえます。
日本については、医薬品産業における薬価制度に関する問題点への指摘が多いわけですが、以下では、日本の医薬品産業の問題点への指摘の中でも、特に知的財産制度に直接関連した懸念事項を指摘している意見書を一部抜粋しました。
やはり、予想通り、昨年に引き続き、パテントリンケージ、特許権存続期間延長登録制度、医薬品データ保護制度に関する問題点を指摘する声があがっていることがよくわかります。
(1)Comment from Biotechnology Innovation Organization (BIO)
バイオテクノロジーイノベーション協会(Biotechnology Innovation Organization)は、優先監視国リストに日本を加えるよう要望しています(Comment from Biotechnology Innovation Organization (BIO): https://downloads.regulations.gov/USTR-2023-0014-0033/attachment_1.pdf)。
例えば、日本について取り上げている知的財産制度に関連する問題点として、医薬品の臨床試験データを保護する規制上のデータ保護(Regulatory Data Protection(「RDPと略す」))が法律上確立していないことや、日本のパテントリンケージ制度は救済措置の確保に数ヶ月を要することがあるために侵害製品が市場に出回る前に差止命令を求める先発製薬企業の能力を挫折させる不確実性を生み出していること、等を問題視しています。
No Legislated RDP
“While Japan’s system has the effect of providing protection that is similar to eight years of regulatory data protection, it has not formally established such protection through legislation. Establishing a high standard RDP system in law would help create more certainty and predictability for innovators, which would encourage more meaningful scientific collaboration between U.S. based biotech enterprises with Japanese counterparts.”

再審査制度から独立したRDP制度の創設は、イノベーションを促進し、最終的には国内の公衆衛生向上と経済発展につながる重要事項だと思います。
データ保護制度については、ブログ記事「「知的財産推進計画 2024」の策定に向けた意見 ― 医薬品の臨床試験データを保護する制度(データ保護制度)の法制度化を要望 ―」をご参照ください。

Patent Linkage Deficiencies with non-FTA Trading Partners
“In Japan, actions by the Ministry of Health (MHLW) have undermined the predictability of patent protections. While MHLW has acknowledged that it should not arbitrate patent disputes, in 2020 it undermined the patent of an innovative product by approving multiple generic versions even though the Japan Patent Office had upheld two of the four claims on the underlying method of use patent. Moreover, while the innovative manufacturer in this instance has initiated patent infringement suits against each of the approved generics, due to the action of the MHLW, potentially infringing products were permitted to enter the market as of December 2020, before the manufacturer could secure injunctive relief. Such relief can take months to secure in Japan’s legal system, thereby frustrating the ability of the innovator to seek an injunction before infringing products enter the market and creating uncertainty for innovator and generic manufacturers alike. This system equally harms patients, who could be prescribed products that ultimately must be withdrawn from the market based on the outcome of the pending litigation. It is exactly this uncertainty and disruption that well-functioning and effective patent enforcement systems are designed to avoid.”

パテントリンケージの不透明さ、予測可能性欠如は、製薬企業にフラストレーションを与えていますね。
日本のパテントリンケージの問題点については、ブログ記事「【アンケート】パテントリンケージとして運用されている二課長通知の問題点は何だと思いますか?」又は「医薬系特許的判例ブログ年報2023」p262をご参照ください。

(2)Comment from PhRMA
米国研究製薬工業協会(PhRMA)も、優先監視国リストに日本を加えるよう要望しています(Comment from PhRMA: https://downloads.regulations.gov/USTR-2023-0014-0027/attachment_1.pdf)。去年は「優先国(priority foreign country)」に指定することを要望していました。
Patent Term Restoration
“Japan’s PTR system permits term extensions for subsequent approvals for a product, such as for a new use of a previously approved product. PhRMA members appreciate Japan’s PTR laws, as they acknowledge the value that additional approvals can provide to patients. However, PhRMA urges the JPO to review its practices in granting PTR for subsequent approvals, to take into account the full regulatory review period in determining the length of any extensions. In particular, the current JPO practice, which provides an extension period based only on what is considered “necessary testing” for the subsequent approval, often results in extension periods for subsequent approvals that are shorter than the extension period of the first approval. As a result, the current practice can act as a disincentive to conduct research on additional medical uses and indications, including new formulations for an approved product.”

承認された製品についてその後に新しい製剤、用法・用量、適応症の追加に関する開発を進めたとしても、権利確保ができないのであればビジネスとしてあきらめてしまう場合があるかもしれません。特許権の延長登録は複数可能であることの弊害といいますか、延長された特許権の効力範囲が不透明であることが問題ですね。
Effective Patent Enforcement
“Specifically, while MHLW appropriately takes the position that it should not arbitrate patent disputes, it essentially did so when it unilaterally determined that it was appropriate to approve multiple generic versions of an innovative product even though the JPO had upheld some claims of a patent directed to the innovative product. In other words, MHLW took it upon itself to interpret whether the upheld patent claims covered the innovative product. … Further, once the MHLW has approved these generic versions, those products are eligible to be added to the National Health Insurance price list, thereby enabling potentially infringing products to enter the market. While injunctive relief is typically available in Japan, such relief can take months to secure, thereby frustrating the ability of the innovator to seek an injunction before potentially infringing products were allowed to enter the market. “
“As a result, the manufacturers of each of the approved generics have been put in the position of having to decide whether to launch at risk despite the ongoing litigation. Indeed, in at least one recent case, the manufacturer of a prematurely approved generic version had to withdraw and discontinue supply of their drug as a result of injunctive relief granted to the innovator, resulting in confusion among healthcare professionals and patients. In short, this situation creates significant uncertainty for innovators and generic manufacturers alike, and ultimately disrupts patient access to a steady drug supply. It is exactly this uncertainty that well-functioning and effective patent enforcement systems are designed to avoid.”

この最近の事件とは、もしや、ブリストル・マイヤーズ スクイブのスプリセル®錠の延長された物質特許権が存続していたところ、厚生労働省がその後発医薬品を承認してしまった件では・・・
スプリセル®錠の最近の事件については、ブログ記事「BMS スプリセル®錠(一般名:ダサチニブ水和物)の後発品を巡る特許権侵害訴訟で東京地裁が沢井製薬のダサチニブ錠の製造販売行為を禁止する仮処分命令を発出 ― 本当の問題点 ―」をご参照ください。
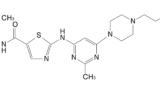
“PhRMA strongly requests that MHLW respect its 2009 guidance, Nikacho-tsuchi, regarding enforcement of innovators’ compound patents for their full term, including all granted PTR. The economic and political impact of potentially losing up to five years of patent life on many or most pharmaceutical products would be enormous. Not only would this represent a severe financial loss for PhRMA members in Japan but could radically change the financial outlook for future investment in Japan.”

「日本への将来的な投資を根本的に変える可能性」に言及。
米国製薬企業の革新的医薬品が日本で開発されないというドラッグロスの懸念を感じさせます。
(3)Comment from Alliance for Trade Enforcement
Alliance for Trade Enforcementは、日本の特許期間延長制度やパテントリンケージについて意見を述べています(Comment from Alliance for Trade Enforcement: https://downloads.regulations.gov/USTR-2023-0014-0043/attachment_1.pdf)。
Patent Term Restoration
“AFTE is encouraged by Japan’s provision of term extensions for subsequent marketing approvals for additional indications or medical uses and acknowledgment of the value that additional approvals can provide to patients. However, the laws as currently interpreted by the Japanese Patent Office often result in extensions for subsequent marketing approvals which are shorter in term than the extensions for the original approval and can thus act as a disincentive to conduct research on additional medical uses and indications, including new formulations for an approved product.”

日本の特許庁による現在解釈では、後続の製造販売承認の期間延長は、最初の承認に対する期間延長よりも短いことが多くなっていることへの懸念表明は、PhRMAの意見と同じですね。
Patent Enforcement
“While AFTE commends Japan’s reliable IP protections, actions by the MHLW have cast doubt on the future predictability of Japanese IP protections. Specifically, in 2020, the MHLW unilaterally determined that it was appropriate to approve multiple generic versions of an innovative product, even though the Japan Patent Office (“JPO”) had upheld two of the four claims on the underlying method of use patent. Therefore, these products will be able to enter the market as soon as MHLW adds these products to the National Health Insurance price standard list. AFTE is concerned that this will create significant uncertainty for innovators and generic manufacturers alike.”

日本のパテントリンケージの現状は、新薬メーカーと後発医薬品メーカーに大きな不確実性をもたらしていることの懸念を表明しています。
4.まとめ
2024年スペシャル301条報告書の中で、革新的な医薬品の価格設定や毎年薬価改定の透明性・予測可能性の欠如といった日本の問題に対してステークホルダーが懸念を表明していることが述べられています。
日本において、革新的な医薬品等として創出された知的財産の価値が適切に扱われていないという問題は、日本国内製薬企業にとっても重要な死活問題です。
ステークホルダーからの意見書を見ると、日本の薬価制度、特許権存続期間延長登録制度、パテントリンケージ、医薬品データ保護制度についての問題が指摘されており、日本を「優先監視国」に指定することを要望する意見書もありました。
PhRMAが「日本への将来的な投資を根本的に変える可能性」について言及しているように、海外では承認されている革新的医薬品が日本では開発されないというドラッグロスが生じ得る問題もあります。
日本政府は、この報告書や意見書での指摘を真摯に受け止め、国民の公衆衛生の維持・発展を促進するために、革新的な医薬品等の開発を促すための、薬価制度の改善、インセンティブ施策の充実、制度の明確化・改善に向けた具体的な検討を進める必要があるのではないでしょうか。




コメント