Summary
本件は、発明の名称を「重症心不全の治療方法およびその薬剤」とする特許第4771937号の特許権者である大塚製薬(原告)が、本件特許を無効と判断した審決を不服として、その取消しを求めた事案である。
知財高裁は、進歩性欠如を理由として本件特許を無効であると判断した本件審決を支持し、大塚製薬の請求を棄却する判決をした。
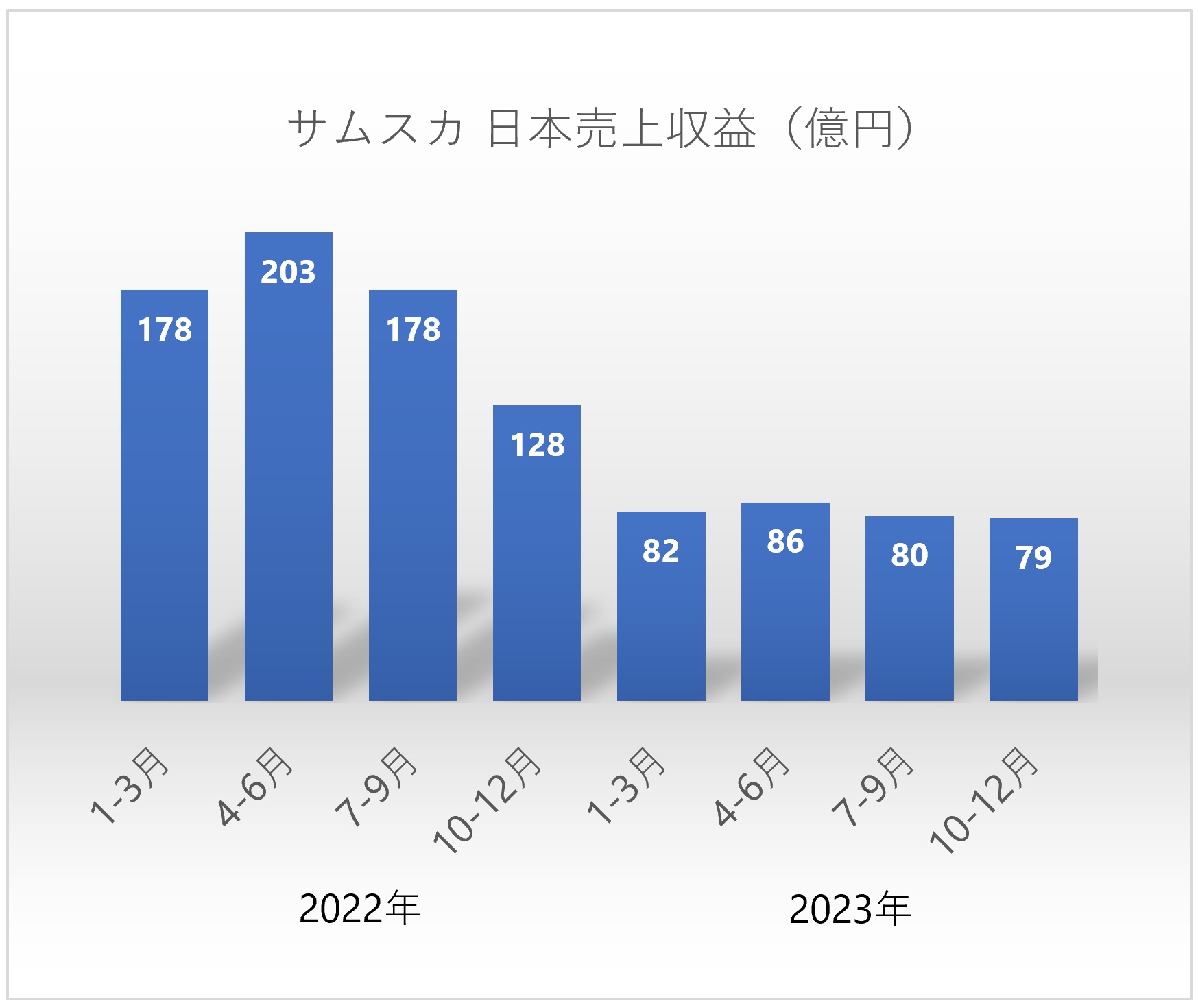
この事件には、バソプレシン V2-受容体拮抗薬であるトルバプタン(Tolvaptan)を有効成分とするサムスカ®(先発医薬品)の主要な効能・効果「ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を保護するかもしれない本件特許を無効にして、後発医薬品には認められていなかったその効能・効果についての追加承認を得たいという後発医薬品メーカー側の思惑が背景にあった。
厚生労働省は、知財高裁の判決に依ることなく無効審決が下されたことをもって本件特許によるパテントリンケージを解除したのだろうか、各後発医薬品に対して、「ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」の効能・効果を2022年9月7日付けで追加承認した。
サムスカ®にとって初の後発医薬品の市場参入(2022年6月)から、たった3か月後のことであった。
1.背景
本件(知財高裁令和4年(行ケ)10084)は、発明の名称を「重症心不全の治療方法およびその薬剤」とする特許第4771937号の特許権者である大塚製薬(原告)が、本件訂正を認めた上で特許を無効とした審決(無効2020-800029号事件)の取消しを求めた事案である。
争点は、進歩性に関する認定判断の誤りの有無である。
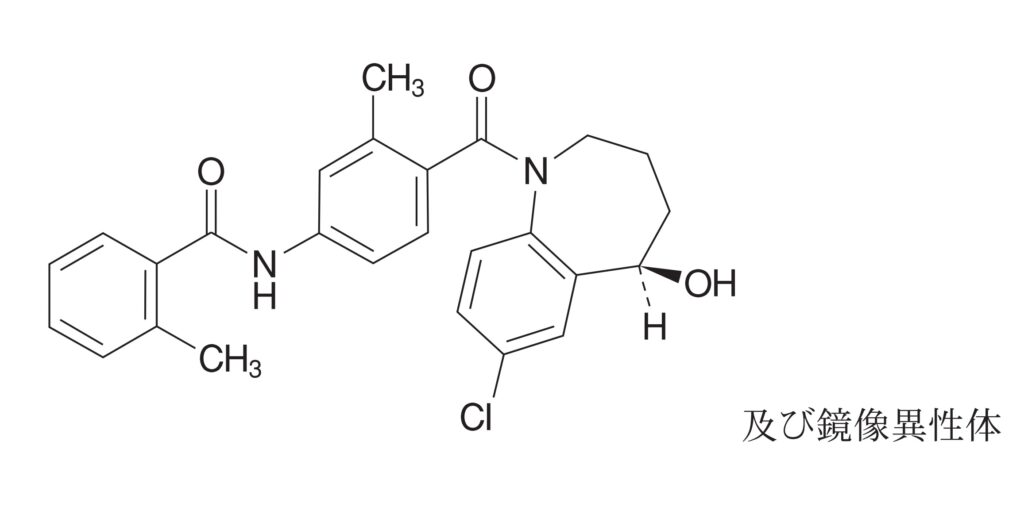
訂正後の特許請求の範囲の請求項1(本件発明1)は以下のとおり。
5-ヒドロキシ-7-クロロ-1-[2-メチル-4-(2-メチルベンゾイルアミノ)ベンゾイル]-2,3,4,5-テトラヒドロ-1H-ベンゾアゼピンまたはその医薬的に許容される塩を活性成分として含み、該活性成分の1日当たりの用量が0.371mg/kg以下の範囲であることを特徴とする、急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度IVの患者に最適の治療と組み合わせて入院下で経口にて投与開始される重症心不全の治療薬。
※以下、「5-ヒドロキシ-7-クロロ-1-[2-メチル-4-(2-メチルベンゾイルアミノ)ベンゾイル]-2,3,4,5-テトラヒドロ-1H-ベンゾアゼピン」を「トルバプタン」と略し、「ニューヨーク心臓協会の分類」を単に「NYHA」と略す場合がある。
後述するが、「トルバプタン」(Tolvaptan)とは、大塚製薬が製造販売している先発医薬品サムスカ®の有効成分である。
すなわち、本件は、サムスカ®を保護するかもしれない本件特許の特許権者である大塚製薬と、その特許を無効にしたい被告ら後発医薬品メーカー側との特許係争である。
2.裁判所の判断
知財高裁・第1部(以下、「裁判所」と略す)は、本件発明は、甲2発明に接した当業者が、甲2発明、甲2の記載及び技術常識に基づき容易にすることができたものである(進歩性無し)とした本件審決に誤りはなく、原告(大塚製薬)の請求には理由がないからこれを棄却することとして、主文のとおり判決した。
1 原告の請求を棄却する。
2 訴訟費用は原告の負担とする。
以下に、本件発明1についての裁判所の判断を紹介する。
(1)本件発明1の要旨について
原告(大塚製薬)は、本件各発明の対象患者を「ADHF(急性非代償性心不全)の重症患者」であると主張し、また、ADHFにつき、機能的あるいは構造的異常が急激に発生し、低下した心ポンプ機能を代償する時間がないか、代償機転が十分でないような重篤な障害が起こり招来される病態をいうと主張した。
しかし、裁判所は、
「進歩性の要件が認められるかを判断するに当たっては、本願発明又は特許発明を認定した上で主引用発明と対比し、一致点及び相違点を認定した上で、相違点につき容易想到性を判断するが、本願発明及び特許発明の認定は、特許請求の範囲の記載の技術的意義が一義的に理解することができないとか、あるいは一見してその誤記が発明の詳細な説明の記載に照らして明らかであるなど、発明の詳細な説明の記載を参酌することが許される特段の事情のない限り、特許請求の範囲に基づいてされるべきである(最高裁昭和62年(行ツ)第3号平成3年3月8日第二小法廷判決。民集45巻3号123頁参照)。」
と述べた上で、

最高裁昭和62(行ツ)3は、あの有名な「リパーゼ事件」判決ですね。
裁判所は、
「特許請求の範囲はおろか、本件明細書の発明の詳細な説明においても、本件優先日当時、「急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度Ⅳの患者」、「ニューヨーク心臓協会の分類:重症度Ⅳの患者」との記載をもって、「ADHF(急性非代償性心不全)の重症患者」を示すことが自明であったことを認めるに足りる証拠はない。また、「急性心不全または慢性心不全の急性増悪期」と「ADHF(急性非代償性心不全)」との関係も、証拠上明らかとはいえない。」
として、原告の主張を認めず、特許請求の範囲に従い、「急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度Ⅳの患者」と認定されるべきものであると判断した。
(2)本件発明1と甲2発明の対比
甲2には、次の発明(甲2発明)が記載されていると認められ、本件発明1と甲2発明とは、「トルバプタンまたはその医薬的に許容される塩を活性成分として含み、心不全の患者に最適の治療と組み合わされて投与される、心不全の治療薬」である点において一致する。
しかし、本件発明1は、「重症度IVの患者」、「重症心不全の治療薬」及び「最適治療と組み合わせて入院下で経口投与開始」について特定している点(相違点1)及び活性成分の1日当たりの用量について特定している点(相違点2)において、甲2とは相違していた。
(3)相違点に係る容易想到性について
裁判所は、 相違点1について、
「・・・技術常識も考慮して、甲2発明のトルバプタンを、「急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度Ⅳの患者」における体液貯留等を改善するための治療薬とすることには、十分な動機付けがあり、容易に想到し得たということができる。・・・甲2発明における「安定したフロセミド用量(20~240mg/日)」が、フロセミドを必要に応じて投与することを制限する趣旨と読み取れないことは、前記・・・のとおりであるから、この点は実質的な相違点とはいい難い。また、・・・対象患者の症状や投与方法等を捨象した、単に治療薬を投与する際に患者が入院下であるか否かという点も、実質的な相違点とはいい難い。次に、・・・トルバプタンは、経口投与で強力な水利尿薬として作用する薬物として知られていたのであるから、甲2発明では経口投与されたか不明であるトルバプタンを本件発明1の対象患者に投与するに当たり、これを経口投与とすることは、当業者が適宜なし得た事項というべきである。」
と判断し、相違点2についても、
「甲2に接した当業者が、甲2発明のトルバプタンを「急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度Ⅳの患者」のための、他の治療と組み合わせて使用される治療薬とするに当たり、甲2の最小有効量とほぼ同一の用量である1日当たり0.371mg/kg(本件試験におけるトルバプタン30mg/日群の体重換算値)以下とすることは、甲2の記載及び技術常識を参酌して適宜なし得ることというべきである。」
と判断した。
原告は、本件優先日当時の技術常識として、ADHFの重症患者と慢性心不全の慢性期の軽症~中等症患者とは、その症状、治療内容・態様、治療薬の適応・治療効果が大きく異なっていた、同じ心不全治療薬であっても、NYHAクラスⅠ~Ⅲの患者には有効だがクラスⅣの患者には効果がない又は悪化させる例があった上、NYHAクラスⅣの患者は利尿薬抵抗性の問題がより深刻であって治療に限界が生じており、トルバプタンにも利尿薬抵抗性の問題が認識されていたことによると、甲2発明から相違点1に係る本件発明1の構成に想到する動機付けはないと主張した。
しかし、裁判所は、
「利尿薬に関していえば、急性心不全と慢性心不全とを問わず、また重症と軽症~中等症とを問わず、心不全の症状の一つである体液貯留、うっ血、浮腫等を改善する治療薬として広く用いられていたのであるから、甲2に記載されたトルバプタンの水利尿効果が、体液貯留等の症状を呈する急性心不全の患者や重症患者にも得られるであろうことを、当業者は当然に想起するというべきである。・・・NYHAクラスⅠ~Ⅲの患者とクラスⅣの患者とで取扱いを異にする例として原告が挙げている例・・・には、利尿薬とは異なる心不全治療薬が含まれているほか、利尿薬に関するものであっても、NYHAクラスⅣであることを理由に利尿薬の取扱いを異にすべき旨が記載されているとは読み取ることはできない。・・・重症心不全患者では、特に体液貯留等の管理が重要とされており、重症度の高さや利尿薬抵抗性の問題から利尿薬が十分に効果を発揮しない場合があるとしても、また、仮にトルバプタンにも利尿薬抵抗性の問題があるとしても、当業者は、NYHAクラスによる重症度を問うことなく、体液貯留等の症状を改善するために利尿薬の使用を試みるというべきである。」
と判断した。
また、原告による、甲2発明から相違点1に係る本件発明1の構成に想到する動機付への阻害要因がある旨の主張に対しても、裁判所は、
「本件優先日前に頒布された刊行物・・・からすると、原告が主張するように、選択的バソプレシンV2受容体拮抗薬につき、血中バソプレシン濃度上昇による悪影響がある可能性を指摘する文献があったことを考慮しても、適切な用量設定等により安全に効果を得られることが示されていたのであるから、トルバプタンをNYHAクラスⅣの重症患者に、また急性心不全の患者に適用することが禁忌であったとはいえず、阻害要因となるべきものとは認められない。」
として、原告の主張は、採用することができないと判断した。
(4)予測できなかった顕著な効果について
原告は、本件優先日当時、利尿薬は、心不全の予後を改善させる(死亡率を低下させる)ものとは理解されていなかったところ、本件試験は、症状改善効果とは別途の評価項目として死亡率低下を設定し、その結果、トルバプタン30mg投与群で、「入院期間から外来で投与を終了するまでの全期間の死亡率」が有意に低く、この効果は、予測できなかった顕著な効果であるから、本件発明1の進歩性を肯定する事情として考慮されるべき旨主張した。
しかし、裁判所は、
「本件試験は、NYHAクラスⅢ及びⅣの患者が混在した試験であり、クラスⅣの患者のみについての死亡数は明らかになっていないのであるから、本件発明1の対象患者である「急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度Ⅳの患者」の予後にいかなる効果を奏するのかは不明である。・・・原告の主張とは異なり、本件試験は、「急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度Ⅳの患者」の予後を評価するための試験として設計されたものではなく、その効果も明らかにはなっていない。加えて、本件試験の対象患者の母数は少なく、死亡者数もプラセボ投与群で7名、30mg投与群で3名であって、60mg投与群ではプラセボ対照群を超える8名が死亡しているのに、90mg投与群では2名が死亡するにとどまることも考慮すると、30mg投与群においてp値が0.05を下回っているとしても、当業者において、技術常識を参酌しても、本件発明1の構成を採用することにより、30mg投与群のみにおいて、その対象患者の予後が改善する効果を奏したとは理解できないというほかはない。・・・また、浮腫改善等の効果は、うっ血性心不全患者に利尿薬が投与される本来の目的そのものであって、甲2において従来のループ利尿薬に上乗せしてトルバプタンを投与したことにより治療効果が得られたことが記載されているのであるから、用量の増加や投与経路の変更がないとしても、これをもって予測できなかった顕著な効果ということは困難である。」
と判断した。
3.コメント
(1)欧・米・日での審査官の判断
裁判所は、本件特許第4771937号に係る本件発明について、引用発明との相違点は当業者が適宜なし得た事項というべきであるり、原告の主張は阻害要因となるべきものとは認められず、さらに予測できなかった顕著な効果があるということも困難であるとして、進歩性欠如を理由に無効であるとした審決を支持した。
さて、日本だけでなく本件特許の欧米ファミリーにおいて、特に進歩性の欠如(自明性)の拒絶理由等で問題とならなかったのか、もし問題となったらどのように解消しているのか気になるところであり、確認した。
欧州
欧州では、引用文献等から「重症度IVの患者」を治療するという課題を当業者が解決しようとしただろうかどうかの点について進歩性欠如の拒絶理由通知を受けたが、日本での本件訂正のようにclaim 1について活性成分の1日用量範囲を限定するような補正をすることをせずに、反論することによって、拒絶理由は解消され、2008年10月22日、EP1596868B1が登録された。
当該欧州特許は異議申立てもされず、2024年2月23日に存続期間満了を迎えた。
EP1596868B1 Claims:
米国
米国でも、引用文献等から当業者が「重症度IVの患者」を治療するだろうことは自明である旨の拒絶理由通知を受けたが、日本での本件訂正のようにclaim 1について活性成分の1日用量範囲を限定するような補正をしたおかげか、これを解消し、2008年9月9日に、US7423032B2が登録された。
また、さらにその継続出願をし、前記特許との自明型ダブルパテント等の拒絶理由通知を受けたが、解消し、US7749993B2が2010年7月6日に登録された。
特に、後者の特許は、claim 1について活性成分の1日用量範囲を限定するような補正をすることをせずに、「重症度III及びIVの患者」を対象とした範囲で登録に至った。
US7423032B2 Claims:
US7749993B2 Claims:
日本
さて、日本における本件特許の審査経過についてのおさらいである。
日本でも、引用文献に記載のトルバプタンを「重症度IVの患者」に用いることに格別の困難性は見いだせないとして、審査官からは進歩性無しとする拒絶査定を受けた。
しかし、拒絶査定不服審判請求後の前置審査での面接において、審査官の説得に成功したようであり(以下の審査官による特許メモを参照)、本件特許第4771937号として登録に至った。
<<特許メモ>>
「本願は、5-ヒドロキシ-7-クロロ-1-[2-メチル-4-(2-メチル ベンゾイルアミノ)ベンゾイル]-2,3,4,5-テトラヒドロ-1H-ベン ゾアゼピン(トルバプタン)を活性成分とするニューヨーク心臓協会の分類(N YHA):重症度IVの重症心不全の治療薬である。 これに対し、参考文献には、トルバプタンをNYHA:重症度I-IIIに用 いることは記載されている。また、利尿剤をNYHA:重症度II-IVに用い ることも公知である。 しかしながら、重症度IIIと重症度IVでは予後の死亡率に差があること、 出願人が意見書に添付して提出した参考文献3には利尿剤の使用は予後を悪化さ せる可能性も指摘されていることから、重症度IIIに有効であっても重症度I Vに有効であると一概には言えない。これに対し、本願では重症度IVに対する 効果を確認している。また、本願は低ナトリウム血症の患者に対する血清ナトリ ウム濃度の上昇作用も有するものである。 よって、本願は参考文献に記載の発明から当業者が容易に想到し得たものとは いえない。」
登録時(本件訂正前)の本件特許第4771937号に係る特許請求の範囲の請求項1は以下のとおり。
日米欧において、いずれも、審査の段階では、「重症度IVの患者」にトルバプタンを用いることへの進歩性欠如(自明性)が問題視されたが、反論及び/又は活性成分の1日用量範囲についての発明特定事項を加える補正をすることによって、大塚製薬は登録に成功した。
本件において被告らが進歩性欠如の無効理由に挙げてきた甲2は、日本及び欧米特許ファミリーの拒絶理由の引用文献として挙がらなかったようである。
出願人からの意見書(又は補正)のどの点が、日米欧の審査官の心を動かしたのかは不明である。
甲2が引用文献として挙げられていたとしたら審査官は拒絶していたのだろうか、それとも、特許が無効とされたのは、特許庁の審査官と審判官の判断の違いが大きな要因だったのだろうか、それともまた、対峙する相手が審査官か無効審判請求人かの違いが大きな要因だったのだろうか。

この発明、特許となるか拒絶となるかは紙一重の差、どっちに転んでもおかしくなかったのかも?
(2)トルバプタンとは
この訴訟の背景にあるのは、バソプレシン V2-受容体拮抗薬であるトルバプタン(Tolvaptan)を有効成分とするサムスカ®(先発医薬品)の主要な効能又は効果を保護するかもしれない本件特許について無効審決を勝ち取って、後発医薬品にはこれまで承認されていなかったその効能又は効果の追加承認を得ることを後発医薬品メーカーが目論んだことにある。
トルバプタン(Tolvaptan)は、大塚製薬において電解質排泄の増加を伴わず過剰な水のみを排泄する「水利尿薬」を目指して開発された、合成された非ペプチド性のバソプレシン V2-受容体拮抗薬サムスカ®の有効成分である。
トルバプタンは、腎集合管でのバソプレシンによる水再吸収を阻害することにより水利尿作用を示し、塩類排泄を増加させずに更なる利尿を得ることが期待され、心不全及び肝硬変における体液貯留の患者に対して臨床開発が行われた。
そして、まず、サムスカ®錠 15mg が、 2010年10月に、「ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を効能又は効果として、製造販売承認を取得した。
その後、剤型追加及び適応症追加を経て、現在は、サムスカ®錠 7.5mg(2013年2月承認)・15mg・30mg (2014年3月承認)は販売を中止し、OD錠7.5mg・15mg・30mg、顆粒1%(OD錠7.5mg・15mg・30mgが2019年8月27日、顆粒1%が2017年3月14日に承認)が販売されており、効能又は効果は以下の4つとなっている(OD錠 7.5mg及び顆粒 1%は①②③④、OD錠 15mgは①②③、OD 錠 30mgは③④)。
- ①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留(再審査期間~2020年10月26日)
- ②ループ利尿薬等の他の利尿薬で効果不十分な肝硬変における体液貯留(2013年9月13日承認。再審査期間~2020年10月26日)
- ③腎容積が既に増大しており、かつ、腎容積の増大速度が速い常染色体優性多発性のう胞腎(ADPKD)の進行抑制(2014年3月24日承認。希少疾病用医薬品: 再審査期間日〜2024年3月23日)
- ④抗利尿ホルモン不適合分泌症候群(SIADH)における低ナトリウム血症の改善(2020年6月29日承認。希少疾病用医薬品: 再審査期間~2030年6月28日)
米国
米国では、トルバプタン(Tolvaptan)は、低ナトリウム血症(心不全、肝硬変、および抗利尿ホルモン不適合分泌症候群(SIADH))の適応症で、2009年5月19日にFDAの承認を取得(その後、肝硬変の部分は削除)し、Samsca®(商品名)として販売されている(2009.05.22 大塚製薬 press release: 米国で初めての経口選択的バソプレシンV2受容体拮抗剤「SAMSCA™」 FDAより承認取得)。
また、トルバプタン(Tolvaptan)は、Jynarque®(商品名)として、常染色体優性多発性のう胞腎(ADPKD)の適応症で、2018年4月23日に承認された(2018.04.25 大塚製薬 press release: 大塚製薬創製「JYNARQUE™」 米国初となるADPKD治療薬として販売承認を取得)。
欧州
欧州では、トルバプタン(Tolvaptan)は、抗利尿ホルモン不適合分泌症候群(SIADH)における低ナトリウム血症を治療する医薬品としてSamsca®(商品名)(2009.08.04 大塚製薬 press release: 経口バソプレシンV2受容体拮抗剤 「SAMSCA™」SIADHによる低ナトリウム血症の治療薬として欧州委員会より承認取得)、常染色体優性多発性のう胞腎(ADPKD)を治療する医薬品としてJinarc®(商品名)が承認されている(2015.05.28 大塚製薬 press release: 大塚製薬創製「JINARC」(ジンアーク) 欧州初となるADPKD治療薬の販売承認を取得)。
(3)本件特許とサムスカ®との関係
大塚製薬は、2004年2月23日、発明の名称を「重症心不全の治療方法およびその薬剤」とする発明について特許出願(特願2006-502681号。優先権主張(米国):2003年2月24日)をし、2011年7月1日、特許権の設定登録(特許第4771937号)を受けた。
本件発明1等の記載「該活性成分の1日当たりの用量が0.371mg/kg以下の範囲であることを特徴とする、急性心不全または慢性心不全の急性増悪期にあるニューヨーク心臓協会の分類:重症度IVの患者に最適の治療と組み合わせて入院下で経口にて投与開始される重症心不全の治療薬」と、サムスカ®の効能又は効果「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」の記載とが包含関係にあるのか否かがいまいちわかりにくい。
しかし、本件明細書の実験例として記載されている臨床試験結果は、利尿薬等の通常治療を受け続けた重症心不全(重症度IIIーIV)患者を対象としたIIB試験において、トルバプタン1日当たり30mg処置群(77例の平均換算用量0.371mg/kg)において全尿排出量が増加し、主要評価項目である体重が減少したこと(体液貯留の改善)を示している(優先日における出願明細書に既にこれら試験結果は記載されていた)。
したがって、「重症心不全(重症度IVを含む)の治療」という意義が「体液貯留」の改善という項目で主に評価されると理解できるのであれば、効能又は効果「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を標榜するサムスカ®の後発医薬品の製造販売行為は、本件発明1の技術的範囲に属すると言えるかもしれない。
サムスカ®錠 15mg が 2010年10月に「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を効能又は効果として初承認を取得したその翌年である2011年7月1日に本件特許が設定登録された。
本件特許の登録までには拒絶査定不服審判請求と並行して保険である分割出願をしていたものの、本件特許が登録となってからは、「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を保護できるようにその分割出願で適切な権利範囲を模索する等の積極的な大塚製薬の動きは無かった。
もし、本件特許権が、サムスカ®の効能又は効果のひとつである「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を保護するものであると考える(考えたい)ならば、最初のサムスカ®錠 15mg の承認(2010年10月)時には本件特許権の設定登録が間に合わず存続期間の延長登録出願をする機会はなかったわけだが、その後の同効能又は効果についてのOD錠や顆粒の承認時には存続期間の延長登録出願の機会はあったのかもしれない。
しかし、それら機会に(敢えて?)延長登録出願をしなかったということは、大塚製薬は本特許権がサムスカ®の効能又は効果である「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を保護しないと考えていたということなのだろうか。
先行処分との関係での延長登録要件についての判断が示された「アバスチン事件」の最高裁判決が言い渡されたのは2015年であり(ブログ記事「2015.11.17 「特許庁長官 v. ジェネンテック」 最高裁 平成26年(行ヒ)356」参照)、サムスカ®のOD錠や顆粒が承認されたのはその後のことである。

もし、OD錠や顆粒の承認に基づいて本件特許に係る特許権の存続期間の延長登録に成功していたならば、少しはその製品寿命(後発医薬品による浸食回避)を延長できていたのかもしれないのだが・・・。
また、米国でのSamsca®のOrange Bookには本件特許米国ファミリーである前述の2つの特許はいずれも収載されていなかったようである。
大塚製薬の本件特許における権利化戦略の情熱の低さ(?)にどうしても違和感を感じるのである(何か裏があるのかもしれない・・・)。
本件特許権の存続期間の満了日は出願日から20年となる2024年2月23日であり、今となっては既に満了している。
後発医薬品メーカーらは、本件特許権がサムスカ®の効能又は効果である「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を保護するかもしれないという可能性を考え、それら後発医薬品において同効能又は効果を承認した場合の当該特許権の侵害リスクを排除するために無効審判を請求したと推測される。
(4)後発医薬品の市場参入と本件特許に対する動き
2022年6月、サムスカ®にとって初の後発医薬品がトーアエイヨー(OD錠7.5mg「TE」)、ニプロ(OD錠7.5mg「ニプロ」)、第一三共エスファ(OD錠7.5mg「DSEP」)、東和薬品(トルバプタン顆粒1%「トーワ」)から発売された。
先発医薬品サムスカ®には4つの適応(前述の効能又は効果①②③④)があったが、後発医薬品の効能又は効果は「②ループ利尿薬等の他の利尿薬で効果不十分な肝硬変における体液貯留」のみとなった。
市場参入した後発医薬品の中には、大塚製薬工場のオーソライズド・ジェネリック(AG)(OD錠7.5mg「オーツカ」)も含まれていた(2022.06.17 大塚製薬工場 press release: V₂-受容体拮抗剤トルバプタンOD錠7.5mg「オーツカ」を新発売)。
初市場参入となった後発医薬品の効能又は効果が「②ループ利尿薬等の他の利尿薬で効果不十分な肝硬変における体液貯留」のみとなった理由は、少なくとも、「③腎容積が既に増大しており、かつ、腎容積の増大速度が速い常染色体優性多発性のう胞腎の進行抑制」及び「④抗利尿ホルモン不適合分泌症候群(SIADH)における低ナトリウム血症の改善」の効能又は効果についてはこの時点で再審査期間が終了していなかったこと、また、「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」については、本件無効審判が特許庁に係属していた(厚生労働省によるパテントリンケージが発動していた?)ことから、①③④については承認されなかったことにあると推測される。
後発医薬品メーカーであるトーアエイヨーが本件特許に対する無効審判を請求したのは2020年3月16日である。そして、他の被告らも参加して、本件特許の無効審決が2022年7月5日に下された。
本件訴訟が提起されたため本件審決は確定していたわけではなかったが、特許庁が本件特許について無効審決を下したことをもってパテントリンケージを解除したのだろうか、厚生労働省は、各後発医薬品に対して、「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」の効能又は効果を2022年9月7日付けで追加承認することとした。
サムスカ®にとって初の後発医薬品の市場参入(2022年6月)から、たった3か月後のことであった。
AGであるはずのトルバプタン OD錠7.5mg「オーツカ」も、同日に効能又は効果①の追加承認を取得したようであり、なぜ、他の後発医薬品より先立って承認(パテントリンケージの解除)を得て先行販売することをしなかったのかは謎である。
- 2022.09.07 トーアエイヨー press release: 『トルバプタン OD 錠 7.5mg「TE」』「効能又は効果」追加承認取得のお知らせ
- 2022.09.07 ニプロ press release: トルバプタンOD錠 7.5mg「ニプロ」「効能・効果」、「用法・用量」一部変更承認取得のお知らせ
- 2022.09.07 第一三共エスファ press release: トルバプタンOD錠7.5mg「DSEP」の効能・効果に係る承認取得のお知らせ
- 2022.09.07 東和薬品 press release: トルバプタン顆粒 1%「トーワ」の「効能又は効果」「用法及び用量」の追加承認取得のお知らせ
- 2022.09.07 大塚製薬工場 お知らせ: トルバプタンOD錠7.5mg「オーツカ」 使用上の注意改訂のお知らせ
前述のとおり、本件特許権は2024年2月23日に満了した。
被告ら後発医薬品メーカーがサムスカ®の後発医薬品の効能又は効果に「①ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」を追加したのは2022年9月であり、それら後発医薬品の効能追加により本件特許権の存続期間が満了するまでの約1年半の間に失った利益を回収するために、特許権者である大塚製薬は、もしかすると、各後発医薬品メーカーに対して本件特許権を侵害していると主張して損害賠償を請求する戦略を考えていたかもしれない。既に、特許権侵害訴訟は提起されていたのだろうか。
しかし、本件特許を無効であるとした審決が知財高裁によっても支持されたことで、もしそのような戦略を練っていたとしても、それも儚く消えそうだ。


コメント