1.第一三共の発表と補足説明
2024年1月17日、第一三共は、第一三共が米国特許商標庁(USPTO)に請求していたSeagen社の米国特許10,808,039(以下「’039特許」)の有効性を審査する特許付与後レビュー(Post Grant Review、以下「PGR」)において、米国特許商標庁が’039特許は無効であるとの決定を下したと発表しました。
- 2024.01.17 第一三共 press release: 当社ADC製品に関するSeagen社との特許係争に関するお知らせ
第一三共は、2020年12月23日にSeagen社の’039特許が無効であるとして米国特許商標庁にPGRの開始を請求し、米国特許商標庁は、2022年4月7日にPGRの開始を決定していました。
PGRの開始決定後、手続きの停止もありましたが(2022.07.19記事: Seagen社の抗体薬物複合体(ADC)特許と第一三共「Enhertu®(エンハーツ)」を巡る特許紛争 米国特許商標庁が特許付与後レビュー手続きを進めないことを決定)、再度開始の決定を経て(2023.02.17 第一三共 press release: 当社ADC製品に関するSeagen社との特許係争に関するお知らせ)、今回の米国特許商標庁による無効判断に至りました。
なお、’039 特許は、今回のPGR手続きと並行して進んでいる、米国連邦巡回区控訴裁判所(以下「CAFC」)にて係属中の特許権侵害訴訟において、Seagen社が主張の根拠としている唯一の特許です。
この特許権侵害訴訟は、第一三共による米国でのEnhertu®(エンハーツ)の販売がSeagen社の抗体薬物複合体(Antibody-drug conjugate: ADC)技術に関する’039特許の侵害に当たると主張して、Seagen社が第一三共に対して提起した事件です。
その第一審である米国テキサス州東部地区連邦地方裁判所は、2023年10月17日、第一三共に対して、41.8百万ドルの損害賠償金に加え、2022年4月1日からSeagen社の’039特許が満了する2024年11月4日までのEnhertu®の米国売上に対する8%のロイヤルティの支払を命じる判決を下しましたが、第一三共は、2023年11月16日、この地裁判決を不服として、CAFCに控訴を提起しています。この地裁判決の内容については以下の記事をご参照ください。
従って、’039特許が無効であるとの判断が確定されれば、Seagen社が提起した特許権侵害訴訟の根拠が無くなるため、今回のPGRでの米国特許商標庁による判断は第一三共にとって有利なものとなります。
第一三共は、「米国特許商標庁が本決定を下したことを高く評価しております」と述べています。
しかし、Seagen社はこのPGRでの判断を不服として、裁判所に上訴する可能性がありますので、今後のSeagen社の動きと係属中の特許権侵害訴訟の行方を引き続き注視する必要があります。
2.Enhertu®と’039特許のクレーム
まず、第一三共のEnhertu®(trastuzumab deruxtecan)と’039特許のクレームの関係をおさらいします。
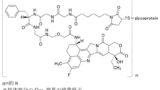
(1)Enhertu®(エンハーツ)
Enhertu®(エンハーツ)は、ヒト上皮増殖因子受容体2型(HER2)に対するヒト化モノクローナル抗体とトポイソメラーゼI阻害作用を有するカンプトテシン誘導体(ペイロード)を、リンカーを介して結合させた抗体薬物複合体(antibody-drug conjugate: ADC)であるトラスツズマブ デルクステカン(trastuzumab deruxtecan)を有効成分とする抗悪性腫瘍剤です。
2019年3月、第一三共とAstraZeneca社は、全世界(第一三共が独占的権利を有する日本は除く)においてトラスツズマブ デルクステカンを共同で開発及び商業化する契約を締結し、2019年12月に米国で承認、2020年3月には日本でも承認され、販売されています。
(2)’039特許
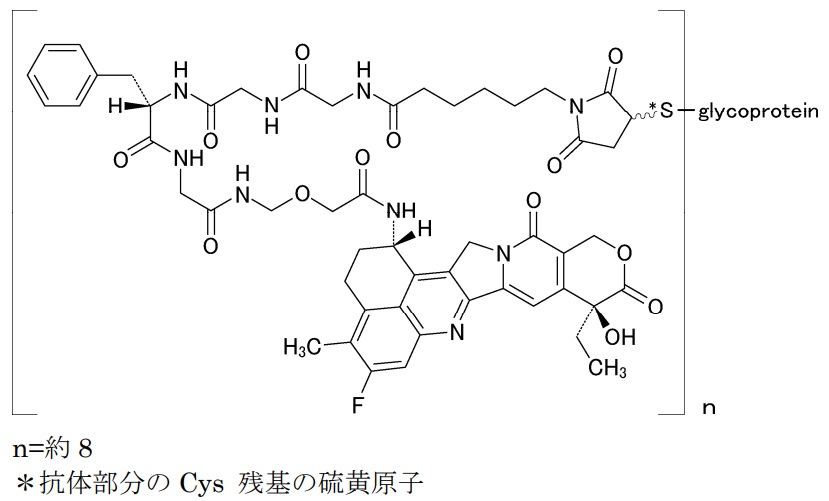
‘039特許のクレームは、特定のリンカーを介して抗体と薬物を結合させた抗体薬物複合体(antibody-drug conjugate: ADC)に関する発明です。
Seagen社は、この出願をEnhertu®と関係のないクレームで継続出願と登録でつないできましたたが、第一三共とAstraZeneca社との契約発表(2019年3月)を見たからでしょうか、2019年7月にはじめてEnhertu®の有効成分であるトラスツズマブ デルクステカンのリンカー部分に合わせ、それを包含するクレームの継続出願にチャレンジしてきました。
そして、特許許可通知を受け、その3日後に登録料を支払い、2020年10月20日に、’039特許の登録に漕ぎつけました。
既に、Enhertu®が米国で承認された2019年12月から約10カ月が経っていました。
特にリンカー部分の「-Ww- unit」のアミノ酸が、トラスツズマブ デルクステカンのリンカー部分と同じグリシン(R19 is hydrogen)かフェニルアラニン(R19 is benzyl)に特定されている点に注目です。
従って、’039特許のクレームは、Enhertu®の有効成分であるトラスツズマブ デルクステカンを包含していることになります。
3.PGRでの米国特許商標庁による判断
Seagen社の’039特許を無効としたPGR(PGR2021-00030)での米国特許商標庁による判断の内容を簡単に紹介します。
無効判断の理由は、記載(written description)要件及び実施可能(enablement)要件を満たさないこと(112条(a))、並びに優先権の利益を享受できないことによる新規性の欠如(102条(a)(1))です。
PRIORITY
まず、米国特許商標庁は、クレームの「Ww unit」についての記載が不十分であるから本件特許クレームは優先権の利益を享受できないとの、第一三共による主張に同意しました。
We remain unpersuaded by Patent Owner’s reliance for descriptive support on three tetrapeptides “GFLG(glycine-phenylalanine-leucineglycine) and ALAL (alanine-leucine-alanine-leucine)” as well as “GSVQ (glycine-serine-valine-glutamine).” Resp. 70–71. Patent Owner asserts that these “would have guided a POSA to gly/phe tetrapeptides. (Ex. 2058 ¶¶ 133-37.)” Id. at 71.
We find that the disclosure of these three tetrapeptides in the ’039 patent does not suggest the use of the gly/phe tetrapetides. Rather, we find the ’039 patent discusses that “[u]seful – Ww- units can be designed and optimized in their selectivity for enzymatic cleavage by a particular enzymes [sic], for example, a tumor-associated protease. In one embodiment, a – Ww unit is that whose cleavage is catalyzed by cathepsin B, C and D, or a plasmin protease.” Ex. 1001, 67:57–60. While the gly/phe tetrapeptides might have been obvious after optimization for a particular protease is performed, “a description that merely renders the invention obvious does not satisfy the [written description] requirement.” Ariad, 598 F.3d at 1352.
In sum, after reviewing the record, including the statements of Dr. Lambert and Dr. Bertozzi, we agree with Petitioner that a preponderance of the evidence shows claim 1 lacks benefit of priority to the priority applications because those applications do not provide written descriptive support for the Ww subgenus recited in claim 1.
WRITTEN DESCRIPTION
次に、米国特許商標庁は、Ww unitにおける「グリシンまたはフェニルアラニンのtetrapeptide」について、記載(written description)要件を満たさないと判断しました。
We find that our written description analysis of the gly/phe tetrapeptide as discussed above with regard to priority applies equally in the written description analysis. For the reasons given in our priority section, we agree with Petitioner that, in sum, a preponderance of the evidence shows the claims of the ’039 patent fail to comply with the written description requirement because the Specification fails to provide written descriptive support for the gly/phe tetrapeptide Ww subgenus recited in the claims of the ’039 patent.
Therefore, overall, we find that a preponderance of the evidence shows the claims 1–5, 9, and 10 of the ’039 patent fail to comply with the written description requirement.
ENABLEMENT
また、米国特許商標庁は、In re Wands(Wands factors)とともに最近のAmgen判決も引用して、本件特許クレームは実施可能(enablement)要件を満たさないと判断しました。
最近のAmgen判決も引用して、Amgenでの状況と一致していると述べている点は、今後の米国特許商標庁での抗体関連発明の実施可能要件についての審査実務の方向性として参考になる点かもしれません(Amgen判決については以下の記事をご参照ください)。
- 2023.05.19記事: 【速報】2023.05.18 「Amgen v. Sanofi」 米国最高裁No. 21–757 - Amgenの抗PCSK9抗体特許 実施可能要件非充足を理由に無効としたCAFC判決を米国最高裁も支持 -

The facts here are consistent with the situation in Amgen, which addressed a situation where the claimed “class of antibodies does not include just the 26 that Amgen has described by their amino acid sequences, but a ‘vast’ number of additional antibodies that it has not.” Amgen, 598 U.S. at 613. The description in the instant ’039 patent describes two drug classes (and no linkers within the scope of the claims) while encompassing a vast number of additional drugs that are not described. See Ex. 1001, 31:39–34:49. And, just as the Court in Amgen found, a description that leaves readers of the ’039 patent to “random trial-and-error discovery,” the evidence here also shows trial and error discovery where “[m]uch of the selection of the optimal antibody, the ideal linker–payload chemistry, and the optimal number of payload molecules linked per antibody molecule, are determined empirically.” Ex. 1040, 1016; Amgen, 598 US at 615.
Considering the Wands factors as a whole, we find that the large breadth of the claims, absence of working examples, limited amount of direction and guidance provided by the ’039 patent, unpredictability in synthesizing antibody-drug linker conjugates, and extensive quantity of experimentation are balanced against a high level of skill in the art and predictability in testing generated antibody-drug conjugates for intracellular cleavage. Based on our consideration of the entirety of the evidence, we find that a preponderance of the evidence supports the conclusion that undue experimentation would have been required to make and use the invention commensurate in scope with the claims of the ’039 patent.
2024年1月10日、米国特許商標庁は、112(a)条に基づく実施可能要件をどのように適用するかに関するガイダンスの通知を連邦官報(89 Fed. Reg. 1563)に掲載しました。このガイダンスには、前述のAmgen判決も取り上げられており、その判決を受けても、実施可能要件の判断にはこれまで同様Wands factors (In re Wands)を基準として用いていくと説明されています。
Patent and Trademark Office
[Docket No. PTO-P-2023-0013] Guidelines for Assessing Enablement in Utility Applications and Patents in View of the Supreme Court Decision in Amgen Inc. et al. v. Sanofi et al.
今回、’039特許は実施可能要件を満たさないとした米国特許商標庁の判断は、このガイダンスの発表直後に出されたものであることから、実施可能要件に対する今後の米国特許商標庁のスタンスを知ることのできる直近の具体的な実例として興味深いものと思われます。
ANTICIPATION
最後に、前述のとおり’039特許のクレームは優先権の利益を享受できないことから、Enhertu®の有効成分であるtrastuzumab deruxtecan(DS-8201)が記載された先行文献(Ogitani文献)により’039特許のクレームは新規性を失うとの第一三共の主張について、米国特許商標庁も同意しました。
We again note that in the priority analysis above, we found that the claims are not entitled to benefit to the priority applications. Thus, prior art encompasses any reference published prior to the filing date of July 10, 2019 of the ’039 patent.
We find that Petitioner has provided a detailed analysis comparing the limitations of the claims of the ’039 patent with the disclosure in Ogitani. See Pet. 68–72; Ex. 1009, 1041. The first structure recited in Figure 1 of Ogitani shows an ADC that is composed of an antibody, a linker, and a drug within the express scope of the claims of the ’039 patent as explained in the Petition and by Dr. Lambert. See Pet. 68–72. Ex. 1002 ¶¶158–162.
… In sum, after reviewing the record, we agree with Petitioner that a preponderance of the evidence shows 1–5, 9, and 10 of the ’039 patent are unpatentable as anticipated by Ogitani (Ex. 1009).
以上、米国特許商標庁は、Seagen社の’039特許のクレーム1~5、9、および10は無効であると結論付けました。
4.今後
この’039 特許は、CAFCに控訴中の特許権侵害訴訟において、Seagen社が主張の根拠としている唯一の特許であることから、おそらく、Seagen社はこの米国特許商標庁の無効判断を不服としてCAFCに上訴すると推測されます。
特許権侵害訴訟の地裁判決は、第一三共に対して、41.8百万ドルの損害賠償金に加え、2022年4月1日から’039特許が満了する2024年11月4日までのEnhertu®の米国売上に対する8%のロイヤルティの支払を命じるという第一三共にとって不利なものでしたが、Enhertu®の販売を差止めてはおらず、第一三共にとっては金銭面で’039特許が満了する2024年11月までの辛抱・・・という我慢の状況でした。
しかし、今回、PGRでは’039特許は無効という第一三共にとって有利な判断が示されたことで、現在係属中の特許権侵害訴訟において、CAFCも「第一三共はSeagen社に対して損害賠償金を支払う理由はない」という判断を下すのではないか・・・という第一三共にとってはポジティブな結果への期待が高まりました。
また、第一三共の抗体薬物複合体(ADC)技術の知的財産権の帰属を巡りSeagen社と第一三共との間で争われていた仲裁事件で、仲裁廷は、Enhertu®の有効成分であるトラスツズマブ デルクステカンおよび他のいくつかの医薬品候補に第一三共が使用した特定のADC技術に関する知的財産権がSeagen社に帰属するとの同社の主張を退けました。従って、第一三共は、Enhertu®や他のADC製品に対しても、Seagen社からのライセンスを得なければならない事態、すなわち、実施料等を長期にわたって支払い続けなければならない・・・というリスクは回避されています(下記記事をご参照ください)。


2023年10月には、第一三共の3つの抗体薬物複合体(ADC)製品であるパトリツマブ デルクステカン(HER3-DXd/U3-1402、抗HER3 ADC)、DS-7300(I-DXd、抗B7-H3ADC)及びDS-6000(R-DXd、抗CDH6 ADC)について、米Merck社と全世界での開発及び商業化契約の締結に至ったわけですし、第一三共には勢いがありますね!
- 2023.10.20 第一三共 press release: DXd-ADC 3製品に関するMerck & Co., Inc., Rahway, NJ, USAとのグローバル開発及び販売提携のお知らせ)
様々な紛争がSeagen社と第一三共との間で同時進行していましたが、残すところ、CAFCでの’039 特許の有効性判断が今後の焦点であり、この判断が出されれば、これまで争われていた一連の抗体薬物複合体(ADC)技術を巡る両社間の紛争が終結へ向かうと思われます。



コメント
【追加情報】
CAFC Case No. 24-1878 – Seagen Inc v. Daiichi Sankyo Co Ltd et al.
Filing Date: 2024-05-28