2023年12月6日の第一三共のプレスリリース「当社子会社の米国特許侵害訴訟(和解)に関するお知らせ」によると、Novartis社のBRAF阻害剤Tafinlar®(有効成分: dabrafenib)に関して、第一三共の米国子会社であるPlexxikon社が保有する米国特許9,469,640及び9,844,539を侵害しているとして、Plexxikon社が2017年8月に米国カリフォルニア州北部地区連邦地方裁判所に提起していた特許権侵害訴訟において、2022年10月27日、Novartis社が米国連邦巡回区控訴裁判所に控訴していましたが、2023年12月5日、全面的に和解する契約を締結したとのことです。
今回の和解により、Plexxikon社は、Novartis社より約182百万米ドルを一括で受け取り、係属中の訴訟はすべて取り下げられるとのことです。
これまでの経緯
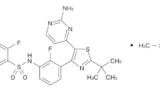
Plexxikon社は、BRAF阻害剤であるZelboraf®(有効成分: vemurafenib)の開発に成功(2011年8月にFDA承認)しています(以下に示す化学構造式がvemurafenib)。
つまり、Plexxikon社とNovartis社とは、BRAF阻害剤においてバチバチの競合関係にあります。
米国カリフォルニア州北部地区連邦地方裁判所は、
- 177.8百万ドルの損害賠償金
- 同特許存続期間中のTafinlar®の米国売上に対して、9%のロイヤルティ
をNovartis社がPlexxikon社に対して支払うべきである、と判断していました(なお、Novartis社の故意侵害は認められませんでした)(Plexxikon Inc. v. Novartis Pharmaceuticals Corporation, Civil Action No. 4:17-cv-04405 HSG (EDL) (N.D. Ca. filed Aug. 3,
2017))。
今回の和解では、地裁判決で言い渡された損害賠償金をほぼそのまま和解金として一括支払いを受けるPlexxikon社が、ロイヤルティ支払い分については求めず譲歩した形にまとまったようです。
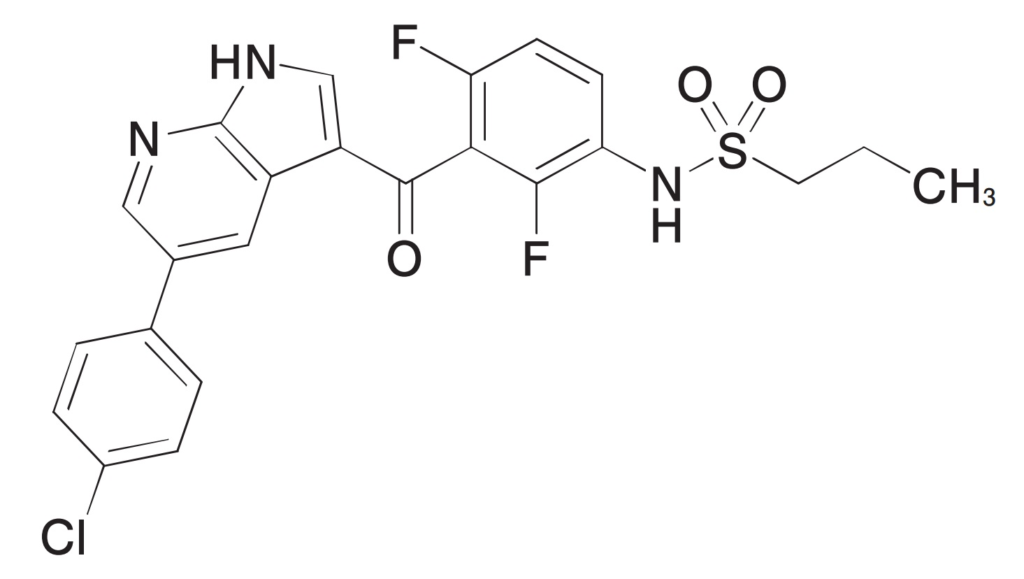
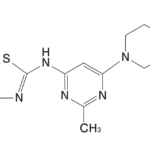
さて、特許権侵害として訴えられたNovartis社のBRAF阻害剤Tafinlar®は、当初GSK社が開発して2013年5月にFDAから承認され、その後Novartis社に承継されました。
有効成分はdabrafenibであり、以下の構造式の化合物です。
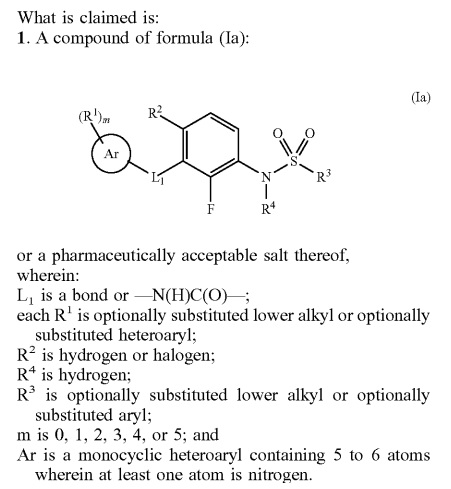
一方、訴訟を提起したPlexxikon社の2つの特許のうち、米国特許9,469,640は、2008年7月(優先日2007年)に出願されたものであり、登録されたクレーム1は以下のとおりとなっています。クレーム中のL1がbondであることがポイントです。
クレームは、L1=bondであることによってdabrafenibを包含することになります。なお、この特許は、Plexxikon社のvemurafenibを保護する物質特許ではありません。
この特許が米国特許庁で認められるまでの審査においては、このL1=bondである範囲まで認められるかどうか(Plexxikon社としては何とかdabrafenibを包含させてやろうという思いだったことでしょう)、その実施例が十分ではないとされ、記載要件の観点でPlexxikon社と米国特許庁との間で拒絶理由発出とその反論という攻防がありました(以下は記載要件(112条)を満たさないとする審査官からの拒絶理由通知の抜粋)。
結局、Plexxikon社の反論により、2016年10月にとうとう米国特許9,469,640として登録されました。
Novartis社は、このPlexxikon社の特許出願の審査経過を注視していたに違いありません。
しかし、とうとう、dabrafenibがそのクレームに捕獲されてしまいました。
そして、2017年8月に、Plexxikon社が、とうとうNovartis社に対して本件特許権侵害訴訟を提起するに至ります。
本件特許権侵害訴訟が裁判所で係属している中、2018年6月、Novartis社は、米国特許庁に米国特許9,469,640に対する無効を主張して当事者系レビューを申し立てましたが、2019年1月に棄却されています(Case IPR2018-01287)。
Plexxikon社の米国特許9,469,640の日本特許ファミリーにおいても、2016年の分割出願から、最後までL1=bondの点について審査官から拒絶を受けていました。
例えば、審査官は、拒絶理由通知(起案日平成29年8月7日)にて、
「「実施例2」という部分([0159]~[0163])には、L1が結合である態様の一般的で例示的な製造方法が記載されるのみである。たしかに当該方法によって製造されうることは予測できるが、化学物質の製造は、客観的に示すデータがなければ実証することはできないから、当該記載のみでは、L1が結合である化合物が実際に製造されたといえないことに変わりはない。・・・L1が結合である式Iaの化合物がRAFキナーゼ阻害作用を有することを示せば、本願の拒絶理由は解消しうるが、本願明細書にはL1が結合である式Iaの具体的な構造式が示されていない」
と述べています。
しかし、Plexxikon社の反論によりその拒絶理由は解消され、2018年に日本特許第6456900号として登録されました。dabrafenibは、日本でも特許クレームの範囲に包含されているように見えます。また、下位のクレームもdabrafenibに焦点を当てている構成に見えます。

L1=bondのクレーム範囲獲得に頑張ったPlexxikon社の知財部員(代理人)はボーナスですね。この頑張りのおかげで、競合企業から莫大な和解金を勝ち得たわけですしね。
何故か、欧州特許ファミリーにおいては、審査の過程で審査官からの拒絶理由(先行出願公開D2:WO2007/002325A (PLEXXIKON, 4 January 2007))を受け、抵抗することなく2011年11月23日付でL1からbondを削除する補正がなされ、2014年に登録に至りました(EP2170830B1)。その後、分割出願はされていないようです。従って、欧州では、dabrafenibは特許クレームの範囲外のようであり、何故かは分かりませんが、dabrafenibを包含させてやろうとする意欲はその経過を見ても感じられません・・・。これは不思議な点です。

最近、第一三共の特許係争のニュースが多いですねー。
参考:
- 2023.12.06 第一三共 press release: 当社子会社の米国特許侵害訴訟(和解)に関するお知らせ
- 2022.10.28 第一三共 press release: 当社子会社の米国特許侵害訴訟(控訴)に関するお知らせ
- 2022.09.30 第一三共 press release: Novartis社との特許係争に関するお知らせ
- 2011.08.18 第一三共 press release: 米国食品医薬品庁(FDA)から転移性悪性黒色腫治療剤Zelboraf(TM) (vemurafenib)の承認取得について
- 2013.05.29 GSK press release: Two new GSK oral oncology treatments, BRAF-inhibitor Tafinlar® (dabrafenib) capsules and the first MEK-inhibitor Mekinist™ (trametinib) tablets, approved by FDA as single-agent therapies
過去ブログ記事:



コメント