2023年11月7日、米国連邦取引委員会(FTC)は、喘息用吸入薬、エピネフリン自動注射器、およびその他の医薬品について製薬企業が保有する100件以上の特許が、米国食品医薬品局(FDA)が発行する「Orange Book」に不適切または不正確に収載されているとして、製薬企業10社に対して異議を唱える通知をしたことを発表しました。
- 2023.11.07 Federal Trade Commission press release: FTC Challenges More Than 100 Patents as Improperly Listed in the FDA’s Orange Book
Orange Bookへの特許の収載について、適用されるFDAの規制と矛盾しないかどうかが争われた場合、FDAは新薬承認申請(NDA)ホルダー(先発医薬品企業)にその旨を通知し、NDAホルダーは、30日以内に、このような収載を撤回もしくは修正するか、または偽証罪に問われることを覚悟の上で、収載が適用される法定・規制要件に準拠していることを証明しなければなりません(21 CFR§314.53(f))。
FTCは、FDAに対し、これらの特許に関する収載情報の正確性や関連性に異議があることを既に通知しているとのことで、通知を受けた製薬企業は、対応を迫られています。
Orange Bookに収載された特許情報の精査は今に始まったことではありませんが、FTCが独自にOrange Bookに収載された特許情報に異議を唱えたことは過去になく、今回のFTCの動きは、Orange Bookに収載された不適切または不正確な特許情報に対する批判を再燃させたといえます。
このFTCの大胆とも思える一手は、FTC、FDA、そして米国特許商標庁(USPTO)の連携を強化するとともに、Orange Bookの特許収載要件の明確化の流れにより、投与デバイス等を含むより複雑化・多様化する医薬品の開発と競争を促進する点において新たな意義を持つことになると思われます。
1.Orange Bookとハッチ・ワックスマン訴訟
 FDAが発行する「Approved Drug Products with Therapeutic Equivalence Evaluations」(通称「Orange Book」)は、「Drug Price Competition and Patent Term Restoration Act」(通称「Hatch-Waxman Act(ハッチ・ワックスマン法)」)に基づき、FDAが作成した出版物で、「Federal Food, Drug, and Cosmetic Act」(FD&C Act)に基づいて承認した医薬品を特定しています。
FDAが発行する「Approved Drug Products with Therapeutic Equivalence Evaluations」(通称「Orange Book」)は、「Drug Price Competition and Patent Term Restoration Act」(通称「Hatch-Waxman Act(ハッチ・ワックスマン法)」)に基づき、FDAが作成した出版物で、「Federal Food, Drug, and Cosmetic Act」(FD&C Act)に基づいて承認した医薬品を特定しています。
また、Orange Bookには、各医薬品を保護するとされる特許が明記されています。
ジェネリック医薬品企業がハッチ・ワックスマン法に基づき医薬品の承認を取得するためには、ジェネリック医薬品企業は、簡略新薬承認申請(ANDA)とともに、Orange Bookに収載された特許の満了までジェネリック医薬品の発売を待つことを宣誓するか、或いは特許が無効/権利行使不能であること又はジェネリック医薬品がその特許を侵害しないことの証明(パラグラフIV証明)を提出しなければなりません。
ジェネリック医薬品企業のANDA行為に対してNDAホルダー(先発医薬品企業)が特許権侵害訴訟(ハッチ・ワックスマン訴訟)を提起すれば、特許が有効かどうか/ジェネリック医薬品が侵害かどうか等の最終的な裁判所の判断を待つために、FDAにおけるジェネリック医薬品の承認手続きは、ハッチ・ワックスマン法に基づき、自動的に30ヶ月間停止されることになります。
すなわち、その停止措置が取られている期間に並行して、特許が有効かどうか/ジェネリック医薬品が侵害かどうか等について裁判で争われることになります。
2.FTCは何を問題視しているのか
しかし、Orange Bookへの特許の収載が、適用される法律・規制要件をそもそも満たさない不適切なものであった場合に問題が生じます。
Orange Book Transparency Act of 2020(記事参照: オレンジブック・パープルブックに関連する法改正)によって改正された合衆国法律集第21編第355条(21 U.S.C. § 355)に基づき、NDAホルダー(先発医薬品企業)は、Orange Bookに収載する対象として、以下クレイムしている特許リストをFDAに提出しなければならないとされています(section 505(b)(1)(A)(viii) of the FD&C Act (21 U.S.C. 355(b)(1)(A)(viii)); see also 21 CFR§314.53)。
(II) claims a method of using such drug for which approval is sought or has been granted in the application.
本来、上記発明をクレイムしていない特許はOrange Bookの収載対象ではないにもかかわらず、不適切にその特許が収載されてしまった場合には、ジェネリック医薬品企業は、その特許収載の不適切性について争うか、その特許満了を待つか、バラグラフIV証明を提出する必要があり、ハッチ・ワックスマン訴訟が提起されてしまえば、自動的に30ヶ月間のジェネリック医薬品承認停止措置をNDAホルダー(先発医薬品企業)が享受することになってしまいます。
結果として、Orange Bookの不適切な特許収載は、安価なジェネリック医薬品との健全な競争を阻害してしまう可能性があるわけです。

Orange BookにREMS特許収載で物議を醸した「Jazz v. Avadel事件 No. 23-1186 (Fed. Cir. Feb. 24, 2023)」は有名ですね
今回の異議を唱える通知書の発行に先立ち、FTCは、リスク評価緩和戦略(Risk evaluation and mitigation strategy (REMS))をカバーする特許のOrange Bookへの収載の是非をめぐる訴訟に介入し、REMSに関する特許は原薬、医薬品、使用方法をカバーしていないため、Orange Bookへの収載は認められないと主張しました(Brief for Fed. Trade Comm’n as Amicus Curiae, Jazz Pharms., Inc. v, Avadel CNS Pharms. No. 1:21-cv00691 (D. Del. Nov. 10, 2022) (Doc. No. 22-3).)。
そして、9月14日、FTCは政策声明を発表し、Orange Bookに収載されている特許の適切性を精査すると警告していました。
- 2023.09.14 FTC press release: FTC Issues Policy Statement on Brand Pharmaceutical Manufacturers’ Improper Listing of Patents in the Food and Drug Administration’s ‘Orange Book’
3.FTCが異議を唱えた10社とその特許とは
FTCは以下の10社に通知書を送付しました。
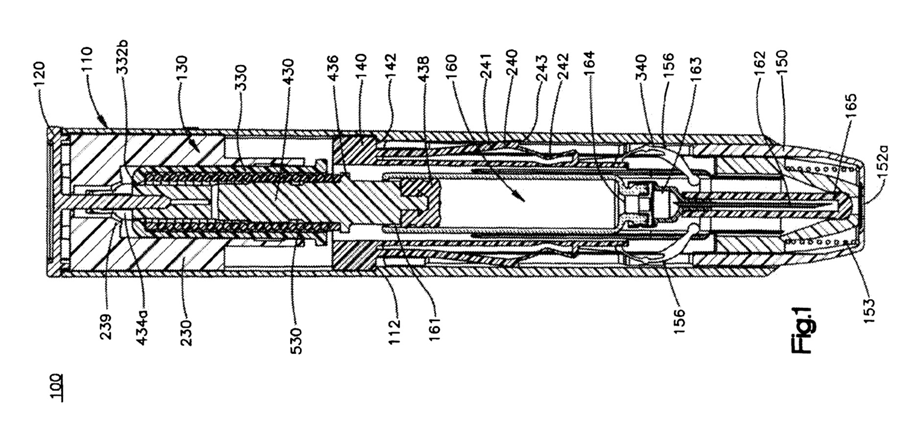
詳細は以下の各リンクから確認できますが、総じて、いずれも医薬品そのもの(active ingredient、formulationまたはcomposition)を格納している投与デバイス(吸入器や注射デバイス)をクレイムしている特許のようです。
- Teva Branded Pharmaceutical: ProAir HFA、ProAir DigiHaler、QVAR 40・・・例えば、米国特許8,651,103は、”dry powder inhalation apparatus”をクレイムしており、吸入デバイスを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Norton Limited: QVAR RediHaler・・・例えば、米国特許8,132,712は、”dose counter”や”dose inhaler”をクレイムしており、吸入デバイスのカウンターを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Mylan Specialty LP: EPIPEN、EPIPEN JR・・・例えば、米国特許7,449,012は、”auto-injectior”をクレイムしており、注射デバイスを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Kaleo Inc: AUVI-Q・・・例えば、米国特許7,731,686は、薬剤を送達するデバイスを含む”apparatus”をクレイムしており、注射デバイス装置を保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Impax Labs: Adrenaclick・・・例えば、米国特許7,905,352は、”medicine injection device”と”container”との”kit”をクレイムしており、注射デバイスと容器を保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Glaxo Smith Kline: Arnuity Ellipta、Ventolin HFA・・・例えば、米国特許8,113,199は、”dose counter”をクレイムしており、吸入デバイスのカウンターを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Glaxo Group: Advair HFA、Flovent HFA・・・例えば、米国特許7,500,444は、”actuation indicator”をクレイムしており、吸入デバイスのカウンターを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Boehringer Ingelheim: Atrovent HFA、Combivent Respimat、Spiriva、Spiriva Respimat・・・例えば、米国特許7,284,474は、”piston pumping system”をクレイムしており、吸入デバイス製品を製造するために必要なシステムを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Astrazeneca LP: Symbicort・・・例えば、米国特許7,587,988は、”inhaler counter”をクレイムしており、製品である吸入デバイスのカウンターを保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
- Abbvie, Inc.: Restasis Multidose・・・例えば、米国特許8,292,129は、”dispensing device”をクレイムしており、製品である容器を保護しているのかもしれませんが、医薬品そのもの(active ingredient、formulationまたはcomposition)を対象とはしていないように思えます。
4.定義の曖昧さ
Orange Bookに収載する対象として、どのようなクレイムの特許リストをFDAに提出しなければならないかは前述したとおり、「drug product」をクレイムしたものでなければならないとされていますが、さらに細則を規程している連邦規則集Code of Federal Regulations(CFR)には、「drug product」の定義を以下のように定めています(21 CFR§314.3(b))。
さらに、2003年6月18日の連邦官報告示(FDA, Final Rule, 68 Fed. Reg. 36676 at 36680 (June 18, 2003))に含まれるFDAのガイダンス(21 CFR§314)によると、「Orange Bookの収載対象には、定量エアゾール、カプセル、定量スプレー、ゲル、プレフィルド薬物送達システムなどが含まれる」と述べられています。
FDAは、21 CFR§314.3(b)の 「drug product」および「dosage form」の定義の解釈を、投与デバイス特許のリストに関連するものであるのか否か明確にすべきであるのかもしれません。
投与デバイス特許がOrange Bookに「収載されるべきである」とするならば、そのようなデバイスのどのような機能をクレイムすることが対象となるかを明確にすべきではないでしょうか。
しかし、FDAは、USPTOのような特許の専門知識を持っているわけではありません。
そして、今回のFTCからの異議を唱えた通知書には、なぜその特許のクレイムの対象が法律上の「drug product」または「finished dosage form」の定義に該当しないかについての理由は記載されていません。
明確なガイダンスの公表や、法律・規則の明確化がなされない限り、NDAホルダー(先発医薬品企業)としては、Orange Bookへの特許収載義務を果たすために、投与デバイスは「final dosage form」としての「drug product」に該当し得ると解釈可能であることから、投与デバイス特許もOrange Bookに収載するという「保守的な態度」をとらざるを得ないということもあるかもしれません。
このOrange Bookへの特許収載要件の不明確性の問題について、製薬企業は18年も前からFDAに対して規則の明確化の改善を求めてきたそうです。
- 2023.03.15 United States Government Accountability Office (GAO) Report to Congressional Committees: GENERIC DRUGS: Stakeholder Views on Improving FDA’s Information on Patents (GAO-23-105477) p25 text box参照
FDAは、2022年1月の議会への報告書において、Orange Bookに含めるべきまたは削除すべき特許の種類に関してさらなる明確化が必要かどうかを評価するために、FDA内に多角的な専門分野にわたるワーキンググループを設置することを表明していました。
- FDA Report to Congress: The Listing of Patent Information in the Orange Book (December 2021)
にもかかわらず、FDAからは明確なガイダンスも公表されないまま、今回、FTCが製薬企業側に対して異議を唱える形となってしまいました。
米国バイオテクノロジーイノベーション協会(Biotechnology Innovation Organization (BIO))のVP for Intellectual propertyであるHans Sauer氏は、今回の製薬企業側を非難するかのようなFTCの攻撃的な行動に対して、疑問を呈しました。
- 2023.11.21 BIO.News: FTC’s aggressive questions on patents registered with FDA is harmful overreach, expert says
“Ironically, some of the exact same companies that have asked the FDA for clarification without receiving an answer for 18 years are now being threatened with enforcement by the FTC.“
“Disappointingly, despite its own regulatory inaction, FDA has issued statements that it ‘appreciates and supports’ the FTC’s aggressive but unfounded threats of enforcement against drugmakers in a space that FDA should have addressed long ago”
“What is needed at this point is not the threat of enforcement or legal liability, but rather, increased regulatory clarity and a forum for stakeholders and regulators to jointly and proactively address new patent listing questions that are likely to arise with further technological advances”
「皮肉なことに、FDAに18年間も回答を得ずに説明を求めてきたのとまったく同じ企業が、今、FTCから強制執行の脅しを受けている。・・・失望すべきことに、FDAは自らの規制上の不作為にもかかわらず、FTCの医薬品メーカーに対する積極的だが根拠のない強制執行の脅しを『評価し支持する』という声明を発表している。・・・ここで必要なのは、エンフォースメントの脅威や法的責任ではなく、むしろ規制の明確化を図ることであり、さらなる技術の進歩に伴って生じると思われる新たな特許上の疑問にステークホルダーと規制当局が共同且つ積極的に対処するためのフォーラムの存在である」(訳)
製薬企業が、Orange Bookへの明らかに不適切な特許収載を意図的に行っているとしたら問題です。
しかし、法律・規則の明確化が行われない限り、解釈の議論は平行線のままとならざるを得ません。
Sauer氏が言うように、ステークホルダーと規制当局が共同して、規制の明確化を図ることが望ましいのではないでしょうか。
各社の対応、FDAの対応、そしてFTCの今後のアクションを注視していく必要があります。

米国のパテントリンケージが法律の不明確な部分があることやFDAからの煮え切らない態度で揉めているのは、日本の状況に似ているかも?

いや、いや・・・米国は疑問点があれば声を上げ、公に議論することが当たり前ですよね~。
それに対して、日本は・・・。
しかも日本ではパテントリンケージの法律すら無いのですから・・・レベルが違いますよね~ピポ先輩~。

そだねー。
5.参考
- 2023.11.07 Federal Trade Commission press release: FTC Challenges More Than 100 Patents as Improperly Listed in the FDA’s Orange Book
- 2023.03.15 United States Government Accountability Office (GAO) Report to Congressional Committees: GENERIC DRUGS: Stakeholder Views on Improving FDA’s Information on Patents (GAO-23-105477)
- FDA Report to Congress: The Listing of Patent Information in the Orange Book (December 2021)
- 2023.11.21 BIO.News: FTC’s aggressive questions on patents registered with FDA is harmful overreach, expert says
- Lina Khan (Chair, Federal Trade Commission): Comments on X (Twitter) (2023.11.08)

コメント
【進展情報メモ】
少なくともImpax社とKaleo社はFTCからの警告に従い、指摘された特許を対象製品のOrangebookから削除する対応をとったようです。Orangebookにそれら特許は既に見当たりません。
参考: FTC Spoke, Kaleo and Impax Listened: Orange Book Patent Delistings Begin – JD Supra
https://www.jdsupra.com/legalnews/ftc-spoke-kaleo-and-impax-listened-9904310/
【進展情報メモ】
FTCは標的特許を拡大したようです。
2024.04.30 FTC press release: FTC Expands Patent Listing Challenges, Targeting More Than 300 Junk Listings for Diabetes, Weight Loss, Asthma and COPD Drugs
Commission challenges junk patent listings for Ozempic, Victoza, Saxenda and other blockbuster prescription medications
https://www.ftc.gov/news-events/news/press-releases/2024/04/ftc-expands-patent-listing-challenges-targeting-more-300-junk-listings-diabetes-weight-loss-asthma
“Today, the Federal Trade Commission expanded its campaign against pharmaceutical manufacturers’ improper or inaccurate listing of patents in the Food and Drug Administration’s (FDA) Orange Book, disputing junk patent listings for diabetes, weight loss, asthma, and COPD drugs, including Novo Nordisk Inc.’s blockbuster weight-loss drug, Ozempic.”
The warning letters were sent to:
Teva Branded Pharmaceutical Products R&D, Inc. v. Amneal Pharmaceuticals of New York, LLC, No. 23-20964 (SRC) (D.N.J. June 10, 2024).
https://www.reuters.com/legal/litigation/amneal-us-ftc-win-order-removing-teva-inhaler-patents-fda-list-2024-06-10/
https://ipwatchdog.com/2024/06/12/amneal-aided-ftc-succeeds-getting-teva-patents-removed-orange-book/id=177969/
Teva Branded Pharmaceutical Products R&D, Inc. v. Amneal Pharmaceuticals of New York, LLC, No. 2024-1936 (Fed. Cir. July 10, 2024).
https://natlawreview.com/article/ftcs-challenge-listing-device-patents-orange-book-what-challenge
https://today.westlaw.com/Document/I531c4970503b11ef86cdc95ec2033825/View/FullText.html
Teva事件は米国連邦巡回区控訴裁判所(U.S. Court of Appeals for the Federal Circuit; CAFC)に控訴されましたが(Teva v. Amneal, No. 2024-1936 (Fed. Cir. July 10, 2024))、2024年12月20日、CAFCは、オレンジブックに特許を収載するには、特許は少なくとも承認された医薬品の有効成分をクレームしていなければならないと判示し、地裁の判断を支持する判決を下しました。
https://cafc.uscourts.gov/opinions-orders/24-1936.OPINION.12-20-2024_2439730.pdf
“To summarize, our analysis of the numerous relevant statutory provisions and the relevant case law leads us to only one conclusion: To list a patent in the Orange Book, that patent must, among other things, claim the drug for which the applicant submitted the application and for which the application was approved. And to claim that drug, the patent must claim at least the active ingredient. Thus, patents claiming just the device components of the product approved in an NDA do not meet the listing requirement of claiming the drug for which the applicant submitted the application.”