 ブリストル・マイヤーズ スクイブ株式会社(以下「BMS Japan」)のプレスリリースによると、2023年11月28日、東京地方裁判所から、沢井製薬に対し、BMS Japan が製造販売承認を取得している「スプリセル®錠 20 mg/50mg」(一般名:ダサチニブ水和物)の後発医薬品である沢井製薬の「ダサチニブ錠 20mg/50mg 「サワイ」」(対象製品)に関し、当該製品に係る製造販売行為等を禁止する仮処分命令が発出されたとのことです。本件仮処分命令の詳細についても公表されています(リンク)。
ブリストル・マイヤーズ スクイブ株式会社(以下「BMS Japan」)のプレスリリースによると、2023年11月28日、東京地方裁判所から、沢井製薬に対し、BMS Japan が製造販売承認を取得している「スプリセル®錠 20 mg/50mg」(一般名:ダサチニブ水和物)の後発医薬品である沢井製薬の「ダサチニブ錠 20mg/50mg 「サワイ」」(対象製品)に関し、当該製品に係る製造販売行為等を禁止する仮処分命令が発出されたとのことです。本件仮処分命令の詳細についても公表されています(リンク)。
- 2023.11.29 ブリストル・マイヤーズ スクイブ press release: 沢井製薬のダサチニブ錠に関し、製造販売行為を禁止する東京地方裁判所による仮処分命令の発出
本件仮処分命令により、今後、沢井製薬は、BMS Japan の関連会社であるブリストル マイヤーズ スクイブ ホールディングス アイルランド アンリミテッド カンパニー(以下「BMS Ireland」、BMS Japan と併せて、以下「BMS」)が保有する特許第3989175号に係る特許権(以下「本件特許権」)の存続期間が満了する2024年1月27日まで、「慢性骨髄性白血病(ただし、イマチニブ抵抗性の慢性骨髄性白血病を除く。)」を「効能又は効果」に含む添付文書を改訂しない限り、対象製品の製造販売行為をすることができなくなること、及び、BMS Japan は、ダサチニブ製剤を必要とされる患者さんに確実にお届けできるよう、「スプリセル®錠 20 mg/50mg」の在庫により十分賄える態勢を整えていることを伝えています。
BMSは、本件特許権に基づき、2023年7月18日付けで東京地方裁判所に仮処分申立事件を提起し、沢井製薬に対して、BMS Japan が製造販売承認を取得している「スプリセル®錠 20 mg/50mg」(一般名:ダサチニブ水和物)の後発医薬品である沢井製薬の対象製品について、「慢性骨髄性白血病(ただし、イマチニブ抵抗性の慢性骨髄性白血病を除く。)」を「効能又は効果」に含む対象製品を製造販売する行為は本件特許権を侵害するものであるとして、沢井製薬による同行為の差し止めを求めていました(令和5年(ヨ)第30214号仮処分命令申立事件)。
- 2023.10.06 ブリストル・マイヤーズ スクイブ株式会社 press release: 沢井製薬のダサチニブ錠に関する発表について
- 2023.11.06 ブリストル・マイヤーズ スクイブ株式会社 press release: 沢井製薬のダサチニブ錠に関する発表について
本当の問題点
本件仮処分申立てが提起されている中、2023年10月4日、厚生労働省は、沢井製薬の対象製品の「効能又は効果」に「慢性骨髄性白血病」を追加する承認をしました。
- 2023.10.04 沢井製薬 press release: ダサチニブ錠 20mg/50mg「サワイ」 – 「効能又は効果」「用法及び用量」追加承認取得のお知らせ –)。
特許第3989175号はダサチニブに関する物質特許であり、スプリセル®錠20mg/50mgについて「慢性骨髄性白血病(ただし、イマチニブ抵抗性の慢性骨髄性白血病を除く。)」を「効能又は効果」とする追加承認に基づいて特許権存続期間の延長登録(特願2011-700199/特願2011-700200)が認められ、存続期間満了日は2024年1月27日となっています。
すなわち、2023年10月4日の沢井製薬の「効能又は効果」の追加承認は、ダサチニブに関する物質特許に係る延長された特許権が存在しており、特許権侵害訴訟が既に起きている最中での、厚生労働省が下した判断となります。
ここで問題となるのが、後発医薬品の承認にあたっては先発医薬品の特許の存在を考慮する仕組み(パテントリンケージ)の存在です。
「医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(各都道府県衛生主管部(局)長あて厚生労働省医政局経済課長・厚生労働省医薬食品局審査管理課長通知)(平成21年6月5日付け医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号審査課長通知)」において、後発医薬品の薬事法(現・薬機法)上の承認審査にあたっては、
- 先発医薬品の有効成分に特許が存在する場合には後発医薬品を承認しないこと
- 先発医薬品の特許が存在する効能・効果、用法・用量(効能・効果等)については承認しない方針であること
- 特許の存否は承認予定日で判断するものであること
を従前より定めており、この厚生労働省からの通知(以下、「二課長通知」という。)に従えば、沢井製薬の今回の「効能又は効果」の追加は、前記延長された特許権の存在により本来承認されないはずです。
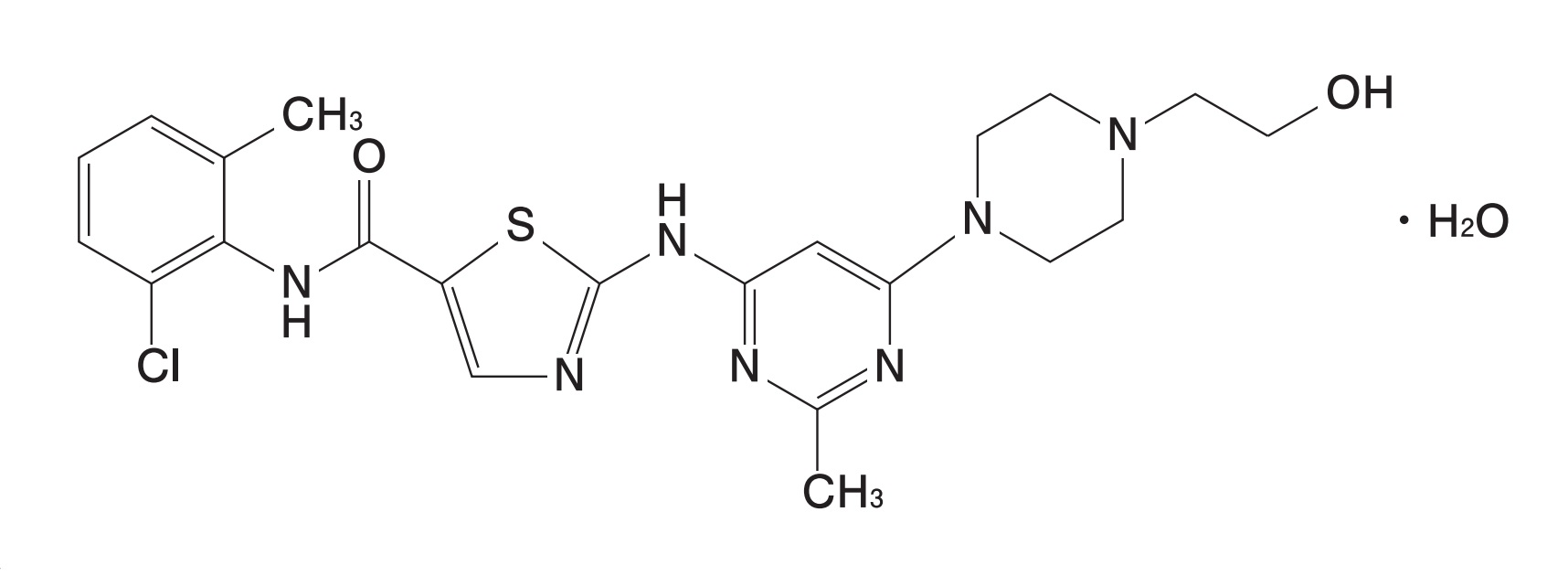
しかし、先発医薬品であるスプリセル®錠20mg/50mgの有効成分は「ダサチニブ水和物」として錠剤に含有されているのに対し、沢井製薬の対象製品の有効成分は「ダサチニブ(無水物)」であるという違いがあります。
スプリセル®錠の物質特許に係る特許権はその存続期間が延長されたため現在も存続していますが、もしかすると、厚生労働省は、有効成分が「ダサチニブ水和物」として含有されている先発医薬品スプリセル®錠について延長された特許権の効力が、有効成分が「ダサチニブ無水物」として含有されている後発医薬品に及ぶのかどうか判断できず、二課長通知の運用(パテントリンケージ)を機能させることをあきらめて当事者間での特許紛争に委ねたのではないかと推測されます。
なお、承認申請の審査上、水和物/無水物の違いがあっても、それは同じ有効成分として取り扱われることが規定されており(平成23年6月16日付け薬食審査発0616第1号 厚生労働省医薬食品局審査管理課長通知「異なる結晶形等を有する医療用医薬品の取扱いについて」)、これを踏まえれば、スプリセル®錠と沢井製薬の対象製品との間に水和物/無水物の違いがあろうとも、厚生労働省は同じ有効成分として取り扱っているはずであり、その一方で、厚生労働省が二課長通知の運用(パテントリンケージ)を機能させなかったことには大きな違和感があるように思われます。
- 2023.10.17記事: ブリストル・マイヤーズ スクイブが沢井製薬ダサチニブ錠の効能追加販売に対し特許権侵害の差止仮処分命令申立て
このような運用事例は、沢井製薬のシタグリプチンリン酸塩錠(ジャヌビア®錠の後発医薬品)の製造販売承認でも見られています。
今回の厚生労働省の承認判断は、二課長通知の運用(パテントリンケージ)を形式的にも実質的にも逸脱しているのではないかとの疑問があります。
厚生労働省の今回の二課長通知の運用(パテントリンケージ)は、当事者間の紛争に収まらず、業界全体において大きな議論を生むかもしれません。
参照:



コメント
2023.12.01 沢井製薬 press release: ダサチニブ錠 20mg/50mg「サワイ」に対する仮処分命令について
https://www.sawai.co.jp/release/detail/621
「本件仮処分命令は、令和6年1月27日までの製造販売等を禁止するものであり、その根拠となった特許権は、同日の経過を以て権利期間が満了いたします。権利期間満了後、速やかに当社製品の製造販売を再開し、引き続き安定供給に支障が生じないよう最大限の努力を行って参ります。
なお、当社としては、本件仮処分命令は極めて不当な判断であると考えており、早急に裁判所に対し異議を申し立てるなど、適切な対応を行っていく所存です。」
いつも興味深い事件のご紹介、有難うございます。
個人的な意見として、ダサチニブ等の水和物・無水物に関するパテントリンケージ適用の可否判断は、ブランド品の有効成分の一般名称(JAN:ダサチニブ水和物)とジェネリックの有効成分の一般名称(JAN:ダサチニブ)が異なることが影響しているように思いました。加えて、薬事上も、「既承認医薬品の原薬を異なる・・・水和物/無水物の原薬に切り替える場合には、原則として、代替新規承認申請で取扱うこととする。」(薬食審査発 0616第1号)とされています。一般名が異なること、及び薬事上も厳密には同じものはみなしていないことから、当局は、延長された特許権の効力に係る条文の「処分の対象となつた物」をダサチニブ水和物と限定解釈したのではと思いました。官僚的には、拡大解釈よりもこの限定解釈の方が釈明しやすいように思います。この解釈は、先発メーカーにとっては死活問題になる可能性がありますが、拡大解釈すべきという判例が出るまで、維持されるおそれがありますね。特許期間延長制度の趣旨を鑑みると、個人的にはある程度は拡大解釈されるべきと思います。
コメントありがとうございました!
今回の地裁の仮処分命令を受けてか、それとも判決が明らかになってからか、厚労省がもしそのような限定解釈をしているのだとしたら、改めることになるのでしょうね。延長された特許権の効力を厚労省が判断できるとは思えませんし・・・。沢井製薬は不服のコメントを発していますから、これから裁判でどうなるのか、見守るしかありませんね。
2023.12.08 ブリストル・マイヤーズ スクイブ株式会社 press release: レブラミドおよびスプリセルのオーソライズド・ジェネリックを発売
「抗悪性腫瘍剤スプリセル®錠 20mg、同錠 50mg(一般名:ダサチニブ水和物)のオーソライズド・ジェネリック(AG)について、本日の薬価収載を受け、販売を開始しました。」
https://www.bms.com/assets/bms/japan/pressrelease/20231208.pdf
2023.08.16 ブリストル・マイヤーズ スクイブ株式会社 press release: スプリセルのオーソライズド・ジェネリックの製造販売承認を取得
https://www.bms.com/assets/bms/japan/pressrelease/20230816.pdf
BMSの代理人(阿部・井窪・片山法律事務所)が事件についてコメントを発信(2024.01.09)
Japan: Sawai’s Generic Drug is approved by the MHLW amid patent litigation with Bristol-Myers Squibb, but the Court orders preliminary injunction against Sawai soon after
Mami Hino, Naho Ebata, Shoichiro Kajinami (Abe, Ikubo & Katayama)/January 9, 2024
https://patentblog.kluweriplaw.com/2024/01/09/japan-sawais-generic-drug-is-approved-by-the-mhlw-amid-patent-litigation-with-bristol-myers-squibb-but-the-court-orders-preliminary-injunction-against-sawai-soon-after/
2024年1月31日、厚生労働省は、東和薬品、日本ジェネリック、日本化薬のダサチニブ(無水物)の効能追加承認を出しました。問題となっていた特許第3989175号に係る特許権が1月27日に満了してパテントリンケージを解除したことによるこのタイミングと思われます。沢井製薬の効能追加承認は何だったのでしょうか・・・。