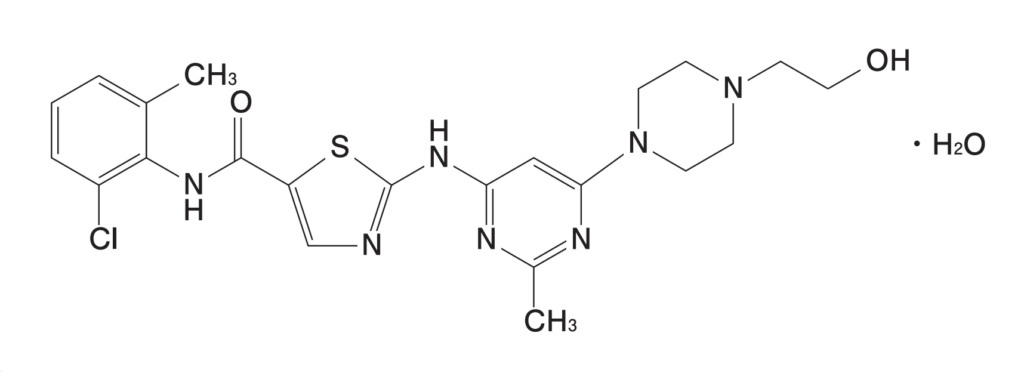
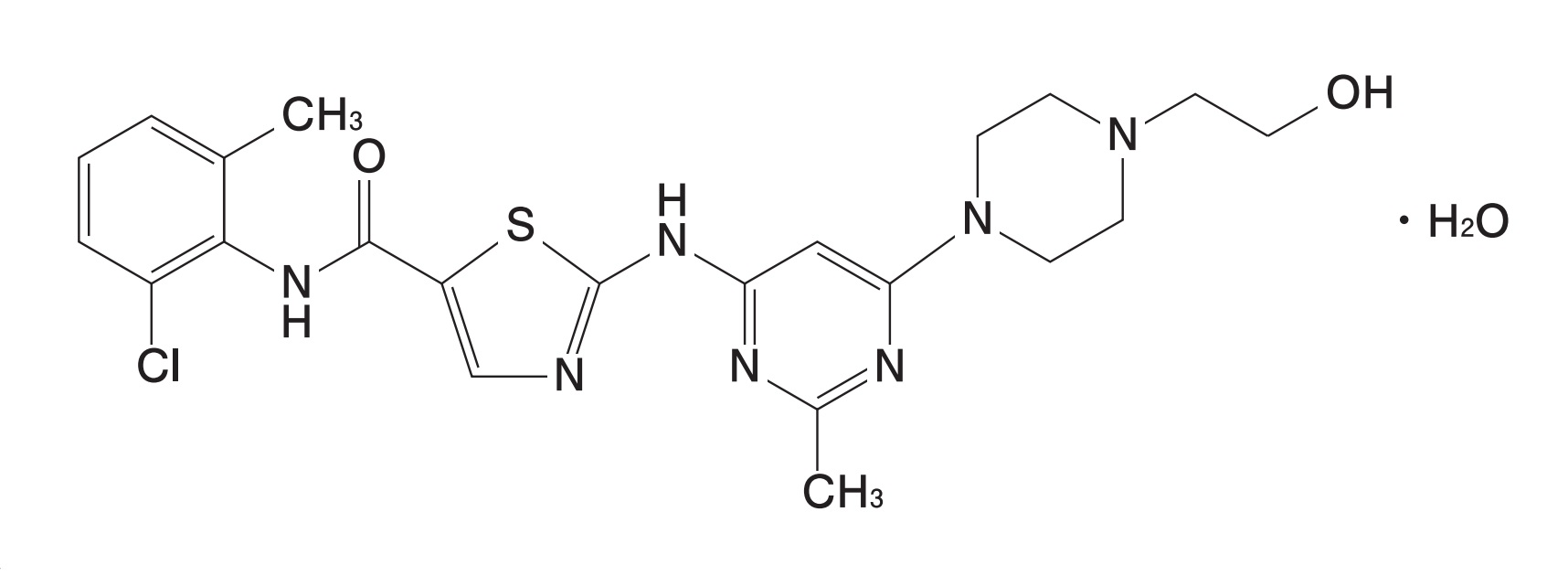
 2023年10月4日、スプリセルⓇ錠20mg/50mg(一般名:ダサチニブ水和物)の後発医薬品である沢井製薬のダサチニブ錠20mg/50mg「サワイ」(以下「対象製品」という。)の「効能又は効果」に「慢性骨髄性白血病」が追加承認されましたが(2023.10.04 沢井製薬 press release: ダサチニブ錠 20mg/50mg「サワイ」 – 「効能又は効果」「用法及び用量」追加承認取得のお知らせ –)、「慢性骨髄性白血病(ただし、イマチニブ抵抗性の慢性骨髄性白血病を除く。)」を「効能又は効果」に含む対象製品を製造販売する行為は、BMS Ireland が保有する特許第3989175号に係る特許権を侵害するものであるとして、BMS Irelandは、既に、2023年7月18日、東京地方裁判所に対して、沢井製薬による対象行為の差し止めを求める仮処分命令申立事件を提起しているとのことです。
2023年10月4日、スプリセルⓇ錠20mg/50mg(一般名:ダサチニブ水和物)の後発医薬品である沢井製薬のダサチニブ錠20mg/50mg「サワイ」(以下「対象製品」という。)の「効能又は効果」に「慢性骨髄性白血病」が追加承認されましたが(2023.10.04 沢井製薬 press release: ダサチニブ錠 20mg/50mg「サワイ」 – 「効能又は効果」「用法及び用量」追加承認取得のお知らせ –)、「慢性骨髄性白血病(ただし、イマチニブ抵抗性の慢性骨髄性白血病を除く。)」を「効能又は効果」に含む対象製品を製造販売する行為は、BMS Ireland が保有する特許第3989175号に係る特許権を侵害するものであるとして、BMS Irelandは、既に、2023年7月18日、東京地方裁判所に対して、沢井製薬による対象行為の差し止めを求める仮処分命令申立事件を提起しているとのことです。
参照:
- 2023.10.06 ブリストル・マイヤーズ スクイブ株式会社 press release: 沢井製薬のダサチニブ錠に関する発表について
特許第3989175号はダサチニブに関する物質特許であり、スプリセルⓇ錠20mg/50mgについて「慢性骨髄性白血病(ただし、イマチニブ抵抗性の慢性骨髄性白血病を除く。)」を「効能又は効果」とする追加承認に基づいて特許権存続期間の延長登録(特願2011-700199/特願2011-700200)が認められ、存続期間満了日は2024年1月27日となっています。
「医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(各都道府県衛生主管部(局)長あて厚生労働省医政局経済課長・厚生労働省医薬食品局審査管理課長通知)(平成21年6月5日付け医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号審査課長通知)」において、後発医薬品の薬事法(現・薬機法)上の承認審査にあたっては、
- 先発医薬品の有効成分に特許が存在する場合には後発医薬品を承認しないこと
- 先発医薬品の特許が存在する効能・効果、用法・用量(効能・効果等)については承認しない方針であること
- 特許の存否は承認予定日で判断するものであること
を従前より定めており、この厚生労働省からの通知(以下、「二課長通知」という。)に従えば、沢井製薬の今回の「効能又は効果」の追加は、前記延長された特許権の存在により本来承認されないはずです。
しかし、先発医薬品であるスプリセルⓇ錠20mg/50mgの有効成分は「ダサチニブ水和物」として錠剤に含有されているのに対し、沢井製薬の対象製品の有効成分は「ダサチニブ(無水物)」であるという違いがあります。
スプリセルⓇ錠の物質特許に係る特許権はその存続期間が延長されたため現在も存続していますが、もしかすると、厚生労働省は、有効成分が「ダサチニブ水和物」として含有されている先発医薬品スプリセルⓇ錠について延長された特許権の効力が、有効成分が「ダサチニブ無水物」として含有されている後発医薬品に及ぶのかどうか判断できず、二課長通知の運用(パテントリンケージ)を機能させることをあきらめて当事者間での特許紛争に委ねたのではないかと推測されます。
厚生労働省の今回の二課長通知の運用(パテントリンケージ)は、当事者間の紛争に収まらず、業界全体において大きな議論を生むかもしれません。
参照:
- 日本のパテントリンケージの現状の課題とその解決に向けた提案
- 【アンケート】パテントリンケージとして運用されている二課長通知の問題点は何だと思いますか?
- ジェネリック医薬品と特許(gemedicines): シタグリプチン(投稿日: 2023年9月16日、URL: https://gemedicines.blogspot.com/2023/09/blog-post.html)

コメント
2023.11.06 ブリストル・マイヤーズ スクイブ株式会社 press release: 沢井製薬のダサチニブ錠に関する発表について
https://www.bms.com/assets/bms/japan/pressrelease/20231106.pdf
1か月前の発表ではあまり気づいてもらえなかったから再びプレスリリース?
相当怒っているってことでしょうか。