アクテムラ®(Actemra®)(一般名: トシリズマブ (tocilizumab))は、日本発のグローバルな抗体医薬品であって、世界初のIL-6阻害剤であり、関節リウマチ等の治療薬として承認を受け(米国では2010年1月8日)、2022年における全世界の売上は2,701mCHF(内USは1,196mCHF=約2000億円)に至っています(Roche’s Full-Year 2022 Presentation with appendix)。
2023年10月24日、中外製薬は、そのアクテムラ® に関して米国で争っていた特許権侵害訴訟に進展があった旨をプレスリリース(「米国における特許権侵害訴訟の和解に関するお知らせ」)で発表しました。
具体的には・・・
アクテムラ®に対するバイオ後続品の簡略生物製剤承認申請(abbreviated biologics license application (aBLA))を行ったBiogen MA Inc.(以下、「Biogen」)ならびに当該バイオ後続品の開発等を行う Bio-Thera Solutions, Ltd.(以下、「Bio-Thera」)に対して、当該承認申請にかかるバイオ後続品が、中外製薬、ロシュ社及びジェネンテック社(以下、まとめて「中外ら」)が米国で保有する特許権を侵害しているとして、中外らが、米国生物製剤価格競争・革新法(Biologics Price Competition and Innovation Act:BPCIA)に基づく特許権侵害の確認を求め、2023年7月13日(米国現地時刻)に、米国マサチューセッツ州連邦地方裁判所にて提起した訴訟(いわゆるBPCIA訴訟)に関し、2023年10月23日(米国現地時刻)付で、中外らが、BiogenならびにBio-Theraと全世界における和解が成立したとのことです。
本件和解の成立に伴い、中外らはBiogenならびにBio-Theraと共同で、当該特許権侵害訴訟の取り下げ手続きを行うとのことです。
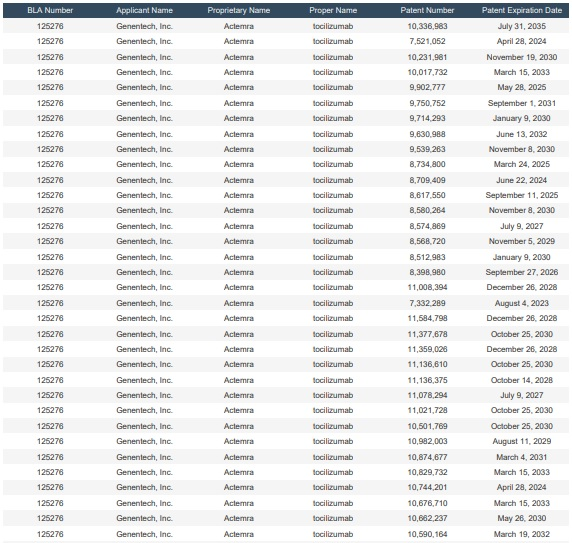
本件訴訟(Genentech, Inc. v. Biogen MA Inc., 1:23-cv-11573, (D. Mass.))の対象となっていた米国特許は、静脈内注射製剤に関連する用途特許ならびにトシリズマブの製造方法に関するもので、7,332,289; 7,521,052; 8,398,980; 8,512,983; 8,574,869; 8,734,800; 9,714,293; 9,902,777; 10,017,732; 10,336,983; 10,501,769; 10,662,237; 10,676,710; 10,744,201; 10,829,732; 10,982,003; 11,021,728; 11,078,294; 11,136,610; 11,377,678の計20の特許群でした。
本件による中外製薬の2023年12月期の連結業績への影響は軽微とのことです。
関連記事:

コメント