はじめに
令和5年度の弁理士試験論文式筆記試験(必須科目)[特許・実用新案]の問題Ⅱでは、医薬系特許に関連した設問が出題されました。
この記事では、その設問に関連する内容や、設問から思いついた判決や事例などを、過去のブログ記事から、わかりやすく紹介します。

わかりにくかったり、間違い、ご意見・ご感想がありましたら、ぜひコメント欄へ!
[特許・実用新案]の問題Ⅱは・・・
口腔内崩壊錠に関する発明に係る特許権の特許権者であって、その実施品である錠剤について医薬品医療機器等法(薬機法)上の承認を取得して製造販売している製薬会社甲が、当該錠剤と実質的に同一である錠剤の承認を取得して製造販売を開始した被告製薬会社に対して存続期間が延長された当該特許権の権利行使をするというケースにおいて、被告製薬会社の各実施行為が侵害に当たるかどうか等を論じること
を問うものでした。
試験問題はこちらを参照(特許庁サイト):
設問1について
乙の行為1
製薬会社乙の行為1(錠剤を生産し、当該発明の技術的効果を確認・評価するための実験にのみ使用した行為)は、当該特許権に係る特許発明の技術的範囲に属する錠剤の実施行為に該当し、形式的には侵害を構成します。
しかし、その実施行為は、特許法第69条第1項の「試験又は研究」の範囲をその対象及び目的により区分して「技術の進歩」を目的とする行為に限定すべきとする染野説※で説示するところの、①特許性調査、②機能調査、③改良・発展を目的とする試験のうち、②機能調査のための試験のためにする実施に該当するといえます。
従って、特許法第69条第1項の「試験又は研究のためにする特許発明の実施」行為に該当し、特許権の効力は及ばないと解されます。
乙の行為1は侵害を構成しないことになります。
※染野説(染野啓子「試験・研究における特許発明の実施(I)」AIPPI, Vol.33, No.3(1988年)5頁)においては、「試験又は研究」の範囲をその対象及び目的により区分し、「技術の進歩」を目的とする行為に限定すべきとする。同説は、「試験又は研究」の範囲をその対象と目的から検討し、対象については特許発明それ自体に限定するとともに、目的についても、以下に示すように「技術の進歩」を目的とするものに(特許性調査、機能調査、改良・発展を目的とする試験)限定している(参照: https://www.jpo.go.jp/resources/shingikai/sangyo-kouzou/shousai/senryaku_wg/document/07-shiryou/paper05_v2.pdf)。
乙の行為2
乙の行為2(薬機法上の承認申請に必要な資料を得るために錠剤を生産し必要な試験を実施)については、平成11年4月16日最高裁第二小法廷判決平成10年(受)第153号(「膵臓疾患治療剤事件」又は「メシル酸カモスタット事件」)の判示が参考になります。
乙の行為2は、染野説でいうところの「技術の進歩」を目的とする行為に必ずしも該当するといえない場合がありそうです。特に、乙の錠剤が後発医薬品であった場合がそうかもしれません。
しかし、もし、乙の行為2を特許法第69条第1項にいう「試験」に当たらないと解して、特許権存続期間中は当該行為を行えないものとすると、特許権の存続期間が終了した後も、なお相当の期間、乙が当該発明を自由に利用することができず(=特許権が満了してから申請に必要な錠剤を生産して必要な試験をして承認申請をして承認を取得するという相当の期間を経ないと乙は錠剤を販売することができないことになり)、特許権の存続期間を相当期間延長するのと同様の結果となってしまいます。
このような結果は特許権者に付与すべき利益として特許法が想定するところを超えるものであり、特許権の存続期間が終了した後は、何人でも自由にその発明を利用することができ、それによって社会一般が広く益されるようにする特許制度の根幹に反するものとなります。
従って、乙の行為2は特許法第69条第1項にいう「試験」に該当すると解すべきであり、特許権の効力は及ばない、すなわち、侵害を構成しないことになります。
このケースにおける乙の錠剤が、先発医薬品であるのか後発医薬品であるのか定かではありませんが、後発医薬品の承認申請に必要な試験について争われた前述の最高裁判決の他に、先発医薬品の承認申請に必要な試験についても同最高裁判決の趣旨は妥当するので同試験は特許法第69条第1項の「試験又は研究のためにする特許発明の実施」に当たると判示した最近の知財高裁判決があります。
乙の錠剤が、先発医薬品又は後発医薬品のいずれであっても、やはり、乙の行為2は特許法第69条第1項にいう「試験」に該当すると解すべきといえます。
参考記事:

乙の行為3
乙の行為3(特許権満了後すぐに販売するために錠剤を生産)も、前述の平成11年4月16日最高裁第二小法廷判決平成10年(受)第153号の判示が参考になります。
乙が、特許権存続期間中に、薬事法に基づく製造承認申請のための試験に必要な範囲を超えて、同期間終了後に販売するために当該錠剤を生産することは、特許権を侵害するものとして許されないと解されます。
従って、乙の行為3は特許法第69条第1項にいう「試験」に該当しないと解すべきであり、侵害を構成することになります。
設問2について
設問(1)
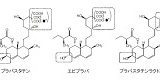
物の発明についての特許に係る特許請求の範囲にその物の製造方法の記載がある場合の表現形式を、いわゆる「プロダクト・バイ・プロセス・クレーム」といいます。
設問(1)については、当該特許権に係る特許請求の範囲に記載された唯一の請求項1が、プロダクト・バイ・プロセス・クレームであることに気付くことができれば、この設問の題意を把握できたのではないでしょうか。
プロダクト・バイ・プロセス・クレームの特許権の効力は、当該物と構造、特性等が同一である物であれば、その製造方法にかかわらず及ぶと解されることから、異なる方法で製造された同一化合物α(有効成分)を含有する被告(丁)の錠剤であっても、当該特許発明の技術的範囲に属することになります。
甲は、プロダクト・バイ・プロセス・クレームの特許権の効力が、丁の錠剤の製造販売行為に及び、侵害を構成することを主張することになります。
プロダクト・バイ・プロセス・クレームの特許権の効力が及ぶ範囲については、平成27年6月5日最高裁第二小法廷判決平成24年(受)第1204号(「プラバスタチンナトリウム事件」)が参考になります。
参考記事:
甲はどのような主張をすることが考えられるかという設問(1)のその先には、丁はどのような対応手段を取ることができるかということに考えが及ぶかもしれません。その一つに、特許法第104条の3第1項に係る抗弁がありますが、その抗弁を検討する際には、その前提となる当該プロダクト・バイ・プロセス・クレームに係る発明の要旨はどのように判断されるべきなのかということを踏まえておく必要があります。
前述の最高裁判決言渡日と同日に、プロダクト・バイ・プロセス・クレームの発明の要旨の認定についても、物同一説の立場を取るとの最高裁判決(平成27年6月5日最高裁第二小法廷判決平成24年(受)第2658号)が言い渡されています。
参考記事:

丁は、甲がなぜ当該特許請求の範囲をプロダクト・バイ・プロセス・クレームにしたのか(せざるを得なかったのか?)や、「化合物αを有効成分として含有する口腔内崩壊錠」の新規性や進歩性を否定できる先行技術文献を探すことも検討することになるでしょう。
また、設問では、「口腔内崩壊・・・錠剤を舌の上にのせると唾液又は少量の水分により錠剤がすばやく崩壊すること」との説明があるように、請求項1に記載された「口腔内崩壊型の錠剤」との表現は、錠剤を構成で特定するものではなく機能的に特定しているものと捉えることができるかもしれません。出願当時の技術常識や特許明細書等の記載に基づいて、実施可能要件やサポート要件等を満たしているかどうかの検討も実場面では必要そうです。
設問(2)
設問(2)は、共有に係る特許権に基づく差止請求に関して、特許権の各共有者は、各持分権を根拠に保存行為として単独で差止請求をすることが可能であること、さらにその趣旨を問うものでした。
ところで、特許権者による差止請求の可否という観点に関連して、特許権の共有者が存在する場合ではなく、専用実施権が設定されている場合には、特許権者は単独で差止請求をすることは可能なのでしょうか。
その可否については、特許法第100条第1項の文言上、特許権者が差止請求権の行使を制限される理由はなく、実質的にみても特許権者には侵害を除去すべき現実的な利益があるなら特許権者にも差止請求権の行使を認める必要があると解されるから、特許権者は、専用実施権を設定したときであっても、差止請求権を失わないものと解すべきであると判示した最高裁判決(平成17年6月17日最高裁判決平成16年(受)第997号)があります。
参考記事:
設問(3)
設問(3)は、共有に係る特許権に基づく通常実施権の許諾に関して、特許権の各共有者は、他の共有者の同意を得なければ、その特許権について専用実施権を設定したり通常実施権を許諾したりすることはできないこと(特許法第73条第3項)、さらにその趣旨を問うものでした。
本題から逸れますが、設問(3)の通常実施権の許諾という場面に関連して、第三者が通常実施権の許諾を求めた場合、仮に特許権の共有者の一人が応じることができると考えていたとしても、他の全ての共有者の同意が得られなければ、当該許諾に至ることが実際には難しい、ということを強く感じた事例として、第三者がやむを得ず公共の利益のための通常実施権設定の裁定の請求(特許法第93条)に至ったケースがあります(裁定請求日令和3年7月13日 裁定請求番号2021-1; 「網膜色素上皮細胞の製造方法」事件)。
参考記事:


この裁定の請求は、現在も工業所有権審議会発明実施部会で審議中のようです。裁定に至る初のケースとなるかもしれず、その判断がどうなるのか非常に注目されています。
また、本題からはどんどん逸れますが、他の共有者の同意を得て第三者に通常実施権を許諾しても、共有者間でしっかりと契約をしておかないと、後になって、「そんなはずではなかった・・・」と、共有者間での認識の相違が大きな問題に発展することがあります。
その典型例が、抗PD-1抗体等に関する用途特許に係る特許権の共有者である小野薬品工業株式会社と本庶佑氏との間で起きた対第三者訴訟関連分配金を巡る事件です。
共有に係る特許権について、第三者に実施権を許諾した場合についても何が起きるのかをよく検討したうえで共有者間で取り決め、しっかりと契約をしておく必要があります。
参考記事:



設問3について
存続期間が延長された当該特許権の侵害訴訟において、甲の錠剤と戊の錠剤は実質同一なものに含まれるとして戊は敗訴し、判決確定を受けて戊は甲に損害賠償金を支払ったところ、第三者が、当該特許権に係る延長登録無効審判を請求し、無効審決を勝ち取ったという状況が設問の設定。

製薬会社戊(その訴訟代理人)にとって、苦~い状況・・・。
「なぜ、他社ができて、うち(戊)はできなかったんだ!」と、戊の社長がお怒りになるのは必至。
もし、ピポが戊の知財担当だったら・・・(汗)
設問では、第三者による延長登録無効審判請求により延長登録無効審決が確定(特許法第125条の3第3項により遡及消滅しますね)したことを理由に、戊は、侵害訴訟判決の確定を受けて甲に支払った損害賠償金を取り戻せるか否かが問われました。

戊の社長は、知財部に対して「支払った賠償金を取り戻して来い!」と怒り心頭で仰せになるでしょうね・・・。それに対して事前の見解を用意しておかないと、さらに怒られそう・・・(汗)
戊は、民訴法第338条第1項第8号の再審事由に該当することを理由に、確定した侵害訴訟判決に対し、再審の訴えをもって、不服を申し立てることができます(民訴法第338条第1項柱書)が、当該判決の確定を受けて損害賠償金を支払った後に延長登録無効審決が確定したときは、当該再審の訴えにおいて、当該審決が確定したことを主張することはできません(特許法第104条の4第2号)。
後の特許無効審判や訂正審判の結果によっては、再審の訴えにより確定判決の既判力が排除され、損害賠償金の返還となる事態が発生する(紛争が蒸し返される)ことは妥当とはいえず、特許権侵害訴訟等の紛争解決機能、企業経営の安定性等の観点から問題があったため、平成23年の一部改正により特許法第104条の4が新設されました(特許庁 平成23年法律改正(平成23年法律第63号)解説書 第4章 再審の訴え等における主張の制限)。
戊は、甲に対して既に支払った損害賠償金を取り戻すことはできません。

まあ、約1年半、販売の差止めはなかったし、支払った賠償金も大した額ではなかったし、2026年からの製造販売は特許権も満了して問題ないわけでイケイケなんだから、ビジネス的にはイイっすよね・・・(汗)

ピポ先輩! その言い訳では知財担当として自覚が足りないと言われちゃいそうですよ~。
ところで、特許権の満了日(2024年2月1日)が2025年12月31日まで延長されたということなので、与えられた延長期間は1年10月30日ですね。甲の錠剤の薬機法上の承認は、特許権の設定登録日(2011年9月1日)から1年10月30日の後、すなわち、早くとも2013年7月31日以降だったことがわかります。このことから、プロダクト・バイ・プロセス・クレームの最高裁判決が出された2015年6月より前に当該延長が認められた可能性は大いにあり得ますよね。だとすると、プロダクト・バイ・プロセス・クレームの延長登録出願の審査で特許庁は化合物αの製法の一致まで求めたのか、製法に関係なく物同一で許可したのか、どちらだったのでしょうか~ピポ先輩!
それから、特許権の存続期間の延長登録出願の登録要件について判示した最高裁判決(アバスチン事件)が2015年11月に出されていますよ。「アバスチン事件」判決の前後で、当該プロダクト・バイ・プロセス・クレーム、また、他の製法特許一般の延長登録可否を、審査官はどのように解釈して判断していたのでしょうか~ピポ先輩!
それから、設定の製薬会社甲の錠剤は実は後発医薬品という場合はあるのでしょうか。後発医薬品でも特許権の存続期間延長登録となったケースはあるのでしょうか~ピポ先輩!

・・・
参考記事:

設問では、存続期間が延長された当該特許権の侵害訴訟において、甲の錠剤と戊の錠剤は実質同一なものに含まれるとして損害賠償が認められたという設定でした。
延長された特許権の効力の範囲を判断する際に、この「実質同一なもの」にも及ぶと判示した平成29年1月20日知財高裁大合議判決平成28年(ネ)10046(「オキサリプラチン事件」)はとても有名です。
参考記事:
- 2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046(延長された特許権の効力(知財高裁大合議判決))
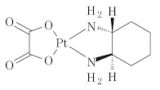

この「オキサリプラチン事件」において、知財高裁大合議は、延長された特許権の効力は、政令処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」(医薬品)のみならず、これと医薬品として実質同一なものにも及び、政令処分で定められた上記構成中に対象製品と異なる部分が存する場合であっても、当該部分が僅かな差異又は全体的にみて形式的な差異にすぎないときは、対象製品は、医薬品として政令処分の対象となった物と実質同一なものに含まれ、存続期間が延長された特許権の効力の及ぶ範囲に属すると判示しました。
また、「実質同一なもの」の範囲は、特許発明の内容に基づき、その内容との関連で技術的特徴及び作用効果の同一性を比較検討して、当業者の技術常識を踏まえて判断すべきであると説示し、「実質同一なもの」に含まれる類型についても示しました。

後発医薬品とは、「その先発医薬品と同一の有効成分を同一量含み、同一投与経路の製剤であり、効能・効果、用法・用量も原則的に同一である医薬品で、生物学的同等性試験等にてその先発医薬品と治療学的に同等であることが検証されているもの」です((独)医薬品医療機器総合機構より)。
先発医薬品と後発医薬品とは、治療学的に「同一・同等である」はずです。しかし、特許法上の延長された特許権の効力という観点では、両者は「実質同一なもの」であったり、なかったり・・・。
また、設問では、口腔内崩壊錠の承認に基づいて存続期間が延長された当該特許権の侵害訴訟において、甲の錠剤と戊の錠剤は実質同一なものに含まれると裁判所は判断したという設定でしたが、延長された特許権の効力が及ぶ範囲について判定(特許法第71条)を求めた事例があります。
特許庁は、「特許法第68条の2の規定による特許権の効力が及ぶ範囲について、特許庁に判定を求めることができる旨の規定は特許法に存在しないから、特許法第68条の2の規定による本件特許権の効力が及ぶ範囲について、請求人は、特許庁に対して判定を求めることはできない。」として、延長された特許権の効力が及ぶ範囲について判断をしませんでした。
参考記事:

おわりに
令和5年度の弁理士試験論文式筆記試験(必須科目)[特許・実用新案]の問題Ⅱは、非常に魅力的な医薬系特許に関する設問でした。
設問には、「なお、医薬品医療機器等法固有の問題を考慮する必要はない」と強調されているものの、医薬品医療機器等法固有の問題とは何なのかについての言及はなく、また、わかりやすい「物質特許」や「用途特許」ではなく、(敢えて?)口腔内崩壊錠の発明に係る特許(製剤特許)が採用されています。
これらのことから、パテントリンケージ※の問題を考慮する必要はないと受験者に暗に伝えているのかなと思いました。
試験問題にそのような問題があることを明示して、それについて波風を立てるわけにもいきませんからね。勘繰りすぎでしょうか。
※パテントリンケージ(patent linkage)とは、後発医薬品承認時に先発医薬品の有効特許を考慮する仕組みであり、その制度内容は国によって異なるが、その意義は総じて、先発医薬品を保護する特許権の重要性を尊重しつつ先発医薬品メーカーと後発医薬品メーカーとの特許紛争を事前に整理することによって後発医薬品の市場への安定供給を実現することを目的としている。
参考記事:

さて、この記事では、弁理士論文試験の設問に関連する判決や事件を紹介する際に、設問の内容から少し脇道に逸れたり、自由な発想で過去の記事を取り上げたりしました。
その結果、興味深い医薬系特許に関連する事件や判決が数多く浮かび上がりました。
当ブログでは、15年以上前から、そのような判決や事件を紹介し続けています。
知財実務や弁理士試験の勉強において、当ブログが皆さんの参考になれば幸いです。

医薬系特許の世界は常に進化しています。ぜひ、当ブログを通じて、医薬系特許の魅力的な世界を探索してくださいね!


コメント