- 抗PCSK9モノクローナル抗体アリロクマブ(alirocumab)を有効成分とするサノフィの高コレステロール血症治療剤プラルエント®を特許権侵害訴訟で販売停止に追い込んだアムジェンの抗体特許に対して、今度はリジェネロンが同特許の無効を求めて再挑戦してきた無効請求不成立審決取消訴訟で、サノフィとの別件訴訟でアムジェン勝訴判決を下してきた知財高裁は、一転、リジェネロンが主張した取消事由(サポート要件違反の判断の誤り)は理由があるとして、本件審決を取り消す(アムジェン敗訴)判決を言い渡した。
- アムジェンの抗体特許の請求の範囲には「参照抗体と競合する」との発明特定事項があり、サポート要件を充足するか否かにおいて、この点が議論の中心となった。
-
米国最高裁での審理も注目される中、アムジェンとリジェネロン/サノフィとの間の抗PCSK9モノクローナル抗体を巡る特許紛争は新たな局面を迎えている。
1.はじめに
本記事では、アムジェンの特許第5705288号に対してリジェネロンがした無効審判請求を不成立とした特許庁審決の取消訴訟において、リジェネロンが主張した取消事由(サポート要件違反の判断の誤り)は理由があるから本件審決は取り消されるべきであると言い渡した知的財産高等裁判所判決(知財高裁令和3年(行ケ)10093)を紹介する。
また、争点となったサポート要件の充足性を中心に、訂正の可能性や本件発明である「モノクローナル抗体」に係る3つの発明特定事項の意義付けはそれぞれ異なることについて雑感を述べる。
2.背景
(1)リジェネロンによる本件審決取消請求事件の経緯
本件(知財高裁令和3年(行ケ)10093)は、発明の名称を「プロタンパク質コンベルターゼスブチリシンケクシン9型(PCSK9)に対する抗原結合タンパク質」とするアムジェンの特許第5705288号(以下「本件特許」という)の請求項1及び9に係る部分について、リジェネロンがした特許無効審判の請求(無効2020-800011号事件、請求日:2020年2月12日)を不成立とした審決の取消訴訟である。
特許庁が、リジェネロンが主張するサポート要件違反(無効理由1)、実施可能要件違反(無効理由2)、進歩性欠如(無効理由3)、明確性要件違反(無効理由4)及び発明該当性要件違反(無効理由5)のいずれによっても本件特許の請求項1及び9に係る部分について無効とすることはできないとの審決をしたため、リジェネロンは、当該審決の取消しを求めて本件訴訟を提起した。
リジェネロン(Regeneron Pharmaceuticals, Inc.)は、米国のバイオテクノロジー企業である。
高コレステロール血症治療剤プラルエント(Praluent)®の有効成分である抗PCSK9モノクローナル抗体アリロクマブ(alirocumab)を創製し、サノフィと共同で開発したのがリジェネロンである。
リジェネロン及びサノフィは、2020年5月、サノフィ社が直接保有するリジェネロン株をリジェネロンが約50億ドルで買い戻すことに合意したと発表した(サノフィはリジェネロン株を約2320万株(20.6%)保有していたがリジェネロンによる買い戻し後も約40万株を保有)・・・という関係がある。
- Sanofi press release: 2020.05.25 Sanofi intends to sell its equity investment in Regeneron; confirms no change to ongoing collaboration
- Regeneron press release: 2020.05.25 REGENERON ANNOUNCES SECONDARY OFFERING OF ITS COMMON STOCK HELD BY SANOFI AND $5 BILLION STOCK REPURCHASE
(2)サノフィによる別件審決取消請求事件等からの経緯
本件特許については、以下のとおり、過去にサノフィにより無効審判が請求されたが、アムジェンが勝訴したという経緯がある。
- サノフィは、2017年12月8日、本件特許の請求項1及び9に係る部分について無効請求不成立審決の取消しを求める訴訟(以下「別件審決取消訴訟」という)を提起した(平成29年(行ケ)10225号)が、知財高裁は、2018年12月27日、サノフィが主張する取消事由(進歩性の判断の誤り、サポート要件の判断の誤り、実施可能要件の判断の誤り)の存在をいずれも否定し、サノフィの請求を棄却した(2018.12.27 「サノフィ v. アムジェン」 知財高裁平成29年(行ケ)10225)。

- 同特許に係る特許権侵害差止請求事件においても、知財高裁は、サノフィ(被告)のモノクローナル抗体及び製品(プラルエント® 皮下注 75mg ペン/150mg ペン(有効成分:アリロクマブ)は、本件発明の技術的範囲に属し、また、本件特許は特許無効審判により無効にされるべきものとは認められないものと判断し、サノフィの控訴を棄却した(2019.10.30 「サノフィ v. アムジェン」 知財高裁平成31年(ネ)10014)。

- サノフィは、上記各判決を不服として上告受理申立てをしたが、最高裁判所は、2020年4月24日、上告不受理決定をし、同判決は確定したことを受けて、2020年5月7日、高コレステロール血症治療剤プラルエント®の日本での販売を停止すると発表した(サノフィがプラルエント®の販売停止発表 アムジェンとの特許侵害訴訟で最高裁上告棄却決定受け)。製薬業界においては、たった一つの特許権が事業にとてつもなく甚大な影響を与えること、そして特許制度における差止請求権のおそろしさを改めて知らしめた事件となった。

- アムジェン press release: 2020.05.08 PCSK9特許侵害訴訟の最高裁決定について
ところで、アムジェンの本件特許第5705288号は特願2010-522084(原出願)の分割出願であり、この原出願特許(第5441905号)に係る特許権は、アムジェンで開発された抗PCSK9モノクローム抗体製剤レパーサ(Repatha)®皮下注(有効成分:エボロクマブ(evolocumab))を保護するものである。
日本では、2016年1月22日にレパーサ®皮下注140mgシリンジ及びレパーサ®皮下注140mgペンが承認され、2017年8月23日にレパーサ®皮下注420mgオートミニドーザーが承認された。
上記のとおり、抗PCSK9モノクローム抗体製剤(高コレステロール血症治療剤)の競合関係という観点から本事件の背景をいうならば、高コレステロール血症治療剤プラルエント®の有効成分である抗PCSK9モノクローナル抗体アリロクマブを創製し、プラルエント®をサノフィと共同で開発してきたリジェネロンが、サノフィがアムジェンとの特許権侵害訴訟に敗訴してプラルエント®の日本での販売停止に追い込まれたことへのリベンジを果たすべく、アムジェンの特許第5705288号の無効を求めて再挑戦してきた・・・というのがサノフィによる別件審決取消請求事件等からの本件の背景である。
(3)本件発明
本件発明(特許請求の範囲の請求項1及び9の記載)は以下のとおりである。
【請求項9】 請求項1に記載の単離されたモノクローナル抗体を含む、医薬組成物。
※下線部「配列番号49のアミノ酸配列からなる重鎖可変領域を含む重鎖と、配列番号23のアミノ酸配列からなる軽鎖可変領域を含む軽鎖とを含む抗体」を「21B12抗体」といい、「参照抗体」ともいう。)。
本件発明の請求項1は、
- ① PCSK9とLDLRタンパク質の結合を中和することができ、
- ② PCSK9との結合に関して、21B12抗体(参照抗体)と競合する、
- ③ 単離されたモノクローナル抗体
との発明特定事項を有するものであり、①と②の発明特定事項は、③のモノクローナル抗体の性質を決定するものと解される。
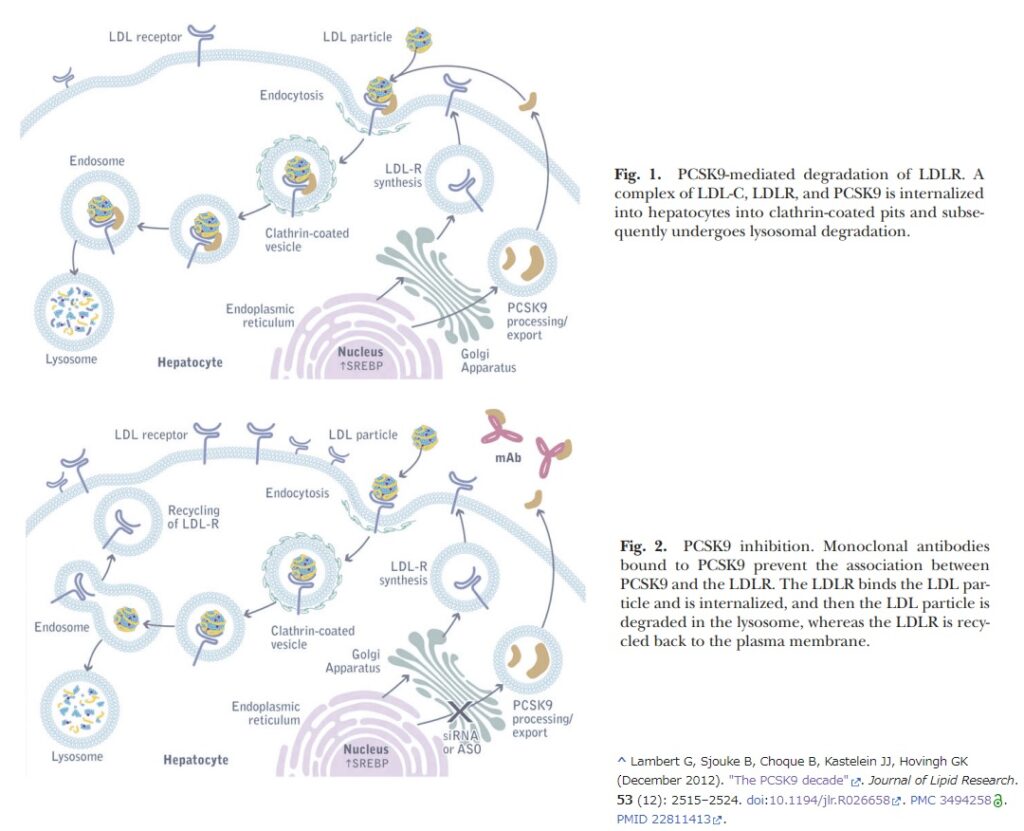
PCSK9(プロタンパク質コンベルターゼスブチリシンケクシン9型)は、低密度リポタンパク質受容体(LDLR)タンパク質のレベルの制御に関与するセリンプロテアーゼであり、LDLRタンパク質と直接相互作用し、LDLRとともに肝臓の細胞内に取り込まれ、LDLRタンパク質のレベルを減少させ、さらには細胞表面(細胞外)でLDLへの結合に利用可能なLDLRタンパク質の量を減少させることにより、血清LDLコレステロールを増加させる(Lambert G et al. “The PCSK9 decade”. Journal of Lipid Research. 53 (12): 2515–2524. doi:10.1194/jlr.R026658より下図 Fig.1)。
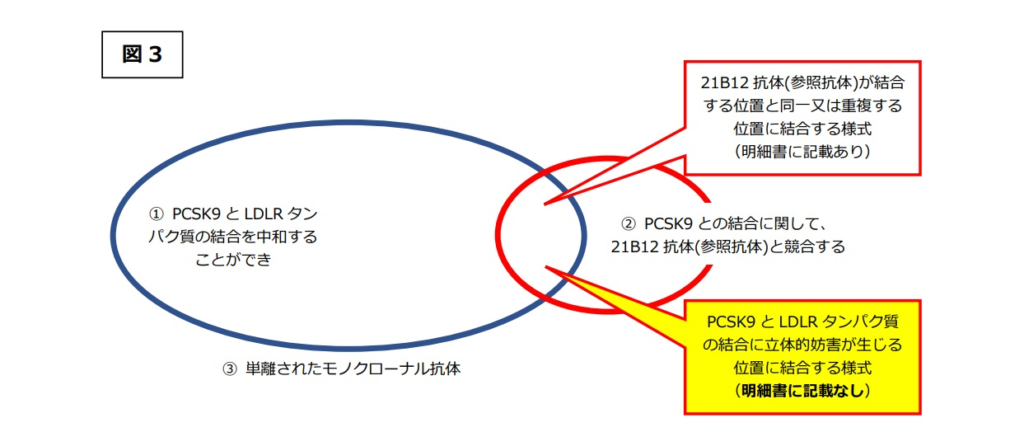
つまり、PCSK9とLDLRタンパク質の結合を中和することができれば、細胞表面(細胞外)でLDLへの結合に利用可能なLDLRタンパク質の量を増加させ、血清LDLコレステロールの低下をもたらすことができる(下図 Fig.2)。
本件発明は、血清LDLコレステロール濃度を低下させるという課題を解決するために、①PCSK9とLDLRタンパク質の結合を中和することができるという特性と、②PCSK9との結合に関して「21B12抗体」と競合するという特性を有する③単離されたモノクローナル抗体を具体的手段として提示するものである(被告アムジェンの主張より)。
3.裁判所の判断
裁判所(知財高裁 第4部)は、原告リジェネロン主張の取消事由2(サポート要件違反の判断の誤り)は理由がある(本件発明1及び9は、いずれもサポート要件に適合するものと認められない)から、その余の取消事由について判断するまでもなく、本件審決は取り消されるべきであるとの判決を言い渡した。
裁判所の判断を以下の項目で整理し、抜粋する。
- 本事件でリジェネロンが取消事由2を主張することは特許法167条には反しない
- 本件発明の技術的意義は、21B12抗体(参照抗体)と競合する抗体であれば結合中和抗体としての機能的特性を有することを特定した点にあるというべきである、と認定
- 「参照抗体と競合する抗体であれば結合中和抗体である」との理解に至ることは困難
(1)取消事由2を主張することは特許法167条に反するか否か
被告アムジェンは、
「原告とサノフィが実質的に利害関係を共通していることを前提として、本件特許がサポート要件違反等を理由とした別件無効審判に係る別件審決が確定していること等をもって、原告が取消事由2を主張することは特許法167条に反する」
と主張した。しかし、裁判所は、
「特許法167条は、「特許無効審判・・・の審決が確定したときは、当事者及び参加人は、同一の事実及び同一の証拠に基づいてその審判を請求することができない。」と定めるところ、原告とサノフィ又はサノフィ株式会社が本件特許に関する係争に係る製剤等を共同で製品化する関係にあるからといって、原告は、サノフィと別法人であって、サノフィと親会社と子会社の関係であるとか、日本法人と外国法人の関係にあるといった、実質的にみれば同一当事者であると評価すべき特段の事情があると認められないから(もとより原告は別件無効審判の参加人でもない。)、そもそも同条の適用はないというべきである。」
と判断し、被告アムジェンの主張を認めなかった。
参考:
- 「別件無効審判に係る別件審決」とは、特許庁が無効2016-800004号事件について2017年8月2日にした審決のことである(参考: 2018.12.27 「サノフィ v. アムジェン」 知財高裁平成29年(行ケ)10225)。
- 特許法: (審決の効力)第百六十七条 特許無効審判又は延長登録無効審判の審決が確定したときは、当事者及び参加人は、同一の事実及び同一の証拠に基づいてその審判を請求することができない。
- 平成23年法律改正(平成23年法律第63号)解説書: 第6章 無効審判の確定審決の第三者効の廃止
(2)本件発明の技術的意義
裁判所は、そもそも本件発明の課題は、LDLRタンパク質と結合することにより、対象中のLDLRタンパク質の量を減少させ、LDLの量を増加させるPCSK9とLDLRタンパク質との結合を中和する抗体又はこれを含む医薬組成物を提供することであり、このような課題の解決との関係では、参照抗体と競合すること自体に独自の意味を見出すことはできないから、このような観点からも、下記のとおり、本件発明の技術的意義は、21B12抗体(参照抗体)と競合する抗体であれば、21B12抗体(参照抗体)と同様のメカニズムにより、結合中和抗体としての機能的特性を有することを特定した点にあるというべきである、と認定した。
「サポート要件に適合するか否かは、特許請求の範囲の記載と発明の詳細な説明の記載とを対比し、特許請求の範囲に記載された発明が、発明の詳細な説明に記載された発明で、発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か、また、その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきものであると解するのが相当であるところ、
・・・(略)・・・
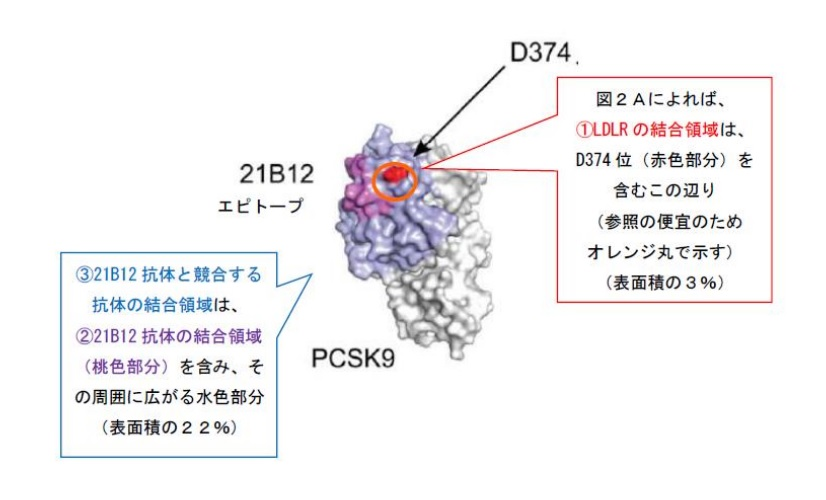
本件発明における「PCSK9との結合に関して、21B12抗体と競合する」との発明特定事項も、21B12抗体と競合する抗体であれば、21B12抗体と同様のメカニズムにより、LDLRタンパク質の結合部位を直接封鎖して(具体的には、結晶構造上、抗体がLDLRのEGFaドメインの位置と重複する位置でPCSK9に結合して)、PCSK9とLDLRタンパク質の間の相互作用を妨害し、遮断し、低下させ、又は調節することを明らかにする点に技術的意義があるものというべきであり、逆に言えば、参照抗体と競合する抗体は、このような位置で結合するからこそ、中和が可能になるということもできる。
・・・(略)・・・
甲1文献の開示事項によれば、家族性高コレステロール血症は、血漿中のLDLコレステロールレベルの上昇に起因するものであるところ、PCSK9は、細胞表面に存在するLDLRタンパク質の存在量を低下させるものであるため、PCSK9が治療のための魅力的な標的であり、血漿中のPCSK9に結合し、そのLDLRタンパク質との結合を阻害する抗体等が効果的な阻害剤となり得ることが既に示されていたものと認められるのであるから、このような観点から見ても、本件発明の技術的意義は、21B12抗体と競合する抗体であれば、21B12抗体と同様のメカニズムにより、上記のようなLDLRタンパク質との結合を阻害する抗体、すなわち結合中和抗体としての機能的特性を有することを特定した点にあるということもできる。」
(3)「参照抗体と競合する抗体であれば結合中和抗体である」との理解に至ることは困難
裁判所は、以下のとおり、本件明細書の発明の詳細な説明には、「PCSK9との結合に関して、21B12抗体(参照抗体)と競合する抗体」であれば、「PCSK9とLDLRタンパク質の結合を中和することができ」る抗体としての機能的特性を有することについて何らの開示がないというほかなく、本件発明はサポート要件を満たさない、と判断した。
「本件発明の「PCSK9との結合に関して、参照抗体と競合する」との性質を有する抗体には、上記本件明細書の発明の詳細な説明に具体的に記載される数グループの抗体以外に非常に多種、多様な抗体が包含されることは自明であり、・・・その中には、例えば、21B12抗体がPCSK9と結合する部位と異なり、かつ、結晶構造上、抗体がLDLRのEGFaドメインの位置とも異なる部位に結合し、21B12抗体に軽微な立体的障害をもたらして、21B12抗体のPCSK9への特異的結合を妨げ、又は阻害する(例えば、低下させる)もの等も含まれ得るところ、このような抗体がPCSK9に結合する部位は、結晶構造上、抗体がLDLRのEGFaドメインの位置と重複する位置ではないのであるから、LDLRタンパク質の結合部位を直接封鎖して、PCSK9とLDLRタンパク質の間の相互作用を妨害し、遮断し、低下させ、又は調節するものとはいえない。」
「「PCSK9との結合に関して21B12抗体と競合する」とは、21B12抗体と同じ位置でPCSK9と結合することを特定するものではないから、21B12抗体と競合する抗体であれば、21B12抗体と同じエピトープと競合し、又は結合する抗原結合タンパク質(抗体)であるとはいえず、このような抗体全般が21B12抗体と類似の機能的特性を示すことを裏付けるメカニズムにつき特段の説明が見当たらない以上、本件発明の「PCSK9との結合に関して、21B12抗体と競合する抗体」が21B12抗体と「類似の機能的特性を示す」ということはできない。
前述のとおり、本件発明の技術的意義は、21B12抗体と競合する抗体であれば、21B12抗体と同様のメカニズムにより、PCSK9とLDLRタンパク質との結合を中和する抗体としての特性を有することを特定する点にあるというべきところ、前記のとおり、21B12抗体と競合する抗体であれば、LDLRのEGFaドメインと相互作用する部位・・・に結合してPCSK9とLDLRタンパク質の結合部位を直接封鎖するとはいえず、他には、21B12抗体と競合する抗体であれば、どのようなものであっても、PCSK9とLDLRのEGFaドメイン(及び/又はLDLR一般)との間の相互作用(結合)を阻害する抗体となるメカニズムについての開示がない以上、当業者において、21B12抗体と競合する抗体が結合中和抗体であるとの理解に至ることは困難というほかない。」
(4)被告アムジェンの主張について
被告アムジェンは、
「21B12抗体(参照抗体)と競合するが、PCSK9とLDL5 Rタンパク質との結合を中和できない抗体が仮に存在したとしても、そのような抗体は、本件発明1の技術的範囲から文言上除外されているし、そのような抗体は、本件明細書の記載に基づいて、PCSK9とLDLRとの相互作用を確認することにより技術的にも困難なく取り除くことができることから、本件発明がサポート要件に反する理由とはならない。
・・・(略)・・・
本件発明1は、PCSK9とLDLRとの結合を中和することができるという要件と21B12抗体と競合するという要件の2つを満たすものとして規定されており、当然のことながら、PCSK9とLDLRとの結合を中和することができるというのは、技術的に有意にPCSK9とLDLRとの結合を中和することができることを意味するものである。そうとすれば、本件発明は、当業者が、本件明細書と本件出願日当時の技術常識に基づいて、発明の効果を有意に奏すると理解することができるものであるから、原告の主張は失当である。」
と主張した。
しかし、裁判所は、
「既に説示したとおり、21B12抗体と競合する抗体であれば、21B12抗体と同様のメカニズムにより、PCSK9とLDLRタンパク質との結合中和抗体としての機能的特性を有することを特定した点に本件発明の技術的意義があるというべきであって、21B12抗体と競合する抗体に結合中和性がないものが含まれるとすると、その技術的意義の前提が崩れることは明らかである(本件のような事例において、結合中和性のないものを文言上除けば足りると解すれば、抗体がPCSK9と結合する位置について、例えば、PCSK9の大部分などといった極めて広範な指定を行うことも許されることになり、特許請求の範囲を正当な根拠なく広範なものとすることを認めることになるから、相当でない。)。なお、被告が主張するように、本件発明1の特許請求の範囲は、PCSK9との結合に関して、参照抗体と競合する抗体のうち、「PCSK9とLDLRタンパク質の結合を中和することができ」る抗体のみを対象としたものであると解したとしても、前示のとおり、本件発明のPCSK9との競合に関して、参照抗体と競合するとの発明特定事項は、被告が主張するような、参照抗体が結合する位置と同一又は重複する位置に結合する抗体にとどまるものではなく、PCSK9とLDLRタンパク質の結合に立体的妨害が生じる位置に結合する様式で競合する抗体をも含むものであるから、このような抗体についても結合中和抗体であることがサポートされる必要があるところ、参照抗体が結合する位置と同一又は重複する位置に結合する抗体の場合とは異なり、PCSK9とLDLRタンパク質との結合に立体的妨害が生じる位置に結合する様式で競合する抗体が結合を中和するメカニズムについては本件明細書には何らの記載はなく・・・そうすると、本件明細書の発明の詳細な説明には、参照抗体と競合する抗体のうちPCSK9とLDLRタンパク質との結合に立体的妨害が生じる位置に結合する様式で競合する抗体が結合中和活性を有することについて何らの開示がないというほかなく、この点からも、本件発明はサポート要件を満たさない。」
と判断した。
また、裁判所は、
「本件明細書に記載された抗体の作製過程を経たとしても、免疫化されたマウスの中でPCSK9上のどのような位置に結合する抗体が得られるかは「運に支配される」ものであって、抗体の抗原タンパク質への結合を立体的に妨害する態様で抗原タンパク質に結合する抗体を製造する方法が本件出願時における技術常識であったともいえないことからすると、本件明細書に記載された抗体の作製方法に関する記載をもって、本件発明に含まれる多様な抗体が本件明細書の発明の詳細な説明に記載されていたとはいえない。」
と判断した。
(5)付言
裁判所は、
本件発明を巡る国際的状況について、
「もとより、他国における判断が本件判断に直ちに影響を与えるものではないことは明らかである」
と付言し、
また、本件発明に係る別件審決取消訴訟においては、サノフィによるサポート要件違反に関する主張は退けられていることについて、
「これは、当時の主張や立証の状況に鑑み、21B12抗体と競合する抗体は、21B12抗体とほぼ同一のPCSK9上の位置に結合し21B12抗体と同様の機能を有するものであることを当然の前提としたことによるものと理解することも可能である。これに対し、本訴においては、【A】博士や【B】博士の各供述書、【F】教授の鑑定書等による構造解析、「EGFaミミック抗体」に係る関係書証等の新証拠に基づく新主張により、上記前提に疑義が生じたにもかかわらず、この前提を支える判断材料が見当たらないのであるから、別件判決の結論と本件判断が異なることには相応の理由があるというべきである。」
と付言した。
4.コメント
(1)発明特定事項の関係性とサポート要件の充足について
本件発明1に係る発明特定事項①②③の関係性とサポート要件の充足について、ベン図を用いて以下に整理する。
裁判所は・・・
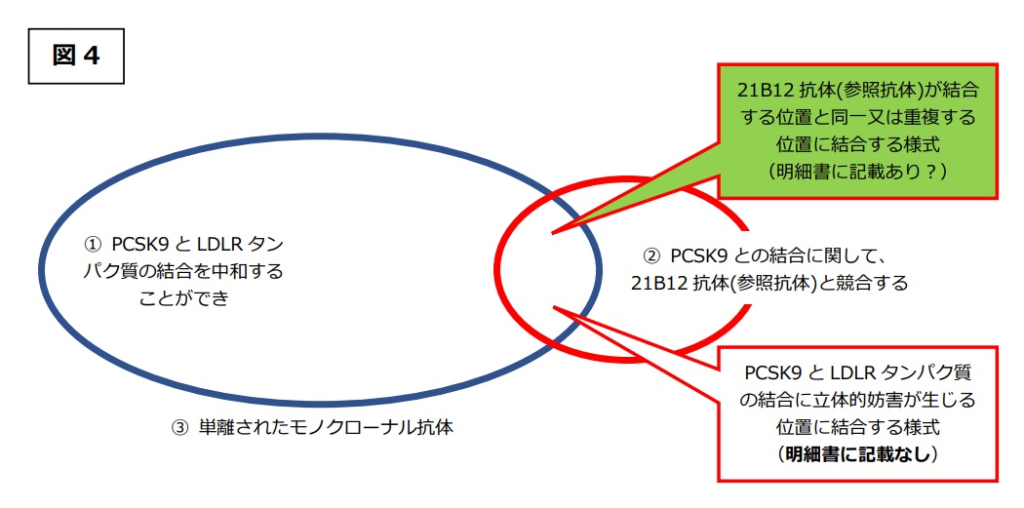
本件発明の技術的意義は、「②PCSK9との結合に関して、21B12抗体(参照抗体)と競合する」抗体であれば、21B12抗体と同様のメカニズムにより、「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体、すなわち結合中和抗体としての機能的特性を有することを特定した点にあるが(図1)、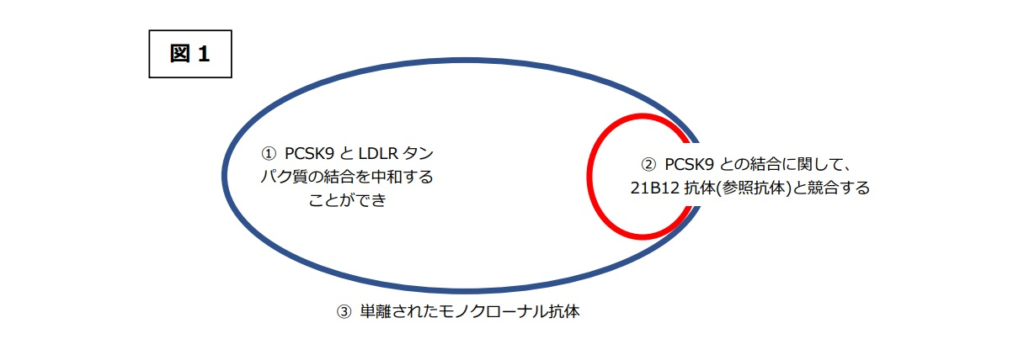 実際は、「②21B12抗体(参照抗体)と競合する」抗体には非常に多種多様な抗体が包含され、その中には、「①PCSK9とLDLRタンパク質の結合を中和することができ」ない抗体も含まれ得る(図2赤矢印部分)。
実際は、「②21B12抗体(参照抗体)と競合する」抗体には非常に多種多様な抗体が包含され、その中には、「①PCSK9とLDLRタンパク質の結合を中和することができ」ない抗体も含まれ得る(図2赤矢印部分)。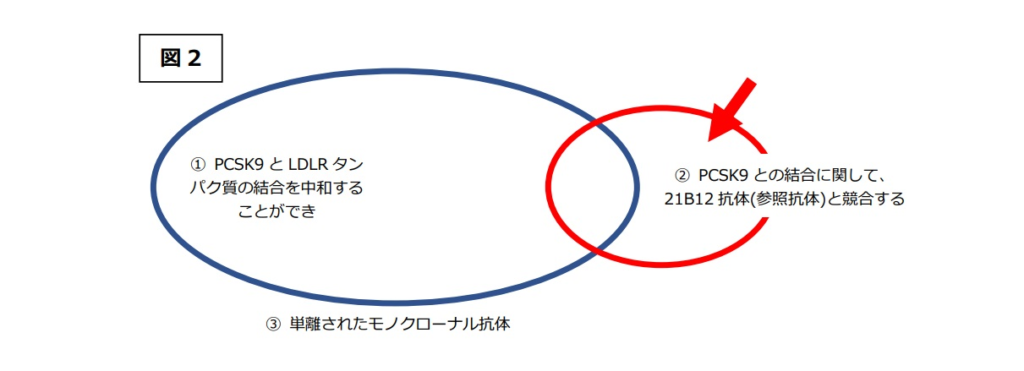 そうすると、本件発明の技術的意義の前提(図1のベン図で示される関係)が崩れることは明らかであり、「②21B12抗体(参照抗体)と競合する」抗体であれば、どのようなものであっても、「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体となるメカニズムについての開示がない以上、当業者において、「②21B12抗体(参照抗体)と競合する」抗体であれば「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体であるとの理解に至ることは困難というほかない。
そうすると、本件発明の技術的意義の前提(図1のベン図で示される関係)が崩れることは明らかであり、「②21B12抗体(参照抗体)と競合する」抗体であれば、どのようなものであっても、「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体となるメカニズムについての開示がない以上、当業者において、「②21B12抗体(参照抗体)と競合する」抗体であれば「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体であるとの理解に至ることは困難というほかない。
・・・と判断した。
被告アムジェンは・・・
「②21B12抗体(参照抗体)と競合する」が、結合を中和できない抗体が仮に存在したとしても、そのような抗体は、本件発明の技術的範囲から文言上除外されているし(図2ベン図①②の共通部分(①⋂②)であるし)、そのような抗体は、本件明細書の記載と出願日当時の技術常識に基づいて、PCSK9とLDLRタンパク質との相互作用を確認することにより技術的にも困難なく取り除くことができるし、発明の効果を有意に奏すると理解することができるものである。
・・・と主張した。
しかし、裁判所は・・・
「②21B12抗体(参照抗体)と競合する」抗体に結合中和活性がないものが含まれるとすると、その技術的意義の前提(図1のベン図で示される関係)が崩れることは明らかであるとしたうえで、被告アムジェンの主張するように、本件発明1の特許請求の範囲は、「②21B12抗体(参照抗体)と競合する」抗体のうち、「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体のみを対象としたものである(図2ベン図の重複部分である)と解したとしても、「②21B12抗体(参照抗体)と競合する」との発明特定事項は、『参照抗体が結合する位置と同一又は重複する位置に結合する様式』で競合する抗体にとどまるものではなく、『PCSK9とLDLRタンパク質の結合に立体的妨害が生じる位置に結合する様式』で競合する抗体(図3黄色吹き出し)をも含むものであるから(図3ベン図①②の共通部分(①⋂②))、このような抗体についても結合中和活性を有するメカニズムについては本件明細書には何らの記載はなく、この点からも、本件発明はサポート要件を満たさない。
・・・と判断した。
上記のとおり、「②21B12抗体(参照抗体)と競合する」抗体には結合中和活性がないもの(図2赤矢印)も含まれるから、本件明細書の記載から裁判所が認定した本件発明の技術的意義(「②抗体」であれば「①抗体」であること)(図1)を理解することは困難となったと裁判所は判断した。
しかし、特別の事情がない限り、発明の要旨は請求の範囲の記載どおりに解釈しなければならないとの原則に基づいて考えるのであれば、本件発明1の特許請求の範囲は、「②21B12抗体(参照抗体)と競合する」抗体のうち、「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体のみを対象としたものである(図2ベン図①②の共通部分(①⋂②)である)と解され、サポート要件もその範囲について充足すれば足るはずである。
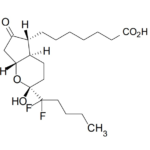
この点は、裁判所も触れており、そうであったとしても、『参照抗体が結合する位置と同一又は重複する位置に結合する様式』で競合する抗体にとどまらず、『PCSK9とLDLRタンパク質の結合に立体的妨害が生じる位置に結合する様式』で競合する抗体(図3黄色吹き出し)をも含むものであるからサポート要件を満たさないと判断している。
これは訂正の可能性を示唆する裁判所からの助け舟なのかどうかは不明であるが、「②PCSK9との結合に関して、21B12抗体(参照抗体)と競合する」との発明特定事項を「②PCSK9との結合に関して、21B12抗体(参照抗体)が結合する位置と同一又は重複する位置に結合する様式で21B12抗体(参照抗体)と競合する」や当該位置を特定のエピトープ配列とするような訂正(図4緑色吹き出し事項を付加する訂正)が認められれば、サポート要件違反は解消される可能性があるかもしれない。
そして、そのような訂正が認められれば、本件発明の技術的意義は、「②PCSK9との結合に関して、『21B12抗体(参照抗体)が結合する位置と同一又は重複する位置に結合する様式で』21B12抗体(参照抗体)と競合する」抗体であれば、21B12抗体と同様のメカニズムにより、「①PCSK9とLDLRタンパク質の結合を中和することができ」る抗体、すなわち結合中和抗体としての機能的特性を有することを特定した点となり、裁判所が認定した本件発明の技術的意義(図1のベン図で示される関係)の前提を崩すことなく、訂正によりその範囲を狭めたものとして理解することができると思われる。
しかし、そのような訂正が仮に許されたとしても、当該訂正発明を提供するためには、「21B12抗体(参照抗体)と競合する」抗体の中から『21B12抗体(参照抗体)が結合する位置と同一又は重複する位置に結合する様式で競合する』ものを選び出す工程や結合中和活性を有するものを選び出す工程は依然として必要とされるであろうから、PCSK9上のどのような位置に結合する抗体が得られるかは「運に支配される」ものであるとした裁判所の判断に対して被告アムジェンはその判断を反駁できる答えを用意する必要があるだろう。
そして、前述のような訂正をすることができたとしても、原告リジェネロンが主張した下記点:
「LDLRのうちPCSK9が結合する領域であるEGFaドメインと相互作用するPCSK9の表面上におけるアミノ酸の大部分を認識する結合中和抗体(「EGFaミミック抗体」と呼ばれる抗体で、現時点においてアリロクマブとして発見されているもの)・・・も含まれるところ、・・・本件優先日及び本件出願時の技術常識や技術水準によれば、不連続なアミノ酸により構成される特定の立体構造的エピトープ(LDLR結合部位)の大部分を認識する抗体を取得するための方法論は存在せず、また、本件明細書にはEGFaミミック抗体を取得できるような記載はない」
について、サポート要件を充足しているのか否かの問題は残されている。
何より、訂正するにあたって、アムジェンにとって一番重要な点は、サノフィのプラルエント® の有効成分である抗PCSK9モノクローナル抗体アリロクマブを依然としてその特許請求の範囲に包含し、特許権侵害を主張し続けることができるかどうかにある。
本件特許を巡る紛争が、前述のような訂正請求の段階に移るとなれば、サノフィのアリロクマブ(EGFaミミック抗体)が依然として本件(訂正)発明の技術的範囲に属することと判断されるのか、それともサポート要件等により無効理由を有することから属さないとの逆転判断となるのか、事件は新たな局面を迎えることとなりそうだ。
(2)「モノクローナル抗体」についての各発明特定事項の意義付け
本件発明1は、まず「モノクローナル抗体」という「物」の発明である。
本件発明1は、その「物」である「モノクローナル抗体」という発明をさらに特定する事項として、
- 「①PCSK9とLDLRタンパク質の結合を中和することができ」るという特定、
- 「②PCSK9との結合に関して、21B12抗体(参照抗体)と競合する」という特定、
- 「③単離された」という特定
の3つの発明特定事項で構成されているが、いずれも「モノクローナル抗体」の構造を直接特定して表現したものではない。
そして、「モノクローナル抗体」に対して、3つの発明特定事項の意義付けはそれぞれ異なる。
ア 「①PCSK9とLDLRタンパク質の結合を中和することができ」
「①結合を中和することができる」抗体には、本件発明の技術的意義や効果を発揮する場面を踏まえると、「結合を中和するために用いることができる(=結合を中和する使いみちに用いる)」抗体としての意義があるわけだから、「①結合を中和することができる」という発明特定事項は、「モノクローナル抗体」について「医薬用途(医薬の使いみちに用いる)『的』※な意義付け」を担っているといえる。
※本件発明1は、「モノクローナル抗体」という「物」の発明であり、「抗体」という物質発明であって、医薬用途発明ではないため、「『的』な意義付け」とした。また、厳密には「中和する」だけでは「どのような医薬の使いみちに用いる」のかについては表現上明確ではないが、発明の効果を発揮する場面では、「中和する」ことと「医薬として使う」ことは同義であろう。
「①結合を中和することができる」という発明特定事項は「モノクローナル抗体」の有用性を示しているにすぎないから、「用途Y用化合物Z」のように、結局のところ用途限定のない「モノクローナル抗体」そのものと解釈される余地があるのではないかという議論はあり得るかもしれない。しかし、「抗原Aに対する抗体」のように、抗体が認識する抗原を特定して抗体を表現することは一般に認められている。そして、「モノクローナル抗体”Z”」のような特定の抗体(点)であれば「①結合を中和することができる」という枠で囲もうが「モノクローナル抗体”Z”」であることに変わりはないが、それとは異なり本件発明の「モノクローナル抗体」という範囲については「①結合を中和することができる」という枠でさらにその範囲を限定する意義がこの発明特定事項にはあるのだから、「用途Y用化合物Z」と同様に解釈することはできないといえる。従って、「①結合を中和することができる」という発明特定事項をクレーム解釈において無視する議論は妥当ではないだろう。
しかし、「モノクローナル抗体」について「①PCSK9とLDLRタンパク質の結合を中和することができ」るという発明特定事項だけでは、あまりにも広い概念を包含した発明であり、その他の発明特定事項で発明をさらに特定しない限り、サポート要件を充足するのは直感的にもさすがに難しいように思う。
そこで、「②PCSK9との結合に関して、21B12抗体(参照抗体)と競合する」という特定が問題となる。
イ 「②PCSK9との結合に関して、21B12抗体(参照抗体)と競合する」
一方、「②参照抗体と競合する」抗体には、本件発明の技術的意義や効果を発揮する場面を踏まえると、「参照抗体と競合するために用いる(=参照抗体と競合する使いみちに用いる)」抗体として意義があるわけではなく、「参照抗体と競合することを確認する方法(手段・プロセス)により同定された」抗体としての意義がある。すなわち、「②参照抗体と競合する」という発明特定事項は、「モノクローナル抗体」について「医薬用途(医薬の使いみちに用いる)『的』な意義付け」はなく、「同定するための手段・プロセスとしての意義付け」のみを担っているといえる。
“そもそも本件発明の課題は・・・PCSK9とLDLRタンパク質との結合を中和する抗体又はこれを含む医薬組成物を提供することであり、このような課題の解決との関係では、参照抗体と競合すること自体に独自の意味を見出すことはできない”(判決文より)
「②参照抗体と競合する」という発明特定事項の「同定するための手段(プロセス)としての意義付け」を踏まえれば、本件発明1は、「プロダクト・バイ・プロセス・クレーム」(製法ではないが手段(プロセス)を経たことにより得られる物というクレームという点)又は、いわゆる「リーチ・スルー・クレーム(reach-through claims)」(現在開示された発明に基づいた、将来なされるであろう発明に対するクレーム)という性質を有していると考えられ、そのような観点からクレームを理解することによって、記載要件に適合するのか否かについて議論することも価値があるのではないだろうか。
上述のように「②参照抗体と競合する」抗体が、「プロダクト・バイ・プロセス・クレーム」という性質を有すると考えれば、プロダクト・バイ・プロセス・クレームの発明の要旨又は特許発明の技術的範囲は物同一説で判断、明確性要件に一定のハードルを課すというような最高裁判決(平成24年(受)2658; 平成24年(受)1204)の考え方を判断に応用することがあり得てもよいのかもしれない。
参考:

また、「②参照抗体と競合する」抗体が、「リーチ・スルー・クレーム」という性質を有すると考えるのならば、リーチ・スルー・クレームで特定される「化合物」については、一般的には、当業者は構造的な定義がなされていない化合物をどのように製造し使用するか理解できず、出願に具体的に記載されたもの以外の特定の化合物がクレームされた範囲に含まれるかどうか事前には知り得ないことや、クレームされた活性を有するかどうかについて、特定されていない化合物を無作為にスクリーニングすることは、過度の実験(過度の負担)を要するものであるとして、明確性要件、実施可能要件やサポート要件を満たさないとされている(三極プロジェクトB3b サーチと審査における相互理解 「バイオテクノロジー関連特許の審査運用に関する比較研究報告書(抄訳)」 テーマ:「リーチ・スルー」クレームについての比較研究 欧州特許庁・日本国特許庁・米国特許商標庁(2001) (英文はこちら))ことも判断に応用することがあり得てもよいのかもしれない。
もちろん、リーチ・スルー・クレームについて、抗体等のバイオ医薬分野では、技術常識や技術進歩も「(低分子)化合物」の分野とは異なるだろうから、必ずしも「化合物」と同様な上記当時の考え方がそのまま当てはまるとは限らないという議論はあるだろう。
しかし、「モノクローナル抗体」について「②参照抗体と競合する」という発明特定事項が、「医薬用途(医薬の使いみちに用いる)『的』な意義付け」はなく、「同定するための手段・プロセスとしての意義付け」のみしか担っていない限り、このようなクレームは、その手段・プロセスをやってみなければ知り得ない/到達しえない「物」までも取り込んだクレームなのであろうから、いわゆる「オーバーリーチング・クレーム(overreaching claims)」として、サポート要件の充足性には疑義があるように思われる。
参考:
- 矢野恵美子 「抗体医薬と特許」 日本知財学会誌 16(1) 5-19 (2019)
- 井関涼子 「上位概念で記載されたクレームと利用発明 ―選択発明・リーチスルークレーム―」 パテント Vol. 71 No. 11(別冊 No.20)(2018)
- バイオ・ライフサイエンス委員会 第 2 部会 「抗体医薬及び食品用途発明における近年の審査傾向とその国際比較令和元年度」 パテント Vol.73 No.6 (2020)
- 劉一帆 「機能および特性により特定したバイオ関連発明の記載要件の充足を認めた事例-PCSK9に対する抗原結合タンパク質事件-」 知的財産法政策学研究 Vol.57 (2020)
- 前田健 「対象物を新着眼の特性で特定したクレームの特許性 : 発見かそれとも発明か? : 機能的に表現された抗体の発明のサポート要件及び進歩性要件を題材として : 知財高判令和元年10月30日平成31年(ネ)第10014号〔PCSK9に対する抗原結合タンパク質〕」 神戸法學雜誌 70巻1号 (2020)
- 田村善之「存続期間満了後の特許無効不成立審決取消訴訟の訴えの利益・進歩性要件の基礎となる引例適格性・サポート要件における課題の再設定について-ピリミジン誘導体事件知財高裁大合議判決の検討-」 知的財産法政策学研究 Vol.56 (2020)
ウ 「③単離された」
「③単離された」という発明特定事項は、「モノクローナル抗体」について、「医薬用途『的』な意義付け」はなく、「単離されるという手段(プロセス)としての意義付け」を担っているといえる。
しかし、「単離された」抗体という用語は、一般に抗体(物)の構造又は特性を特定する用語として概念が定着している。
従って、「③単離された」という発明特定事項を踏まえて「本件発明1はプロダクト・バイ・プロセス・クレームだから最高裁判決(平成24年(受)2658; 平成24年(受)1204)に従って議論すべきだ」などと目くじらを立てるものではないとして、この点については無粋な議論をしないこととする。
参考:
3.「その物の製造方法が記載されている場合」に該当しない類型・具体例
類型(2): 単に状態を示すことにより構造又は特性を特定しているにすぎない場合
具体例:
特に、物の構造又は特性を特定する用語として、概念が定着しているもの(例えば、辞書、教科書、規格文書等に定義等の記載が存在し、かかる記載に照らすと、物の構造又は特性を特定する用語として概念が定着していると判断されるもの)
・・・「単離細胞」・・・
5.おわりに
アムジェンの別件特許第5906333号(こちらの特許は、参照抗体が31H4抗体であるクレーム)に対する無効請求不成立審決に対する審決取消訴訟判決も、同日に言い渡され、リジェネロンが勝訴している(2023.01.26 「リジェネロン v. アムジェン」 知財高裁令和3年(行ケ)10094)。
本件判決において、アムジェンの抗体特許の無効請求に対する判断を知財高裁が一転してひっくり返したことで、アムジェンとリジェネロン/サノフィとの間の抗PCSK9モノクローナル抗体を巡る特許紛争は新たな局面を迎えている。
アムジェンは本件について最高裁へ上告する予定であると伝えている(Amgen Annual report (10-K) filed on Feb. 9, 2023)。
仮にアムジェンが上告した場合には、最高裁での上告受理判断や、それが叶わなかったとしても特許庁での差戻し審判において新たに請求されるかもしれない訂正後発明の審理等に時間がかかり、特許が有効か無効かの判断確定まで相当な期間を要すると想像される。
さらに、訂正に至ったとしても、その訂正後発明の技術的範囲にプラルエント®(アリロクマブ)が属するか否かが確実なものとならない限り(これには別途、訂正後発明の技術的範囲に属しないことの確認を求めた訴訟や差止請求権の不存在確認訴訟の提起が必要になるかもしれない)、特許権侵害のリスクがあり得ること、そして、既に、アムジェンの抗PCSK9モノクローム抗体製剤レパーサ(Repatha)®皮下注(有効成分:エボロクマブ)がある中で日本市場参入の遅れを取り戻す困難さがあることを考えると、サノフィ/リジェネロンがプラルエント®を日本で再販売に向け動くことができるのは相当先の将来か、そもそも難しいと想像される。
アムジェンは、本件特許についての無効請求不成立審決を取り消した本件知財高裁判決を受けて、今後も続く審理を最大限時間をかけて対応する作戦をとると想像される。
また、本件特許ファミリーである分割出願(特願2019-231236)が審判に係属(3/1に審判請求: 拒絶2023-003462)しており、アムジェンは、「参照抗体と競合する」という観点を別の切り口からクレームに表現することで特許取得を目指しているようであるが、本件判決後の審理の行く末を見ながら分割出願で繋いでどのようにプラルエント®をキャプチャーし続けようか作戦を練っているに違いない。
・・・・・
そして、欧米でもまた、同ファミリーのアムジェンの抗体特許を巡る紛争が重要な局面を迎えている。
欧州では、本件特許ファミリーのアムジェンの抗体特許EP2215124に対して、異議の申し立て(サノフィ、リジェネロンを含む5名の異議申立人)がなされ、その後の審判では、アムジェンのRepatha®を保護するクレームは有効であるが、サノフィのPraluent®を包含する広いクレームは無効であると審決された(2020年10月29日)。ドイツでは、Sanofi-Aventis Deutschland GmbHとリジェネロンが、前記審決後に解除されたPraluent®に対する差止命令の仮執行に起因する損害賠償を求める訴訟を起こしている(他の特許での係争も併存した訴訟合戦となって現在複雑に推移しているようである)。
米国では、本件特許ファミリーのアムジェンの米国特許8,829,165及び8,859,741を巡る裁判(Amgen v. Sanofi)が10年近く続いており、最高裁判所は、アムジェンの申し立てを受理し、実施可能要件について審理することを決定した。2023年3月27日に口頭弁論が開催される。
これら米国特許のクレームは、上記で紹介した日本の抗体特許のような「参照抗体と競合する」という発明特定事項をもつクレームではなく、以下のような、抗体が結合するPCSK9のアミノ酸残基(エピトープ)を特定したことでその抗体を機能的に表現したものである。
The ’165 patent claim 1:
An isolated monoclonal antibody, wherein, when bound to PCSK9, the monoclonal antibody binds to at least one of the following residues: S153, I154, P155, R194, D238, A239, I369, S372, D374, C375, T377, C378, F379, V380, or S381 of SEQ ID NO:3, and wherein the monoclonal antibody blocks binding of PCSK9 to LDLR.
The ’741 patent claim 1:
1. An isolated monoclonal antibody that binds to PCSK9, wherein the isolated monoclonal antibody binds an epitope on PCSK9 comprising at least one of residues 237 or 238 of SEQ ID NO: 3, and wherein the monoclonal antibody blocks binding of PCSK9 to LDLR.
これまでの経緯:
- 米国連邦巡回控訴裁判所(CAFC)は、当該特許は実施可能要件違反を理由に無効であるとしてサノフィを支持する判決(No. 20-1074 (Fed. Cir. 2021))を下した。
- これに対し、アムジェンが最高裁判所に裁量上訴の申し立てをし、受理された。
- 最高裁判所は、2023年3月27日にAmgen v. Sanofiの裁判(21-757)の口頭弁論を行う予定。
3月27日の口頭弁論の音声記録はその日のうちに最高裁判所のウェブサイトに掲載されるとのことだ。
21-757 AMGEN INC. V. SANOFI
DECISION BELOW: 987 F.3d 1080
LOWER COURT CASE NUMBER: 2020-1074
QUESTION PRESENTED:
Section 112 of the Patent Act provides that a patent’s “specification shall contain a written description of the invention, and of the manner and process of making and using it,” sufficient “to enable any person skilled in the art * * * to make and use the” invention. 35 U.S.C. § 112(a). The requirement that the specification teach skilled artisans “to make and use” the invention is referred to as the “‘enablement'” requirement. Markman v. Westview Instruments, Inc., 517 U.S. 370, 379 (1996).
The questions presented are:
1. Whether enablement is “a question of fact to be determined by the jury,” Wood v. Underhill, 46 U.S. (5 How.) 1, 4 (1846), as this Court has held, or “a question of law that [the court] review[s] without deference,” Pet. App. 6a, as the Federal Circuit holds.
2. Whether enablement is governed by the statutory requirement that the specification teach those skilled in the art to “make and use” the claimed invention, 35 U.S.C. § 112, or whether it must instead enable those skilled in the art “to reach the full scope of claimed embodiments” without undue experimentation-i.e., to cumulatively identify and make all or nearly all embodiments of the invention without substantial “‘time and effort,'”
Pet.App. 14a (emphasis added).
LIMITED TO QUESTION 2 PRESENTED BY THE PETITION
CERT. GRANTED 11/4/2022


コメント
事件が最高裁へ上訴されたことが確認されました(知財高裁HP審決取消等訴訟(特許・実用新案)係属中事件一覧表/終局事件一覧表(Excelファイル)より)
米国最高裁判所
Oral Argument – Audio
Amgen Inc. v. Sanofi
Docket Number: 21-757
Date Argued: 03/27/23
https://www.supremecourt.gov/oral_arguments/audio/2022/21-757