 2022年12月16日のシンバイオ製薬(SymBio Pharmaceuticals Limited)のプレスリリースによると、シンバイオ製薬は、抗悪性腫瘍剤トレアキシン®点滴静注液100mg/4mL(一般名:ベンダムスチン塩酸塩水和物(Bendamustine Hydrochloride Hydrate)、以下「トレアキシン®」)について、当該製品のライセンス元であるEagle Pharmaceuticals, Inc.(以下「Eagle社」)と共同で、同製品の後発医薬品の製造販売承認取得者である東和薬品に対し、Eagle社が保有するベンダムスチン液剤に関する特許権を侵害するとして、2022年12月16日、東京地方裁判所に特許権侵害に基づく後発医薬品の製造販売の差止及び損害賠償請求訴訟を提起したとのことです。
2022年12月16日のシンバイオ製薬(SymBio Pharmaceuticals Limited)のプレスリリースによると、シンバイオ製薬は、抗悪性腫瘍剤トレアキシン®点滴静注液100mg/4mL(一般名:ベンダムスチン塩酸塩水和物(Bendamustine Hydrochloride Hydrate)、以下「トレアキシン®」)について、当該製品のライセンス元であるEagle Pharmaceuticals, Inc.(以下「Eagle社」)と共同で、同製品の後発医薬品の製造販売承認取得者である東和薬品に対し、Eagle社が保有するベンダムスチン液剤に関する特許権を侵害するとして、2022年12月16日、東京地方裁判所に特許権侵害に基づく後発医薬品の製造販売の差止及び損害賠償請求訴訟を提起したとのことです。
シンバイオ製薬は、2022年2月にトレアキシン®の後発医薬品の製造販売が厚生労働省によって承認されたことを受け、Eagle社の日本における特許権に関しシンバイオ製薬が有する独占的な特許実施権の侵害のおそれが生じたことから、後発医薬品の製造販売承認を取得した4社に対して当該特許権の侵害の懸念について文書によって通告し、適切な対応を要求してきたとのことで、このうち東和薬品は、2022年6月に後発医薬品の販売を開始したため、Eagle社及びシンバイオ製薬は、当該特許権の侵害を理由として、後発医薬品の製造販売の差止及び損害賠償を求め、提訴するに至ったとのことです。
シンバイオ製薬 press release:
- 2022.12.16 「トレアキシン®」に関する特許権侵害訴訟の提起について
- 2022.02.25 後発医薬品の製造販売承認に対する当社対応について
シンバイオ製薬は、2017年9月19日にEagle社とトレアキシン®液剤(RTD製剤及びRI投与)の日本における独占的ライセンス契約を締結しています。
- 2017.09.20 Eagle社 press release: Eagle Pharmaceuticals Licenses Japanese Rights for Bendamustine Hydrochloride Ready-to-dilute and Rapid Infusion Injection Products to SymBio Pharmaceuticals Limited
- Product Collaboration and License Agreement, by and between the Registrant and SymBio Pharmaceuticals Limited, effective as of September 19, 2017




コメント
シンバイオ製薬 press release: 2022.12.26 「トレアキシン®」に関するファイザー株式会社に対する特許権侵害訴訟の提起について
https://contents.xj-storage.jp/xcontents/AS70963/272c2b74/b7c3/4465/a5f6/c7395cbb24ea/140120221226583605.pdf
ファイザー株式会社は2022年12月に後発医薬品の販売を開始したため、Eagle社及びシンバイオは、特許権の侵害を理由として、後発医薬品の製造販売の差止及び損害賠償を求め、提訴しました。
2023.01.13 東和薬品 press release: 当社に対する損害賠償請求訴訟の提起に関するお知らせ
https://www.towayakuhin.co.jp/pdf/news230113.pdf
これによると、東和薬品は、下記の通り、訴訟を提起され、2023年1月12日に訴状が送達されたとのことです。
1.訴訟を提起された裁判所及び年月日
(1)訴訟が提起された裁判所:東京地方裁判所
(2)訴訟が提起された年月日:2022年12月16日
2.訴訟の原因及び提起されるに至った経緯
東和薬品のベンダムスチン塩酸塩点滴静注液 25mg/1mL「トーワ」(先発・代表製剤:トレアキシン点滴静注用 25mg)及びベンダムスチン塩酸塩点滴静注液 100mg/4mL「トーワ」(先発・代表薬剤:トレアキシン点滴静注液 100mg/4mL)は2022年2月に厚生労働省より製造販売承認を取得した。その後原告2社より連名で7件の特許について照会を受け、東和薬品はいずれの特許も侵害しない旨を2022年3月に回答したうえで、2022年6月に薬価収載を受け製品を発売した。その後は原告らからの連絡は受けていない。
3.訴訟を提起した者の概要
原告(1)イーグル・ファーマシューティカルズ・インコーポレーテッド
原告(2)シンバイオ製薬株式会社
4.訴訟内容
(1)原告(1)が保有する特許権(特許第6570601号)に基づき、下記東和薬品製品について製造・販売等の差止め及び製品の廃棄、並びに 10 分かけて患者に投与される旨を記載した添付文書・インタビューフォームの使用の差止め及び廃棄を請求する。
ベンダムスチン塩酸塩点滴静注液 25mg/1mL「トーワ」
ベンダムスチン塩酸塩点滴静注液 100mg/4mL「トーワ」
(2)損害賠償請求
原告(1)が被った損害の一部として 3,000万円、原告(2)が被った損害の一部として9億円を請求する。
5.東和薬品の対応方針と今後について
東和薬品は、裁判において当該特許権を侵害しない旨を主張し争っていく方針。
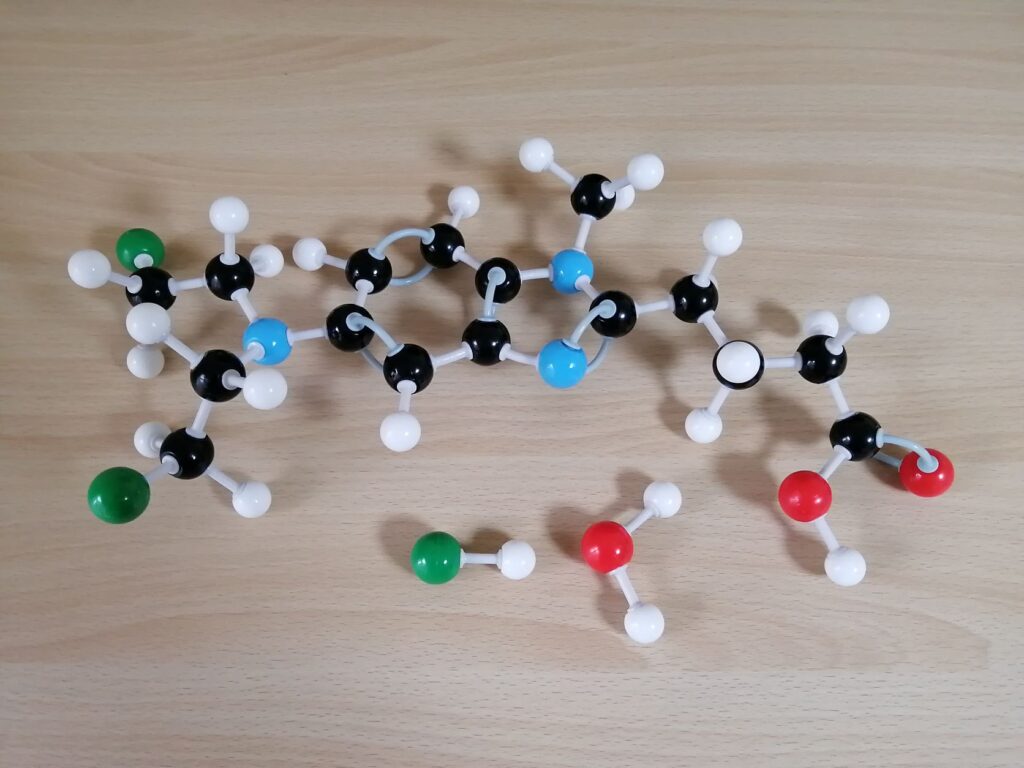
特許第6570601号
【請求項1】
対象における癌又は悪性疾患を治療又は予防するための液体組成物であって、
a)約0.05から約12.5mg/mlのベンダムスチン又はその薬学的に許容される塩、
b)ポリエチレングリコール及びプロピレングリコールを含んでいる可溶化剤、及び場合によって
c)非経口的に許容される希釈剤
を含み、
約100ml+/-15%以下の容量の液体組成物を、それを必要としている対象に約15分以下の実質的に連続した時間にわたって非経口的に投与する、液体組成物。