2022年10月10日、欧州委員会は、Teva社に対し、同社の多発性硬化症治療薬Copaxone®(コパキソン)(有効成分はglatiramer acetate(グラチラマー酢酸塩))の競争を遅らせることを意図した行為により、EU競争法に違反したとの予備的見解を通知しました。
その予備的見解で指摘された一つが、特許手続きの悪用です。
1.Teva社の特許手続きに関する欧州委員会の予備的見解
今回の欧州委員会の予備的見解では、Copaxone®(コパキソン)の有効成分であるglatiramer acetateの基本特許が切れた後も、二次特許出願の分割出願と取り下げを巧みに使ってその一定の保護状態を人為的に引き伸ばし、競合他社にその都度新たに長期の法的挑戦を強いるようにしたTeva社の行為(「Divisionals game」と呼んでいます)は、法的不確実性を人為的に長引かせ、後発医薬品の参入を効果的に阻止または遅延させた、と指摘しています。
2.Divisionals game
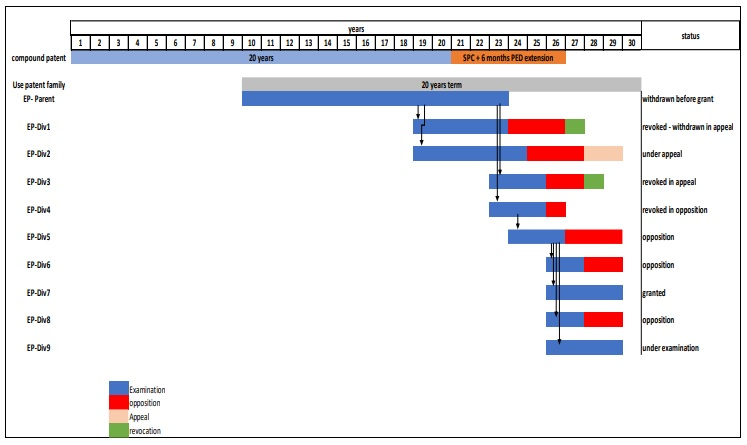
問題となったTeva社による欧州特許出願の「Divisinals game」は、EP2405749ファミリー(出願人はYEDA社)の分割出願手続きのことでしょうか。
特許出願人であるYEDA社はTeva社にCopaxone®をライセンスしています。
この欧州ファミリーの分割出願戦略が欧州委員会から指摘を受けている「Divisionals game」なのかどうか特定できていませんが、もし、このような分割出願戦略のことを指摘しているということであれば、この戦略は、補正要件の厳格な欧州において特許可能な範囲を追求する戦略とも見えるので(EPO審査官は特許を与えていますし)、個人的には悪質とは思えません。
以下が同欧州特許出願ファミリーの分割出願経緯になります。
Filed(2010) ⇒ WO2011022063 ⇒ EP2405749 ⇒ Examination requested(2011) ⇒ Granted(2013) ⇒ Opposition Filed(2014) ⇒ Revoked ⇒Appeal Filed(2016) ⇒ Revoked(2017)
Claim 1. A medicament comprising glatiramer acetate for use in treating a patient who is suffering from relapsing-remitting multiple sclerosis or who has experienced a first clinical episode and is at high risk of developing clinically definite multiple sclerosis, wherein the medicament is to be administered in a regimen of three subcutaneous injections of a 40mg dose of glatiramer acetate every seven days with at least one day between each subcutaneous injection.
⇒Divisional EP2630962 Filed(2013) ⇒ Examination requested(2014) ⇒ Granted(2018) ⇒ Opposition Filed(2019) ⇒ Revoked ⇒ Appeal Filed(2022)
Claim 1. Glatiramer acetate in the form of a pharmaceutical composition for use in treating a human patient suffering from a relapsing form of multiple sclerosis in a regimen of three subcutaneous injections of a 40 mg dose of glatiramer acetate every week with at least one day between every subcutaneous injection and wherein the pharmaceutical composition further comprises mannitol and has a pH in the range of 5.5 to 7.0.
⇒Divisional EP2949335 Filed(2015) ⇒ Examination requested(2015) ⇒ Granted(2017) ⇒ Opposition Filed(2017) ⇒ Valid ⇒ Appeal Filed(2019) ⇒ Revoked(2021)
Claim 1. Glatiramer acetate for use in a regimen of three subcutaneous injections of a 40mg dose of glatiramer acetate every seven days with at least one day between each subcutaneous injection for use in treating a patient who is suffering from a relapsing form of multiple sclerosis or who has experienced a first clinical episode and is at high risk of developing clinically definite multiple sclerosis and wherein the pharmaceutical composition further comprises mannitol.
⇒Divisional EP3199172 Filed(2017) ⇒ Examination requested(2017) ⇒ Granted(2018) ⇒ Opposition Filed(2019) ⇒ Revoked ⇒ Appeal Filed(2022)
Claim 1. Glatiramer acetate for use in treating a human patient suffering from a relapsing form of multiple sclerosis or who has experienced a first clinical episode and is determined to be at high risk of developing clinically definite multiple sclerosis, comprising administering to the human patient three subcutaneous injections of 40mg glatiramer acetate for every seven days with at least one day between every subcutaneous injection, wherein the glatiramer acetate is present in a pharmaceutical composition having a pH in the range of 5.5 to 7.0.
⇒Divisional EP3409286 Filed(2018) ⇒ Examination requested(2019) ⇒ Granted(2020) ⇒ Opposition Filed(2020)
Claim 1. Glatiramer acetate for use in a regimen of three subcutaneous injections of a pharmaceutical composition comprising a 40mg dose of glatiramer acetate every seven days with at least one day between each subcutaneous injection for treating a human patient who is suffering from relapsing-remitting multiple sclerosis, wherein the tolerability of glatiramer acetate treatment in the human patient is increased by reducing the frequency and severity of an immediate post injection reaction or an injection site reaction, wherein the pharmaceutical composition is in a prefilled syringe for self administration by the patient and said treatment comprises reducing the progression of MRI-monitored disease activity in the patient.
「Divisionals game」については、以下の資料が参考になります。
3.今後
この調査に関する詳細は、欧州委員会の競争法に関するウェブサイトで、事件番号AT.40588として公開されている事件簿に掲載される予定とのことです。
欧州委員会の予備的見解が確認されれば、Teva社の行為は、支配的地位の濫用を禁止するEU機能条約(Treaty on the Functioning of the European Union(TFEU))第102条に抵触することになります。
今回の欧州委員会がTeva社に対して通知した予備的見解は、Teva社のどの特許ファミリーの分割出願戦略のことを指しているのか、また分割出願戦略がEU競争法違反になり得るとしたら、違反とされる境界線はどこにあるのか、今後の詳細な調査報告の公開、Teva社の反論、欧州委員会の最終的な見解を待ちたいと思います。


コメント