本記事では、
- FDAが承認した初の重水素化医薬品「Austedo®(deutetrabenazine)」の特許出願審査経過、特許延長、先発権、ANDA訴訟
- Concert社が開発している「CTP-543(deuterated ruxolitinib)」の特許紛争
を眺めながら、既存薬をもとに重水素化医薬品を開発する場合において明らかになってきた課題を、特許的な観点から紹介します。
1.はじめに
米国食品医薬品局(FDA)が初めて重水素化医薬品 「Austedo®」(tetrabenazineを重水素化したdeutetrabenazineを有効成分とするハンチントン病に伴う舞踏運動の治療薬)を承認したのは2017年4月3日。その時から約5年が経過しました。
既存薬の有効成分を重水素化(deuteration)することによって、代謝安定性を改善することに成功し、新たな医薬品としてFDAにより承認されたこと、成功した先発医薬品をある程度参照して開発・申請できることは開発費用と成功確率の面でメリットがあり独占権も確保できれば重水素化医薬品開発は事業価値の見込めるビジネスモデルとしての可能性があること、また、以前からも、重水素化医薬品の開発に特化した企業(例えば、Concert社、Auspex社等)が既存薬の有効成分である化合物の水素を重水素に置換した化合物を次々と特許出願するといった現象も注目されていたこと(Expert Opinion on Therapeutic Patents, 29 Jul 2014, 24(10):1067-1075)から、重水素化医薬品という分野が将来花開くのではないかと期待されました。
しかし、既存薬として公知となっている有効成分を重水素化した化合物発明が非自明性・進歩性の観点で特許性を担保し確固たる製品独占期間を確保できるのかという、特許的な課題があり、その点については随分前から議論がされていました(Deuterated drugs: unexpectedly nonobvious. Journal of High Technology Law. 10 (1): 22–73 (2009))。
さて、Austedo®が重水素化医薬品として初めて米国で承認されてから5年が経過し、Austedo®や開発中の他の重水素化医薬品の特許状況が進展したことにより、重水素化医薬品を巡る特許的課題として議論されていたことが、現実のものとして明らかになってきました。
本記事では、FDAが承認した初の重水素化医薬品「Austedo®」についての特許出願審査の経過、特許延長登録、先発権、後発医薬品申請(Abbreviated New Drug Application(ANDA))に関する特許侵害訴訟の状況、また、Concert社が開発している「CTP-543(deuterated ruxolitinib)」の特許紛争を眺めながら、既存薬をもとに重水素化医薬品を開発する場合において明らかになってきた課題を、特許的な観点から紹介します。
2.Deutetrabenazine (Austedo®), a deuterated form of tetrabenazine
(1)Deutetrabenazine (Austedo®)
2017年4月3日、米国食品医薬品局(FDA)は、ハンチントン病に伴う舞踏運動の治療薬として、deutetrabenazineを有効成分とするAustedo®を承認しました。
Austedo®は、FDAが初めて承認した重水素化医薬品です。
- 2017.04.03 Teva press release: Teva Announces FDA Approval of AUSTEDO™ (deutetrabenazine) Tablets for the Treatment of Chorea Associated with Huntington’s Disease
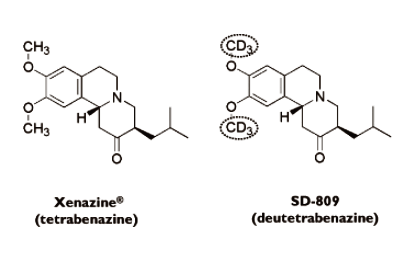
Austedo®の有効成分であるdeutetrabenazineは、既存薬「Xenazine®」の有効成分であるtetrabenazineに含まれる二つのメチル基の水素が重水素に置換されているため、tetrabenazineに比べて、薬物の半減期が長く、薬剤の投与頻度・投与量が少なくて済み、その結果、懸念されていた副作用リスクがより低減されたものとなっています。
Deutetrabenazine(SD-809)は、もともとAuspex社(Auspex Pharmaceuticals, Inc.)により創出・開発されたもので、2015年、Teva社により35億ドルでAuspex社ごと買収されました。
- 2015.05.05 Teva press release: Teva Completes Acquisition of Auspex Pharmaceuticals
Deutetrabenazineのオリジナル化合物であるtetrabenazineは、1958年にHoffmann-La Roche社により抗精神病薬として開発が開始された古い化合物です。その後、過多性運動障害に対する治療効果が注目され、1971年に英国とアイルランドで器質性中枢神経障害に伴う運動障害を適応として承認されました。
米国では、2004年にハンチントン病に伴う舞踏運動の治療薬としてオーファンドラッグに指定され、2008年に承認されました(商品名は「Xenazine®」)。
日本でも、ハンチントン病に伴う舞踏運動の治療薬として承認され、販売されています(商品名は「コレアジン®」)。
(2)Deuterated form may not be obvious.
Deutetrabenazineの化合物発明を保護する米国特許8,524,733(以下、「’733特許」ともいう。)は、その出願の審査において、「先行文献に基づけば、当業者は代謝安定性を改善することを願って重水素化を試みようとする動機が存在することから、その発明(deutetrabenazine)は自明である」とする拒絶通知(103条)を米国特許商標庁(USPTO)の審査官から受けました。
しかし、出願人(Auspex社)は、「Deutetrabenazineは、tetrabenazineに比べて、AUC、Cmaxがより大きく、tetrabenazineの25mgに相当する用量が15mgとより低いものとなり、結果として、副作用がより低いものであるから、tetrabenazineに比べて予想外の優位な特性を有する」ことを臨床試験データに基づいて説明する宣誓供述書を提出し、最終的には、クレーム1を以下のように補正(下線)等したことで、特許許可を得るに至りました。
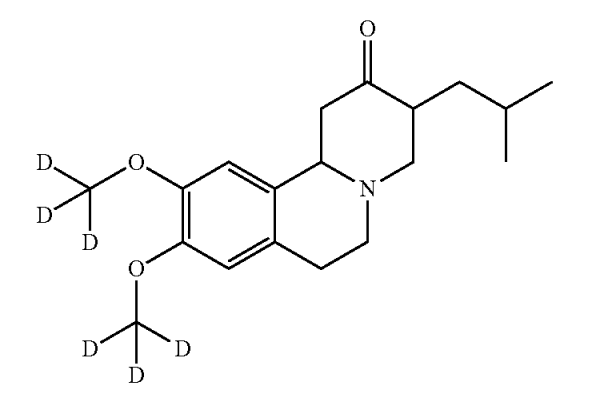 or a salt thereof, wherein each position represented as D has deuterium enrichment of no less than about 90%.
or a salt thereof, wherein each position represented as D has deuterium enrichment of no less than about 90%.以上の審査経過によれば、既存薬の有効成分を重水素化した化合物(deuterated form)は、米国では、新規化合物として新規性(102条)は認められますが、非自明性(103条)が認められるためには、臨床試験データを用いてオリジナル化合物に比べて予想外の効果が重水素化により得られたことを主張して審査官を説得する必要がありそうです。
審査官に対して臨床試験データを揃えて説得することが必要となると、特許性が認められるためには一定の高いハードルが存在するといえます。
- 欧州でも、進歩性欠如の拒絶理由通知が発せられましたが、deutetrabenazineの一化合物にクレームを限定する補正をしたことで特許許可となり(比較データ等の提出はせず)、登録されました(EP2326643B)。
- 日本でも、新規性及び進歩性欠如の拒絶理由通知が発せられましたが、deutetrabenazineの一化合物にクレームを限定する補正をしたことで特許許可となり(比較データ等の提出はせず)、登録されました(特許第5616345号)。
このように、Deutetrabenazineの化合物発明について、米・欧・日における特許出願審査では、tetrabenazineからの非自明性(進歩性)欠如の拒絶理由が発せられましたが、最終的には登録に至りました。
しかし、審査官が特許許可の判断をしたとしても、第三者からの無効チャレンジを受けた際に、審判や裁判で耐えることができるか、という懸念はつきまとうことになります。
(3)Deuterated form is eligible for patent term extension.
前述のdeutetrabenazineの化合物発明を保護する’733特許は、Austedo®の承認に基づいて、562日の特許期間延長が認められました。
米国における特許延長制度は、日本と異なり、最初の有効成分(35.U.S.C.156(f)(1)の”product”)の承認にのみ特許延長を認めていますが、その後は同じ有効成分(塩やエステルも含む)の追加承認に基づく特許延長を認めていません。
Austedo®の特許延長出願手続きにおいて、FDAは、Austedo®の承認は最初の有効成分(”product”)を許可するものであると認定しました(Letter from Food and Drug Administration (FDA) or Department of Agriculture RE: Patent Term Extension (PTE) Application(02/02/2018))。
以上の延長登録の審査経過によると、既にオリジナル化合物(tetrabenazine)が承認されていたとしても、その重水素化された有効成分(deutetrabenazine)は、別の”product”であると位置づけられ、重水素化医薬品の承認に基づいて延長登録の機会を享受することができるといえるでしょう。
この認定は、後述の、既存薬の有効成分を重水素化した化合物は、新規化学物質(New Chemical Entity(NCE))であると位置づけ、5年間のNCEの独占権(「先発権」ともいう)を享受することができることとも整合します。
参考: 平成27年2月 一般財団法人 知的財産研究所「医薬品等の特許権の存続期間の延長登録制度及びその運用の在り方に関する調査研究報告書」
- Ortho-McNeil and Daiichi Sankyo v. Lupin, (Fed. Cir. 2010)・・・CAFCは、ラセミ混合物(ofloxacin)に対する先行処分は、そのラセミ混合物の単一のアイソマー(levofloxacin)に対する特許権の存続期間延長の妨げにならないと判断しました。
- PhotoCure ASA v Kappos, (Fed. Cir. 2010)・・・CAFCは、既にアミノレブリン酸塩酸塩(ALA塩酸塩)の特許権について延長が認められていたところ、そのメチルエステルのプロドラッグであるアミノレブリン酸メチル塩酸塩(MAL塩酸塩)の活性成分はMAL塩酸塩であるとして、特許権の存続期間の延長を認めました。
Austedo®を保護する特許リストをOrangebookから閲覧すると、deutetrabenazineに関する’733特許の満了日は、特許延長期間と小児適用による6か月独占期間分も含めて2031年10月3日となっています。
(4)Deuterated form qualifies for NCE Exclusivity.
Deutetrabenazineを有効成分とするAustedo®の米国での新薬承認申請(NDA)は、既承認のtetrabenazineを有効成分とするXenazine®を参照薬として、そのデータに依拠することにより、連邦食品医薬品化粧品法(Federal Food Drug and Cosmetic Act)505条(b)(2)に基づいて行われました(Application number: N208082)。
FDAのCDER Exclusivity Boardは、「deutetrabenazineとtetrabenazineとは構造的に異なり、同じ”active moiety”ではないから、deutetrabenazineは、NDAにおいてまだ承認されたことのない”active moiety”であり、また、オーファンドラッグの指定を受けることが適切である」と判断しました。
“The Board concluded that tetrabenazine and dutetrabenazine are not the same active moiety under FDA’s regulations and precedent. Therefore, dutetrabenazine and tetrabenazine are not the “same drug” under the statute and regulations governing orphan drugs and it is appropriate to grant orphan drug designation to dutetrabenazine without a plausible theory of superiority to tetrabenazine. In addition, we concluded that the active moiety dutetrabenazine has not yet been previously approved in any new drug application (NDA).”
Ref. CDER Exclusivity Board, DETERMINATION OF WHETHER SD-809 (DUTETRABENAZINE) AND TETRABENAZINE ARE DIFFERENT ACTIVE MOIETIES (07/31/2015) available from FDA LAW BLOG 2017.07.16 FDA Determines that Deuterated Compounds are NCEs and Different Orphan Drugs Versus Non-deuterated Versions
すなわち、deutetrabenazineは、5年間の新規化学物質(New Chemical Entity(NCE))の独占権及び7年間の希少疾病用医薬品(Orphan Drug)の独占権(これら併せて「先発権」ともいう)を享受することができると判断されました。
従って、特許権がどうであれ、2024年4月までは後発医薬品は承認されないことになります。
参考:
- CDER Exclusivity Board, DETERMINATION OF WHETHER SD-809 (DUTETRABENAZINE) AND TETRABENAZINE ARE DIFFERENT ACTIVE MOIETIES (07/31/2015) available from FDA LAW BLOG 2017.07.16 FDA Determines that Deuterated Compounds are NCEs and Different Orphan Drugs Versus Non-deuterated Versions
- Drug@FDA: Austedo Medical Review(s) (pdf p81/273)
このFDAの決定によれば、既存薬の有効成分を重水素化した化合物(deuterated form)は、新規化学物質(New Chemical Entity(NCE))であると位置づけられ、5年間のNCEの独占権を享受することができることになります。
Auspex社が、Austedo®の開発段階でFDAと交渉し、deutetrabenazineのNCE及びOrphan Drugの独占権(先発権)を享受することができることを勝ちとったことは、Austedo®だけでなく、その後に続くかもしれない重水素化医薬品の開発にとって、非常に重要な成果であったといえるでしょう。
米国と同様に、欧州や日本でも重水素化した化合物が新規有効成分として取り扱われるのであれば、欧州では医薬データ保護期間、日本では再審査期間という「先発権」を享受することができることになると想像されます。
(5)Deutetrabenazine patent dispute
2022年5月2日付のプレスリリースにて、Teva社は、Lupin社がAustedo®(deutetrabenazine)に関する複数の特許について無効を主張して提出した後発医薬品申請(Abbreviated New Drug Application(ANDA))に関する特許侵害訴訟を和解することで同社と合意したと発表しました。
- 2022.05.02 Teva社 press release: Teva Announces Settlement with Lupin Resolving AUSTEDO® (deutetrabenazine) Patent Dispute
今回の和解契約により、ニュージャージー州連邦地方裁判所における特許侵害訴訟(3:21-cv-13247)は終了し、Lupin社は、2033年4月から又は特定の状況下ではそれよりも早く、その後発医薬品を販売するライセンスを取得することになります。
Lupin社との特許紛争において、deutetrabenazineに関する’733特許は争いの対象ではなかったようです。
- Teva v. Lupin Cased 3:21-cv-13247 Filed 7/1/2021(COMPLAINT: “Lupin’s Notice Letter did not dispute infringement or validity of two additional patents—U.S. Patent No. 8,524,733 and U.S. Patent No. 10,959,996—that were listed for AUSTEDO® in the Orange Book at the time Lupin submitted its ANDA.”)
また、同プレスリリースは、deutetrabenazineに関する’733特許に対してApotex社が提出した当事者系レビュー(Inter Partes Review(IPR))の申立てに対し、2022年3月9日、米国特許商標庁特許審判部(PTAB)はIPRの申立てを認めなかったことや、Aurobindo社が提出したANDAについて、Teva社は特許侵害訴訟手続きを継続していくことも伝えています。このAurobindoとのANDA訴訟では、’733特許は争いの対象となっています。
- Teva v. Aurobindo Case 3:21-cv-13240 Filed 7/2/2021
Xenazine®を保護する特許は満了しており、既に10社以上の後発医薬品が米国市場に参入していますが、Austedo®の2021年の北米での売上収益は、前年度比26%増の$802mと成長を続けています(2022.02.09 Teva Annual report Form 10-K)。
そして、Deutetrabenazineに関する’733特許は2031年10月まで存続し、Lupin社とのANDA訴訟では同社の市場参入を2033年4月以降で和解できたことから、しばらくは後発医薬品の脅威にさらされることなくAustedo®の持続的な売上収益は見込めそうです。また、中国でも販売が開始されており、ブラジルでも承認を取得したようです。
Teva社にとって残るリスクは、もうひとつのAurobindo社とのANDA訴訟です。Austedo®の持続的な売上収益は、Teva社がこの訴訟でAurobindo社からの’733特許に対する無効の主張を跳ね返すことができるかにかかっています。
3.CTP-543, a deuterated form of ruxolitinib (Jakavi®)
(1)CTP-543
Concert社(Concert Pharmaceuticals, Inc.)は、既存薬に同社が持つDCE(deuterated chemical entity)技術に関するプラットフォームを適用して、新たな重水素化医薬品を創出、開発している企業です。
現在、円形脱毛症(alopecia areata)の経口治療薬として、JAK1/2阻害剤であるruxolitinib(ルキソリチニブ)の8カ所の水素原子を重水素に置換したCTP-543を開発しています。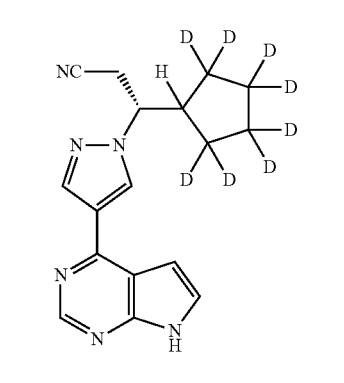 オリジナル化合物であるruxolitinibは、Incyte社により開発され、米国では、2011年11月に、血液増殖性疾患である骨髄線維症の治療薬として承認され(商品名は「Jakafi®」(有効成分: ruxolitinib phosphate))、アトピー性皮膚炎治療薬(外用クリーム剤)としても、2021年9月に承認されています(商品名は「Opzelura®」)。
オリジナル化合物であるruxolitinibは、Incyte社により開発され、米国では、2011年11月に、血液増殖性疾患である骨髄線維症の治療薬として承認され(商品名は「Jakafi®」(有効成分: ruxolitinib phosphate))、アトピー性皮膚炎治療薬(外用クリーム剤)としても、2021年9月に承認されています(商品名は「Opzelura®」)。
Concert社がCTP-543で開発している円形脱毛症については、ruxolitinibは承認を取得していません。
Ruxolitinibの円形脱毛症に対する効果についての論文等は存在しますが、現在、Incyte社のウェブページに開示されているポートフォリオには、ruxolitinibについて円形脱毛症を開発しているとの記述は見当たりません(Lilly社にライセンスアウトしたJAK1/2阻害剤baricitinibについては円形脱毛症について現在開発中のようです。)。
- Oral ruxolitinib induces hair regrowth in patients with moderate-to-severe alopecia areata: JCI Insight. 2016 Sep 22;1(15):e89790. doi: 10.1172/jci.insight.89790
- 2016.09.22 Columbia大学 press release: Drug Restores Hair Growth in Patients with Alopecia Areata
- Ruxolitinib cream for the treatment of patients with alopecia areata: A 2-part, double-blind, randomized, vehicle-controlled phase 2 study: J Am Acad Dermatol. 2020 Feb;82(2):412-419. doi: 10.1016/j.jaad.2019.10.016
(2)Deuterated form may be obvious ?
Concert社は、CTP-543(deuterated ruxolitinib)の化合物発明に関する米国特許9,249,149(以下、「’149特許」ともいう。登録日: 2016.02.02、満了日: 2033.06.14)及びCTP-543の脱毛症治療用途発明に関する米国特許10,561,659(以下、「’659特許」ともいう。登録日: 2020.02.16、満了日: 2037.05.04)を保有しています。
2018年4月、米国特許商標庁特許審判部(PTAB)は、CTP-543の化合物発明に関する’149特許の無効を求めてIncyte社が提出した当事者系レビュー(Inter Partes Review(IPR))手続を開始し(IPR2017-01256)、2019年4月、同特許の請求項は自明であるとの決定(Final Written Decision)を下しました。
“Accordingly, the results asserted to demonstrate an “increased time in the therapeutic window” and an “increased clinical response at a given dose” for CTP-543 as compared to ruxolitinib are not of a “kind” so as to support a finding of nonobviousness of the challenged claims.”
– IPR2017-01256のFinal Written Decision (2019.04.08)より
その後、IPRにおける行政特許判事の権限が合衆国憲法の任命条項に違反すると判断した最高裁判決(Arthrex, Inc. v. Smith & Nephew, Inc.)を踏まえ、PTABの決定は一旦取消され、差戻されており、現時点では、まだ決着に至っていないようです(Intellectual Property – Concert Pharmaceuticals)。
また、CTP-543の脱毛症治療用途発明に関する’659特許に対しても、Incyte社が無効を求めてPost Grant Reviewの請求を提出しており(PGR2021-00006)、PTABは、2021年5月12日、審理手続開始を決定しました。
(3)Potential barriers to the commercialization of CTP-543
ア Third parties may sue Concert alleging that Concert is infringing their intellectual property rights
Concert社は、開発中のCTP-543について、Incyte社が保有しているruxolitinibの米国特許9,662,335やColumbia大学が保有(Aclaris社にライセンス)しているruxolitinibの用途特許との関係で問題があることをAnnual reportで開示しています(Form 10-K: 2018.03.01, 2022.03.03)。
- Concert社 Annual Report on Form 10-K(2018.03.01)
“For example, CTP-543 is a deuterium-modified version of ruxolitinib. Ruxolitinib is marketed in the U.S. by Incyte Corporation under the name Jakafi. Incyte has patents covering ruxolitinib that may be unexpired if and when we seek marketing approval for CTP-543. Incyte also has US patent 9,662,335 that broadly claims deuterated analogs of ruxolitinib. On June 27, 2017, we filed a Post Grant Review with the Patent Trial and Appeal Board, or PTAB, seeking to invalidate all claims of Incyte’s U.S. Patent No. 9,662,335, which includes claims relating to deuterated ruxolitinib analogs. In January 2018, the PTAB rejected our petition to challenge the validity of the ‘335 patent. In addition, Columbia University is the assignee of a patent claiming the use of ruxolitinib for the treatment of hair loss disorders, including alopecia areata, which may be unexpired if and when we seek marketing approval for CTP-543. If we have to defend ourselves in a patent infringement suit, we may incur significant expenses in doing so. Such litigation could delay our ability to market, or prevent us from marketing, CTP-543.”
- Concert社 Annual Report on Form 10-K(2022.03.03)
“In June 2017, we filed a PGR with the PTAB seeking to invalidate all claims of Incyte’s U.S. patent that covers deuterated analogs of ruxolitinib. In January 2018, the PTAB did not grant our petition to challenge the validity of Incyte’s patent. In May 2018, our request for reconsideration was denied.
In addition, Columbia University is the assignee of patents licensed to Aclaris Therapeutics, Inc. claiming the use of ruxolitinib, isotopic forms of ruxolitinib and other named JAK inhibitors for the treatment of hair loss disorders, including alopecia areata, which may be unexpired if and when we seek marketing approval for CTP-543.”
以下に、Concert社が開発中のCTP-543にとって問題となっているIncyte社特許とColumbia大学特許をそれぞれ紹介します。
イ Incyte’s U.S. Patent No. 9,662,335
Incyte社が保有しているruxolitinibの米国特許9,662,335(以下、「’335特許」ともいう。登録日: 2017.05.30、満了日: 2026.12.12)のクレーム1は以下のとおり、Concert社が開発中のCTP-543(deuterated form of ruxolitinib)を包含しています。
‘335特許の出願審査において、審査官から以下のような指摘等があり、他の関連特許と自明型ダブルパテントであるとして拒絶理由が発せられましたが、最終的には、ターミナールディスクレーマーにより特許許可に至りました。
“The natural abundance of deuterium is 0.0115%. Therefore, a compound with 17 hydrogen atoms will contain 0.20% of molecules with one deuterium atom. Thus, the claims are broad and encompass the inherency of the characteristic of natural abundant isotopes. Even the most tiny trace is sufficient to anticipate, SmithKline Beecham Corp. v. Apotex Corp., 74 USPQ2d 1398 (CAFC 2005).”
‘335特許は、ruxolitinibの物質特許7,598,257から審査を係属させてつないできた継続出願によるもので、Incyte社がConcert社のCTP-543を捕捉するように特許請求の範囲を作り変えてきたことは明らかです。
Concert社は同特許の無効を求めてPost grant reviewを請求しましたが、請求は認められませんでした(PGR2017-00034)。
当該特許の当初明細書には、以下のとおり、重水素化に関連する一般的な記載が存在していました。
“Compounds of the invention can also include all isotopes of atoms occurring in the intermediates or final compounds. Isotopes include those atoms having the same atomic number but different mass numbers. For example, isotopes of hydrogen include tritium and deuterium.
・・・
The present invention further includes isotopically-labeled compounds of the invention. An “isotopically” or “radio-labeled” compound is a compound of the invention where one or more atoms are replaced or substituted by an atom having an atomic mass or mass number different from the atomic mass or mass number typically found in nature (i.e., naturally occurring). Suitable radionuclides that may be incorporated in compounds of the present invention include but are not limited to 2H (also written as D for deuterium),…
・・・
The present invention can further include synthetic methods for incorporating radio-isotopes into compounds of the invention. Synthetic methods for incorporating radio-isotopes into organic compounds are well known in the art, and an ordinary skill in the art will readily recognize the methods applicable for the compounds of invention.”
従って、Concert社は、Incyte社の特許の問題を解決しない限り、Incyte社の’335特許が満了する2026年12月12日まで、CTP-543の米国承認を得ることは難しい状況となっています。
医薬分野における新規化合物の発明に関する特許出願の明細書には、発明化合物の各原子は同位体原子に(例えば、1Hを2Hに)置換可能である旨の記載をしておくことは一般的です。このIncyteの特許の例は、その記載を明細書に仕込んでおいたことが後に競合会社の製品を捕捉するのに役立った実例と言えます。
Incyte社は、欧州でも、米国’335特許と同様に、CTP-543を捕捉したクレームにて特許を成立させました(EP3184526B)。
しかし、日本にはそのような分割出願はありません。Concert社がCTP-543の化合物発明である米国’149特許ファミリーを日本では権利化していないことから、「Concert社は日本市場に興味ないのだろう」と、Incyte社は推測し、日本では対抗策を講じなかったのかもしれません。
ウ Columbia University’s U.S. Patent Nos. 10,265,258 and 11,298,570
Columbia大学が保有しているruxolitinibの用途発明に関する米国特許として、少なくとも10,265,258(登録日: 2019.04.23、満了日: 2031.11.02)及び11,298,570(登録日: 2022.04.12、満了日: 2031.11.02)があり、以下のとおり、Concert社が開発中のCTP-543の円形脱毛症治療用途を特許請求の範囲に包含しています。
U.S. Patent No. 10,265,258
1. A method of treating alopecia areata in a human in need thereof comprising administering to the human an effective amount of a Janus kinase (JAK) inhibitor having the following structure: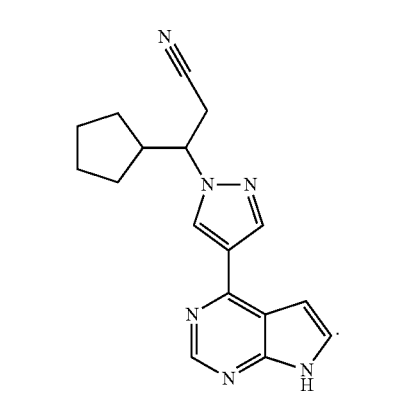
・・・
10. The method of claim 1, wherein the JAK inhibitor includes an isotope.
11. The method of claim 1, wherein the JAK inhibitor includes one or more isotopes of carbon or hydrogen.
U.S. Patent No. 11,298,570
1. A method of treating a hair loss disorder in a subject in need thereof, the method consisting of: administering to the subject an effective amount of a small molecule janus kinase (JAK) 1 and/or JAK2 inhibitor, wherein the JAK1 and/or JAK2 inhibitor comprises one or more isotopes.
2. The method of claim 1, wherein the JAK1 and/or JAK2 inhibitor is selected from ruxolitinib (INCB018424), filgotinib (GLPG0634), Tyrphostin B42 (AG490), momelotinib (CYT387), pacritinib (SB1518), baricitinib (LY3009104), AZD1480, fedratinib (TG101348), BMS-911543, and lestaurtinib (CEP-701), a pharmaceutically acceptable salt thereof, or a combination thereof.
いずれの特許も、JAK阻害剤による脱毛症治療用途発明に関する特許出願を係属させてつないできた継続出願によるもので、Columbia大学がConcert社のCTP-543を捕捉するように特許請求の範囲を作り変えてきたことは明らかです。
Columbia大学から特許ライセンスを受けているAclaris社(Aclaris Therapeutics, Inc.)は、米国特許10,265,258が登録されたことを受けて、Concert社のCTP-543に対する牽制と考えられるプレスリリースを発しています。
- 2019.04.24 Aclaris社 press release: Aclaris Therapeutics Announces Issuance of a Patent Covering the use of Ruxolitinib and its Deuterated Forms to Treat Alopecia Areata
以上のとおり、Concert社は、Columbia大学の特許の問題も解決しない限り、Columbia大学のこれら米国特許が満了する2031年11月2日まで、円形脱毛症治療薬としてのCTP-543の米国承認を得ることは難しい状況となっています。
Columbia大学の各特許が2031年11月2日に満了するまで待っていたら、Concert社が保有するCTP-543の化合物に関する’149特許(満了日: 2033.06.14)及びCTP-543の脱毛症治療用途に関する’659特許(満了日: 2037.05.04)の残存期間は、それぞれ約1年半及び約5年半だけとなってしまいます。
4.おわりに
重水素化医薬品の有効成分(deuterated form)は、やはりオリジナル化合物からの非自明性/進歩性という点で、特許性が認められるためには一定の高いハードルが存在するといえます。
特許として登録することができても、第三者からの無効チャレンジを受けた際に、審判や裁判で耐えることができるか、攻撃を受けやすい点があるということについて特許権の脆弱性は覚悟しておく必要があるでしょう。
FDAが承認した初の重水素化医薬品である「Austedo®」の例によれば、米国では、オリジナル化合物が既に医薬品の有効成分として承認されていたとしても、その重水素化された化合物を有効成分とする医薬品は、独立して、特許延長登録の機会と5年の新規化学物質(New Chemical Entity(NCE))の独占権(先発権)を享受することができます。
米国と同様に、欧州や日本でも重水素化した化合物が新規有効成分として取り扱われるのであれば、特許延長登録の機会だけでなく、欧州では10年の医薬品データ保護期間、日本では8年の再審査期間という「先発権」を享受することができることになると想像されます。
さらに希少疾病用医薬品となれば、その先発権は、米国であれば7年、日本であれば10年となり、後発医薬品の市場参入の脅威から一定期間の保護が約束されることになります。

こうなれば、「特許が取得できなくても、まあいいか」、という考え方もあるかも・・・。
しかし、既存薬の重水素化医薬品を開発するにあたって何よりも重要なこととは、事業自由度(freedom-to-operate(FTO))の確保です。
「CTP-543」の例のように、重水素化した化合物の独占期間を得ることができたとしても、オリジナルの既存薬を保有する競合会社等にオリジナル化合物(または用途)特許からの継続出願でその重水素化した化合物を捕捉されてしまえば、その重水素化医薬品のFTOにとって致命的な問題となります。
既存薬をもとに重水素化医薬品を開発するのであれば、特許的な観点として、特にオリジナルの既存薬に関する特許ファミリーが生き残っている場合には、FTOにとって致命的な問題とならないように、それら第三者特許の満了時期も見定めながら、特許クリアランスとリスク対策をしっかり実施しておく必要があります。
そして、特許権の脆弱性リスクも踏まえると、事業性評価として採算がとれそうかどうか検討する際の独占期間の設定は、保守的には先発権による独占期間を考えておくことが妥当かもしれません。
その意味で、「Austedo®」のように、先発権がより長く確保できる希少疾病用医薬品において、満たされていないニーズ(用量と副作用リスクの低減)を狙ったポジショニングを選択したことは良い戦略だったと思われます。



コメント
Austedo®(Teva社)にとって残るリスクは、Aurobindo社とのANDA訴訟でしたが、Teva社とAurobindo社とがジェネリック参入は2033年4月からとする和解に至ったことで、Austedo®の有効成分deutetrabenazineの化合物特許は生き延び、Austedo®の持続的な売上収益はしばらくの期間確保できたことになります。
https://www.tevapharm.com/news-and-media/latest-news/teva-announces-settlement-with-aurobindo-resolving-austedo-deutetrabenazine-patent-dispute/
“Teva Branded Pharmaceutical Products R&D, Inc. and Auspex Pharmaceuticals, Inc., U.S. affiliates of Teva Pharmaceutical Industries Ltd. (NYSE and TASE: TEVA), have reached an agreement with Aurobindo to resolve the dispute over Aurobindo’s Abbreviated New Drug Application (“ANDA”) for a generic deutetrabenazine product. Teva and Aurobindo have been involved in a patent infringement litigation in which Teva asserted a number of patents against Aurobindo that cover Teva’s AUSTEDO® (deutetrabenazine) product.
Under the terms of the settlement agreement, the litigation between the parties in the United States District Court for the District of New Jersey will be ended, and Aurobindo will have a license to sell its generic product beginning April 2033, or earlier under certain circumstances.”
その後、Concert社を買収したSun社はLEQSELVI™ (CTP-543であるdeuruxolitinib)のFDA承認取得に成功しましたが、その直前にやはりIncyte社から特許権侵害で訴えられました。また、Incyte社はCTP-543特許に対しても無効を請求しており、予想通りの徹底的な特許攻勢を仕掛けています。やはり既存医薬品から他社が重水素化医薬品を開発する場合の特許的な一番の問題が現実のものとなったケースといえるでしょう。
2022.12.28 Notice of Appeal Filed (Incyte v. Sun: CAFC Case No. 23-1300)
Original Decision: PGR2021-00006 – Incyte v. Concert
Sun’s U.S. Patent No. 10,561,659 (’659 patent)
2023.03.06 Sun Pharma press release: Sun Pharma Completes Acquisition of Concert Pharmaceuticals
https://sunpharma.com/wp-content/uploads/2023/03/Press-Release-Sun-Pharma-Completes-Acquisition-of-Concert-Pharmaceuticals.pdf
2023.08.22 Decision by Court of Appeals for the Federal Circuit – Affirmed (Sun v. Incyte: CAFC Case No. 19-2011)
Sun’s U.S. Patent No. 9,249,149 (’149 patent)
https://cafc.uscourts.gov/opinions-orders/19-2011.OPINION.8-22-2023_2178325.pdf
2024.06.11 Filed Declaratory judgment action for infringement of Incyte’s U.S. Patent No.9,662,335 (“the ’335 Patent”) by Sun
New Jersey District Court (2:24-cv-06944)
INCYTE CORPORATION et al v. SUN PHARMACEUTICAL INDUSTRIES LTD. et al
2024.07.26 Sun Pharma press release: U.S. FDA Approves LEQSELVI™ (deuruxolitinib), an Oral JAK Inhibitor for the Treatment of Severe Alopecia Areata
https://sunpharma.com/wp-content/uploads/2024/07/Sunpharma-LEQSELVI-Approval-Scenario-Press-Release.pdf
FDA Approval Letter:
https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/217900Orig1s000correctedltr.pdf
Approved Label: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/217900Orig1s000correctedlbl.pdf
2024.12.03 ブログ記事: 重水素化医薬品LEQSELVI®(deuruxolitinib)の現状に思うこと
https://www.tokkyoteki.com/2024/12/leqselvi-deuruxolitinib.html