Summary
効能・効果を「神経障害性疼痛・線維筋痛症に伴う疼痛」とする先発医薬品リリカ®の医薬用途特許を保有する原告(ワーナー-ランバート)とその後発医薬品を販売等する被告(東和薬品)との間で争われていた、延長登録された特許権の侵害差止請求事件。
東京地裁(民事第46部)は、
- 全ての「痛み」に関する本件発明1及び2に係る特許は、サポート要件違反により無効である
- 本件発明1及び2を「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定する本件訂正は、新規事項の追加に当たるから、訂正要件を満たさず、訂正の再抗弁は認められない
- 「炎症性疼痛又は術後疼痛」に関する本件発明3及び4について、被告医薬品はその特許発明の技術的範囲に属しない(文言侵害も均等侵害も成立しない)
から、延長登録された本件特許権の効力が被告医薬品の販売等に及ぶか等、その他の争点について判断するまでもなく、原告の請求を棄却した。
1.事件の背景
本件(東京地裁令和2年(ワ)19929)は、発明の名称を「イソブチルGABAまたはその誘導体を含有する鎮痛剤」とする特許第3693258号を保有する原告(ワーナー-ランバート)が、被告(東和薬品)が承認を受けた後発医薬品「プレガバリンカプセル25mg「トーワ」」等(被告医薬品)が本件特許発明の技術的範囲に属し、被告による被告医薬品の販売等が本件特許発明の実施に当たると主張して、被告医薬品の販売等の差止め及び廃棄を求めた事案である。
先発医薬品はリリカ®(カプセル・OD錠)。プレガバリンを有効成分とし、「神経障害性疼痛・線維筋痛症に伴う疼痛」を効能・効果とする。本件特許権に係る専用実施権者であるファイザーが販売し、2019年度には国内売上が1000億円を超える大型製品となっていた(2021年9月にファイザーからヴィアトリス製薬へ製造販売移管)。
後発医薬品メーカーは、リリカ®の再審査期間終了(2018年4月15日)後にリリカ®の後発医薬品の薬事承認申請をすることができるが、リリカ®を保護する本件特許(効能・効果を保護する医薬用途特許)の問題を回避できなければ、その後発医薬品の承認を取得し販売することはできない。
本件特許第3693258号は、実は20年の存続期間満了日が2017年7月16日であったところ、特許存続期間の延長が登録され、最長満了日は2022年7月16日となっており、その延長された特許権がリリカ®の後発医薬品参入に対抗する最後の砦となっていた。
このように後発医薬品の参入障壁となっていた本件特許に対して、2017年1月16日、後発医薬品メーカーである沢井製薬は、とうとう特許無効審判を請求した(無効2017-800003号事件)。
参考記事:
審判には、他の後発医薬品メーカーも次々と沢井製薬側への参加を表明。後発医薬品メーカーは以下の15社に上った。
日新製薬株式会社、サンド株式会社、日本ケミファ株式会社、テバ・ホールディングス株式会社、大原薬品工業株式会社、ダイト株式会社、日医工株式会社、ニプロ株式会社、共和薬品工業株式会社、小林化工株式会社、日本ジェネリック株式会社、東和薬品株式会社、Me ファルマ株式会社、辰巳化学株式会社、株式会社フェルゼンファーマ
そして、2020年7月14日、特許庁が下した審決の内容は、「請求項1及び2に係る本件訂正を認めず、請求項1及び2に係る発明についての本件特許を無効とし、他方、請求項3及び4に係る本件訂正を認め、請求項3及び4に係る発明についての審判の請求は成り立たない」というものであった(以下「本件審決」という。)。
参考記事:
この審決に対して、特許権者(原告)は、本件審決のうち請求項1及び2に係る部分(無効)の取消しを求める審決取消訴訟を提起した(本事件の東京地裁判決の後、2022年3月7日に判決が言渡されている。2022.03.07 「ワーナー-ランバート v. 沢井製薬」知財高裁令和2年(行ケ)10135)。なお、本件審決のうち請求項3及び4に係る部分(無効請求不成立)は確定したため、本件特許の請求項3及び4は以下の表1のとおりに訂正された。
| 請求項 | 訂正前 | 訂正後 | 審決での訂正可否判断 |
|---|---|---|---|
| 1 | (本件発明1) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する痛みの処置における鎮痛剤。 | (本件訂正発明1) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤。 | 否 |
| 2 | (本件発明2) 化合物が,式IにおいてR3およびR2はいずれも水素であり,R1は-(CH2)0-2-iC4H9である化合物の(R),(S),または(R,S)異性体である請求項1記載の鎮痛剤。 | (本件訂正発明2) 式I (省略)(式中,R3およびR2はいずれも水素であり,R1は-(CH2)0-2-iC4H9である)の化合物の(R),(S),または(R,S)異性体を含有する,神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤。 | 否 |
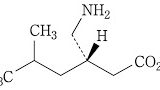
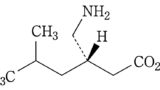
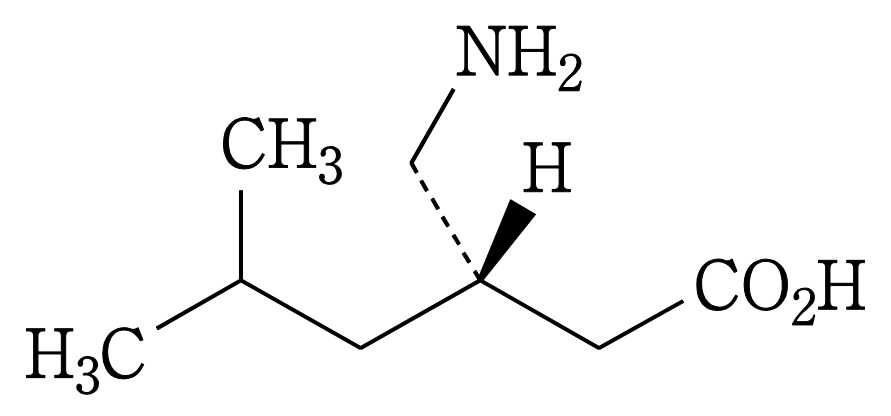
| 3 | (訂正前発明3) 化合物が,(S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸である請求項1記載の鎮痛剤。 | (訂正後の本件発明3) (S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸を含有する,炎症を原因とする痛み,又は手術を原因とする痛みの処置における鎮痛剤。 | 可 (確定) |
| 4 | (訂正前発明4) 痛みが炎症性疼痛,神経障害による痛み,癌による痛み,術後疼痛,幻想肢痛,火傷痛,痛風の痛み,骨関節炎の痛み,三叉神経痛の痛み,急性ヘルペスおよびヘルペス後の痛み,カウザルギーの痛み,特発性の痛み,または線維筋痛症である請求項1記載の鎮痛剤。 | (訂正後の本件発明4) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する,炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における鎮痛剤。 | 可 (確定) |
表1を見てほしい。本事件のポイントは、
- 全ての「痛み」に関する本件発明1及び2に係る特許が、サポート要件を満たすか否か
- 被告医薬品の効能・効果である「神経障害性疼痛・線維筋痛症に伴う疼痛」を充足させるために原告が主張した、本件発明1及び2を「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定する本件訂正の再抗弁が認められるか否か
- 被告医薬品の効能・効果である「神経障害性疼痛・線維筋痛症に伴う疼痛」が、本件発明3及び4の「炎症性疼痛」又は「術後疼痛」という構成要件を充足するか否か
である。
上述のとおり本件特許の無効審決は取消訴訟が提起され、本件発明1及び2の無効が確定していたわけではなく、訂正により有効と判断された本件発明3及び4の属否判断がされたわけでもなかったが、厚生労働省は、この特許庁での一部無効審決を以って、パテントリンケージを働かせることなく、2020年8月17日、リリカ®の後発医薬品(被告医薬品含む22社80品目!)を初承認し、同年12月11日には各後発医薬品メーカーが一斉に後発医薬品を販売するに至った。
厚生労働省がジェネリックを承認した同日、ファイザーは、
「特許庁が2020年7月14日に審決したリリカ用途特許の特許無効審判にて訂正を認めた特許請求項が、リリカが製造販売承認を取得している神経障害性疼痛および線維筋痛症に伴う疼痛の適応症を対象としているため、特許満了前のジェネリック医薬品の承認とそれに続く販売は特許権の侵害にあたると考えています。」
との声明とともに、複数の後発医薬品メーカーを相手取り、東京地裁に特許権侵害訴訟を提起するとともに仮処分命令の申し立てを行ったと発表した(2020.08.17 ファイザー press release: 「リリカ®」に関する特許権侵害訴訟および仮処分命令の申し立てについて)。
この記事で紹介する判決は、その複数の後発医薬品メーカーに対して提起された特許権侵害訴訟のうちのひとつ、東和薬品を被告とするものである(東京地裁令和2年(ワ)19929)。
2.争点
(1)本件特許1,2の無効理由(争点1)
ア 本件特許1,2には,実施可能要件違反の無効理由(以下「無効理由1」という。)があるか(争点1-1)
イ 本件特許1,2には,サポート要件違反の無効理由(以下「無効理由2」という。)があるか(争点1-2)
(2)本件訂正発明1,2に係る訂正の再抗弁について(争点2)
ア 技術的範囲について(争点2-1)
(ア) 被告医薬品は,「痛覚過敏又は接触異痛の痛みの処置における」(構成要件1B)鎮痛剤といえるか(争点2-1-1)
(イ) 被告医薬品は,「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における」(構成要件2B)鎮痛剤といえるか(争点2-1-2)
イ 本件訂正と新規事項追加(争点2-2)
(ア) 対象となる痛みを「痛覚過敏又は接触異痛の痛み」(構成要件1B)とすることは新規事項の追加ではないか(争点2-2-1)
(イ) 対象となる痛みを「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」(構成要件2B)とすることは新規事項の追加ではないか(争点2-2-2)
ウ 無効理由の解消(2-3)
(ア) 本件訂正により,無効理由1が解消するか(争点2-3-1)
(イ) 本件訂正により,無効理由2が解消するか(争点2―3-2)
(3)本件特許1,2の延長登録には無効理由があるか(争点3)
(4)被告医薬品が本件発明3,4の技術的範囲に属するか(争点4)
ア 被告医薬品は,「炎症を原因とする痛み,又は手術を原因とする痛みの処置における」(構成要件3B)鎮痛剤といえるか(争点4-1)
イ 被告医薬品は,「炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における」(構成要件4B)鎮痛剤といえるか(争点4-2)
(5)被告医薬品は,本件発明3に係る特許請求の範囲に記載された構成と均等なものといえるか(争点5)
(6)被告医薬品は,本件発明4に係る特許請求の範囲に記載された構成と均等なものといえるか(争点6)
(7)本件特許3,4の延長登録には無効理由があるか(争点7)
※赤字は裁判所が判断した争点。
3.裁判所の判断
裁判所(東京地裁・民事第46部)は、
- 全ての「痛み」に関する本件発明1及び2に係る特許は、サポート要件違反により無効である
- 本件発明1及び2を「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定する本件訂正は、新規事項の追加に当たるから、訂正要件を満たさず、訂正の再抗弁は認められない
- 「炎症性疼痛又は術後疼痛」に関する本件発明3及び4について、被告医薬品はその特許発明の技術的範囲に属しない(文言侵害も均等侵害も成立しない)
から、延長登録された本件特許権の効力が被告医薬品の製造等に及ぶか等、その他の争点について判断するまでもなく、原告の被告に対する本件各発明に基づく被告医薬品の販売等の差止請求並びに被告医薬品の廃棄請求はいずれも理由がないとして、これを棄却する判決をした。
以下に、裁判所(東京地裁・民事第46部)の判断を一部抜粋する。
(1)本件特許1及び2には、サポート要件違反の無効理由があるか(争点1-2)について
「構成要件1B’は,「痛みの処置における」鎮痛剤と規定されており,その文言上,対象とする痛みを限定していない。本件発明2も,本件発明1を引用した上で,「鎮痛剤」と規定するのみで,対象とする痛みの種類を限定していない。
本件明細書には,発明の概要において,「本発明は,以下の式Ⅰの化合物の,痛みの処置とくに慢性の疼痛性障害の処置における使用方法である。」と記載し,続いて,「このような障害にはそれらに限定されるものではないが」と記載した上で「炎症性疼痛,術後疼痛,転移癌に伴う骨関節炎の痛み,三叉神経痛,急性庖疹性および治療後神経痛,糖尿病性神経障害,カウザルギー,上腕神経叢捻除,後頭部神経痛,反射交感神経ジストロフィー,線維筋痛症,痛風,幻想肢痛,火傷痛ならびに他の形態の神経痛,神経障害および特発性疼痛症候群が包含される。」として,種々の痛みを列挙している。
これらの記載からすると,本件発明1,2が対象とする「痛み」には,種類の限定がなく,少なくとも,本件明細書に包含するとして記載された上記の各種の痛みを含むと認められる。
本件発明1,2が,本件明細書の発明の詳細に記載された発明であるといえるか検討すると,特許請求の範囲の記載が,明細書のサポート要件に適合するか否かは,特許請求の範囲の記載と発明の詳細な説明の記載とを対比し,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か,また,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきものである。
本件発明1,2は,前記・・・で認定した痛みに対し,従前知られていた化合物が,一定の痛みの処置に対する鎮痛剤として使用することができることを見出した医薬の用途発明であると認められ,その課題を解決できると認識するためには当業者が当該化合物の当該痛みに対する有効性を認識できる必要がある。
本件出願日において,前記・・・のとおり,痛みには様々な種類があること,痛みの種類により痛みの発生する機序が異なることが知られていた。そして,本件明細書において,本件発明1,2で規定されている化合物に属する化合物の痛みに対する有効性を確認した試験は,本件3試験のみであり,他に,その化合物について,本件明細書に包含するとして記載された各種の痛みに効果があることを裏付ける記載はない。そして,本件3試験でされたホルマリン試験,カラゲニン試験,術後疼痛試験について,前記2 ~⑽のとおりのことが知られていたが,このことを考慮しても,痛みには様々な種類がある状況で,本件3試験において効果が示された場合に,本件明細書で示された各種の痛みについて効果があったと認識することができたと認めることはできないし,また,上記を認識することができたとする技術常識があったことを認めるに足りる証拠もない。
・・・
本件発明1,2は発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるともいえず,また,当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるともいえない。よって,本件発明1,2は本件明細書の発明の詳細に記載された発明であるとはいえないから(平成14年法律第24号による改正前の特許法36条6項1号),本件発明1,2に係る特許には特許無効審判により無効とされるべき事情があると認められる。」
(2)本件訂正と新規事項追加(争点2-2)について
ア 本件訂正発明2について(対象となる痛みを「神経障害又は線維筋痛症による、痛覚過敏又は接触異痛の痛み」とすることは新規事項の追加でないか(争点2-2-2)について)
「本件訂正発明2は,「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」を対象とする鎮痛剤である。
ここで,「神経障害」という文言や神経障害性疼痛についての当時の技術常識や,「神経障害・・による,・・・痛み」という文言から,「神経障害・・による,痛覚過敏又は接触異痛の痛み」とは,神経障害性疼痛に分類される痛覚過敏及び接触異痛を意味するものと解される。
そうすると,本件訂正発明2は,神経障害性疼痛に分類される痛覚過敏又は接触異痛,並びに,線維筋痛症を原因とする痛覚過敏又は接触異痛に係るものであると認められる。
本件訂正発明2が,本件明細書に記載した事項の範囲内(特許法134条の2第9項,126条5項)といえるか検討すると,本件明細書で本件訂正発明2が規定する化合物に当たる化合物が効果を奏するものであることを具体的に基礎付けているのは,本件3試験のみである。
・・・
当業者は,本件出願日当時,技術常識を参酌しても,本件3試験の結果から,本件訂正発明2の化合物があらゆる類型の神経障害性疼痛に分類される痛覚過敏及び接触異痛,線維筋痛症による痛覚過敏及び接触異痛に有効であることが記載されていると理解することはできないし,他に本件明細書にこのことを基礎付ける実験結果等の具体的な根拠が記載されているともいえない。
そうすると,本件明細書に,本件訂正発明2の化合物があらゆる神経障害性疼痛に当たる痛覚過敏及び接触異痛,並びに,線維筋痛症による痛覚過敏及び接触異痛に効果があることが記載されているとはいえないし,それが記載されているに等しいともいえない。本件訂正が,対象となる痛みを「痛覚過敏又は接触異痛の痛み」(構成要件2B)とすることは,本件明細書,特許請求の範囲に記載した事項の全ての記載を総合しても導き出すことができない技術的事項を含むものに訂正することになるから,本件明細書に記載した事項との関係において新たな技術的事項を導入するものであり,本件明細書に記載した事項の範囲内においてする訂正であるということはできない(特許法134条の2第9項,126条5項)。
よって,本件訂正は,新規事項を追加するものであり,訂正要件を満たさず,本件訂正発明2に係る訂正の再抗弁は認められない。」
イ 本件訂正発明1について(対象となる痛みを「痛覚過敏又は接触異痛の痛み」とすることは新規事項の追加ではないか(争点2-2-1)について)
「本件訂正発明1は,「痛覚過敏又は接触異痛の痛み」を対象とする鎮痛剤である。その文言上,その技術的範囲には,本件訂正発明2の「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」を対象とする鎮痛剤を含むことは明らかである。本件明細書にもこの解釈と矛盾する記載はないから,本件訂正発明1の技術的範囲には本件訂正発明2の技術的範囲が含まれると解される。そして,前記・・・で説示したとおり,本件明細書に本件訂正発明2の化合物があらゆる神経障害性疼痛に当たる痛覚過敏及び接触異痛,並びに,線維筋痛症による痛覚過敏及び接触異痛に効果があることが記載されていると理解することはできず,他に本件明細書にこのことを基礎付ける実験結果等の具体的な根拠が記載されているともいえない。このことに,本件訂正発明1の技術的範囲には本件訂正発明2の技術的範囲が含まれると解されることを考慮すると,本件明細書に,本件訂正発明1の化合物があらゆる痛覚過敏及び接触異痛に効果があることが記載されているとはいえないし,それが記載されているに等しいともいえない。
そうすると,本件訂正が,対象となる痛みを「痛覚過敏又は接触異痛の痛み」(構成要件1B)とすることは,本件明細書,特許請求の範囲又は図面に記載した全ての記載を総合しても導き出すことができない技術的事項を含むものに訂正することになるから,本件明細書に記載した事項との関係において新たな技術的事項を導入するものであり,本件明細書に記載した事項の範囲内においてする訂正であるということはできない(特許法134条の2第9項,126条5項)。
よって,本件訂正は,新規事項を追加するものであり,訂正要件を満たさず,本件訂正発明1に係る訂正の再抗弁は認められない。」
(3)被告医薬品が本件発明3及び4の技術的範囲に属するか(争点4)について
ア 被告医薬品は、「炎症を原因とする痛み、又は手術を原因とする痛みの処置における」鎮痛剤といえるか(争点4-1)について
「本件発明3は,「炎症を原因とする痛み,又は手術を原因とする痛み」(構成要件3B)を対象とする鎮痛剤である。特許請求の範囲の文言上,前者は「炎症」が原因で生じた痛みであり,後者は「手術」が原因で生じた痛みであると認められる。
・・・
本件出願日当時,炎症によって内因性発痛物質等が侵害受容器を刺激して痛みをもたらすことが知られていたのであるから,この「炎症」が原因で生じた痛みとは,上記の炎症が直接的な原因となっている侵害受容性疼痛をいうものであると自然に理解することができるものである。
また,本件カラゲニン試験では,試験化合物が「炎症性疼痛」に対して有効であるとされているところ,「炎症性疼痛」は,文言から,炎症を原因とする痛みであると理解されるものであり,上記技術常識や,本件明細書の上記記載からも,本件明細書に記載された痛みは,炎症を直接の原因とする痛みである侵害受容性疼痛であると自然に理解することができるものである。そして,本件明細書には,上記のような自然な理解とは異なる理解がされるべきであることについて,明示の記載もないし,それを示唆する記載があるともいえない。
・・・
当業者は,本件明細書により本件試験化合物が本件カラゲニン試験において有効であったことは理解できるものの,この結果のみからは,本件試験化合物が神経細胞の機能的変化を緩和したのか,抗炎症作用により効果を奏したのか,これら以外の作用機序で効果を奏したのかを判断することはできない。よって,仮に,本件明細書に接した当業者が,本件発明3の炎症と因果関係のある痛みとして,少なくとも上記2種類の痛みがあると想定するとしても,本件カラゲニン試験の結果をもって,本件発明3の痛みが,神経細胞の機能的変化に由来する痛みを意味するものと理解するとはいえない。
以上によれば,本件発明3の「炎症を原因とする痛み」は,炎症を直接の原因とする痛みである侵害受容性疼痛の痛みであると解するのが相当である。
・・・
「手術を原因とする痛み」の文言や本件明細書の記載,技術常識等,同じ請求項に記載された発明の内容等からすると,「手術を原因とする痛み」は,侵害受容性疼痛に分類される痛みを対象にしていると自然に解されるものであり,上記に述べたところに照らし,それと異なる理解をする理由はない。
したがって,本件発明3の「手術を原因とする痛み」は,侵害受容性疼痛に分類される,手術によって生ずる痛みを意味していると解するのが相当である。
・・・
被告医薬品は,効果又は効能を「神経障害性疼痛,線維筋痛症に伴う疼痛」とする医薬品である。
・・・
従前から,侵害受容性疼痛と神経障害性疼痛とは機序の異なる別種の痛みであることを前提として分類されており・・・,現在においても同様であると認められる。そして,前記・・・のとおり,本件発明3の技術的範囲は侵害受容性疼痛に分類される痛みに限定されるのであるから,神経障害性疼痛はこれに含まれない。また,線維筋痛症は,少なくとも侵害受容性5 疼痛ではないとされている。
よって,被告医薬品が本件発明3の技術的範囲に属するとはいえない。」
イ 被告医薬品は、「炎症性疼痛による痛覚過敏の痛み、又は術後疼痛による痛覚過敏若しくは接触異痛の処置における」鎮痛剤といえるか(争点4-2)について
「前記・・・で説示したとおり,侵害受容性疼痛と神経障害性疼痛は機序の異なる別種の痛みであると理解されている。本件発明4の技術的範囲は,侵害受容性疼痛に分類される痛みに限定されるのであるから,神経障害性疼痛はこれに含まれないといえる。また,線維筋痛症は,少なくとも侵害受容疼痛ではないとされている。
よって,被告医薬品が本件発明4の技術的範囲に属するとはいえない。」
(4)被告医薬品は、本件発明3及び4に係る特許請求の範囲に記載された構成と均等なものといえるか(争点5及び6)について
「本件発明3の技術的範囲は,侵害受容性疼痛に限られる。そして,侵害受容性疼痛と神経障害性疼痛及び線維筋痛症による痛みは,機序の異なる別種の痛みとして理解されていたと認められる。そうすると,神経障害性疼痛及び線維筋痛症を対象とする被告医薬品と本件発明3とは本質的部分において異なるというべきである。よって,その余の点について検討するまでもなく,被告医薬品は,本件発明3に係る特許請求の範囲に記載された構成と均等とはいえない。
・・・
本件発明4の技術的範囲は,侵害受容性疼痛に限られる。そうすると,前記・・・で説示したのと同様の理由により被告医薬品は,本件発明4に係る特許請求の範囲に記載された構成と均等とはいえない。」
4.コメント
(1)明細書記載の訂正事項に「効果を奏すること」の記載を求めることは妥当か
東京地裁・民事第46部は、他の知的財産権部(29部、40部、47部)と同様に、「痛み」に関する本件発明を「神経障害や線維筋痛症による痛覚過敏や接触異痛の痛み」に特定する本件訂正について、本件明細書には「痛み」に「神経障害」及び「線維筋痛症」が含まれる旨の記載があるが、当該痛みに「効果を奏すること」の記載がないから、新規事項の追加に当たるとして、訂正要件を具備せず、訂正の再抗弁を認めなかった(上記「裁判所の判断」の抜粋において、赤アンダーラインを付した箇所参照)。
訂正事項が明細書に具体的に記載されていたとしても、その技術的事項の効果を理解することができなければ、すなわち、本件の場合、医薬用途発明として効果を有することの裏付けになるような記載がなければ、新たな技術的事項を導入するものであり、新規事項の追加に当たると判断したことになる。
このように、明細書に具体的に記載されている事項を訂正事項とする場合において、その訂正事項に係る技術的事項に実施可能要件と同様なハードルを設けて訂正の可否を判断した本判決の論理は、知財高裁平成20年5月30日特別部判決だけでなく、それ以降の裁判例でも採用されたことのある論理なのか不明だが、少なくとも、本件判決(及び関連判決)以外、医薬系判決では見たことがない(参考: 訂正・補正が争点となった判決記事)。
2010.01.20 「三和酒類・大麦発酵研究所 v. 特許庁長官」 知財高裁平成21年(行ケ)10134事件において、知財高裁(第4部)は「有効性が不明であるとして,新請求項1には新規事項の追加があると主張するが,これは,記載不備や進歩性の判断における発明の効果の問題であって,新規事項の追加の有無の問題ではない」と断じている。

結局のところ、訂正後の本件発明であっても実施可能要件違反となると思われるため、裁判所の判断の結論に異論はない。
しかし、本事案のように、明細書に具体的に記載されている事項を訂正事項とする場合において、その訂正の適否に、実施可能要件と同様なハードル(効果を認識し得ること)を設けて判断した論理は妥当と思えない。
特許法134条の2第9項において準用する同法126条5項のとおり、素直に「記載した事項」には訂正を認めた上で、訂正後発明についての実施可能要件等の適否を判断することが適切ではなかろうか。訂正要件と実施可能要件はその条文も趣旨も異なるのであるから、独立に判断されるべきではないか。
そして、本件訂正後における特許請求の範囲に記載されている事項により特定される発明が独立して特許を受けることができるものでない(本件訂正は独立特許要件に違反)ということであれば、訂正後の本件発明について実施可能要件を満たすか否かをしっかり検討して、特許法134条の2第9項において準用する同法126条7項の適否として判断すればよいはずである。
沢井製薬が請求した本件特許第3693258号に対する無効審判請求事件(無効2017-800003号事件)において特許庁がした審決のうち請求項1及び2に係る部分(無効)の取消しを求めて、原告が提起した審決取消訴訟(知財高裁令和2年(行ケ)第10135号)において、知財高裁も、この東京地裁と同様の考え方に基づいて、訂正請求を認めない判断を下しており、その判断方法の考え方も東京地裁の考え方と同様に疑問である。
この問題については、いわゆる「除くクレーム 」の訂正の適否について争われた事件(知財高裁平成18年(行ケ)第10563号)において、知的財産高等裁判所特別部が判示した事項も含めて以下の記事にて言及している。

(2)東京地裁・民事第46部も他の知的財産権部と同様の判断
リリカ®の後発医薬品を販売したジェネリックメーカーに対して原告が提起した本件特許権に基づく侵害差止請求事件として、これまで東京地裁判決(民事第29部、第47部、第40部)が裁判所ホームページにより公開されていたが、東京地裁・民事第46部からの判決(本事案)もやっと公開された。
<東京地裁・民事第46部>
- 【本事案】2021.12.23 「ワーナー-ランバート v. 東和薬品」東京地裁令和2年(ワ)19929
本事案の判決言渡日と同日に、同じく民事第46部から以下の判決も言い渡されている。
- 2021.12.23 「ワーナー-ランバート v. ニプロ・全星薬品工業」東京地裁令和2年(ワ)19925/22288
結論は、民事第46部での本事案及び上記事案も含めて、これまでの東京地裁判決(民事第29部、第47部、第40部)全てが、原告の請求を棄却するものであり、実施可能要件違反及び/又はサポート要件違反、訂正の再抗弁は認めず、被告医薬品は発明の技術的範囲に属しない(文言侵害も均等侵害も成立しない)、という判断である。
<東京地裁・民事第29部>

記事でのコメント:
(1)医薬用途発明について記載要件を満たすために必要とされる明細書への記載の程度とは
(2)特許権侵害訴訟の行方

記事でのコメント:
(1)判決の内容は、小林化工を被告とした侵害訴訟判決と同じ
(2)延長特許権の効力について、武田薬品工業はだんまり
他の関連判決:
- 2022.02.02 「ワーナー-ランバート v. ダイト・科研製薬」 東京地裁令和2年(ワ)19923/22292
- 2022.02.16 「ワーナー-ランバート v. 辰巳化学・陽進堂・三笠製薬」 東京地裁令和2年(ワ)19931/22285/22289
- 2022.02.28 「ワーナー-ランバート v. サンド」 東京地裁令和2年(ワ)19919
<東京地裁・民事第47部>
記事でのコメント:
(1)医薬用途発明の実施可能要件を満たすためには明細書に「効果を有することの裏付け」の記載が必要
(2)明細書記載事項を訂正事項とする訂正可否に実施可能要件?
(3)痛みは原因で区別できず相互に重複するとの議論
(4)延長登録された特許権の効力についての議論
ア 延長された医薬用途特許権の効力は剤形違いの後発医薬品に及ぶか否か
イ 特許発明を実施することができなかった期間の始期は実施権設定登録を要するか
(5)パテントリンケージの運用が抱える問題が顕在化する可能性があった
(6)本件特許第3693258号に関連する判決
他の関連判決:
- 2021.11.30 「ワーナー-ランバート v. 共和薬品工業」 東京地裁令和2年(ワ)19926
- 2021.11.30 「ワーナー-ランバート v. 沢井製薬」 東京地裁令和2年(ワ)19917
- 2021.11.30 「ワーナー-ランバート v. 大原薬品工業・キョーリンリメディオ・杏林製薬・共創未来ファーマ・三和化学研究所」 東京地裁令和2年(ワ)19922/22286/22287
<東京地裁・民事第40部>

記事でのコメント:
(1)医薬用途発明の実施可能要件を満たすためには明細書に「効果を有することの裏付け」の記載が必要
(2)明細書記載事項を訂正事項とする訂正可否に実施可能要件
(3)他のジェネリックメーカーに対する本件特許権に基づく侵害差止請求事件
(4)特許一部無効審決取消訴訟の行方
他の関連判決:
- 2021.11.24 「ワーナー-ランバート v. 日本ジェネリック」 東京地裁令和2年(ワ)19928
- 2021.12.24 「ワーナー-ランバート v. 日医工」 東京地裁令和2年(ワ)19924
- 2022.01.19 「ワーナー-ランバート v. フェルゼンファーマ」 東京地裁令和2年(ワ)19932
- 2022.01.19 「ワーナー-ランバート v. 日本ケミファ・日本薬品工業」 東京地裁令和2年(ワ)19920/22284
(3)訴訟の行方
沢井製薬が請求した特許無効審判事件(無効2017-800003号事件)において特許庁がした審決のうち請求項1及び2に係る部分(無効)の取消しを求めて、原告が提起した審決取消訴訟(知財高裁令和2年(行ケ)第10135号)において、知財高裁は、2022年3月7日、
- 「痛み」に関する本件発明を「神経障害や線維筋痛症による痛覚過敏や接触異痛の痛み」に特定する本件訂正について、本件明細書には「痛み」に当該痛みが含まれる旨の記載があるが、当該痛みに「効果を奏すること」の記載がないから、新規事項の追加に当たる
- 前記訂正が認められない結果、あらゆる「痛み」を包含する本件発明については実施可能要件及びサポート要件各違反がある
との判断をした本件審決に誤りはないとして、原告の請求を棄却する判決をした。
参考:

知財高裁が、上記のとおり、訂正を認めず、請求項1及び2に係る部分を無効とする判断を下したことから、特許権侵害訴訟における東京地裁判決に対して仮に原告が控訴をしたとしても、請求項1及び2に係る部分について、知財高裁の判断は原告にとって厳しいものとなることが予想される。


コメント
【追記】以下の判決が公開されたので本文に追記しました。東京地裁民事第47部判決。いずれも原告の請求を棄却。
【参考情報】
Warner-Lambert Company LLC (Appellant) v Generics (UK) Ltd t/a Mylan and another (Respondents)
Judgment date: 14 Nov 2018
Neutral citation number: [2018] UKSC 56
On appeal from [2016] EWCA Civ 1006
Case ID: UKSC 2016/0197
https://www.supremecourt.uk/cases/uksc-2016-0197.html
Press summary:
This appeal concerns a second European Patent No EP(UK) 0934061 entitled “Isobutylgaba and its derivatives for the treatment of pain”, with a priority date of 24 July 1996 (“the Patent”). The claims of the Patent (which define the scope of the patent protection) are all purposelimited. Most relevant are Claims 1-3 on the use of pregabalin for treating (1) pain, (2) inflammatory pain and (3) neuropathic pain. Lyrica has marketing authorisation in the EU for treatment of peripheral and central neuropathic pain, epilepsy and generalised anxiety disorder. It is one of Pfizer’s most successful drugs in the UK.
Issue (ii) – Sufficiency of disclosure in specification for Claims 1 and 3:
“The court holds, by a majority (Lord Sumption, Lord Reed and Lord Briggs), that the disclosure in the specification supports the claims in relation to inflammatory pain, but not neuropathic pain, whether peripheral or central. Claims 1 and 3 therefore fail for insufficiency. Thus, the appeal is dismissed and the cross-appeal allowed [15(2), 43-54].
The majority’s approach requires the patentee to demonstrate that the specification discloses some scientific reason why the implied assertion of efficacy in the patent claim may well be true [36-37]. More than a bare assertion or mere possibility of therapeutic efficiency is required, though a priori reasoning (not necessarily only experimental data) may suffice [37]. This respects the principle that the patentee cannot claim a monopoly of new use for an existing compound without real disclosure [35]. “