Summary
効能・効果を「神経障害性疼痛・線維筋痛症に伴う疼痛」とする先発医薬品リリカ®の医薬用途特許を保有する原告(ワーナー-ランバート)とその後発医薬品を製造等する被告ら(武田テバファーマ及び武田薬品工業)との間で争われていた、延長登録された特許権の侵害差止請求事件。
東京地裁は、
- 「痛み」に関する本件発明1及び2については、実施可能要件違反及びサポート要件違反により無効である
- 本件発明2に「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」を付加する訂正の再抗弁については、新規事項の追加に当たるから認められない
- 「炎症性疼痛又は術後疼痛」に関する本件発明3及び4については、文言上も均等(第1及び5要件)としても被告医薬品がその特許発明の技術的範囲に属しない
から、延長登録された本件特許権の効力が被告医薬品の製造等に及ぶかについて判断するまでもなく、原告の請求を棄却した。
1.事件の背景
本件(東京地裁令和2年(ワ)22290/26770)は、発明の名称を「イソブチルGABAまたはその誘導体を含有する鎮痛剤」とする特許第3693258号を保有する原告(ワーナー-ランバート)が、被告ら(武田テバファーマ及び武田薬品工業)が承認を受けた後発医薬品「プレガバリンOD錠25mg「武田テバ」」等(被告医薬品)が本件特許発明の技術的範囲に属し、被告らによる被告医薬品の製造等が本件特許発明の実施に当たると主張して、被告医薬品の製造等の差止め及び廃棄を求めた事案である。
先発医薬品はリリカ®(カプセル・OD錠)。プレガバリンを有効成分とし、「神経障害性疼痛・線維筋痛症に伴う疼痛」を効能・効果とする。本件特許権に係る専用実施権者であるファイザーが販売し、2019年度には国内売上が1000億円を超える大型製品となっていた(2021年9月にファイザーからヴィアトリス製薬へ製造販売移管)。
後発医薬品メーカーは、リリカ®の再審査期間終了(2018年4月15日)後にリリカ®の後発医薬品の薬事承認申請をすることができるが、リリカ®を保護する本件特許(効能・効果を保護する医薬用途特許)の問題を回避できなければ、その後発医薬品の承認を取得し販売することはできない。
本件特許は、実は20年の存続期間満了日が2017年7月16日であったところ、特許存続期間の延長が登録され、最長満了日は2022年7月16日となっており、その延長された特許権がリリカ®の後発医薬品参入に対抗する最後の砦となっていた。
このように後発医薬品の参入障壁となっていた本件特許に対して、2017年1月16日、後発医薬品メーカーである沢井製薬は、とうとう特許無効審判を請求した(無効2017-800003号事件)。
参考記事:
審判には、他の後発医薬品メーカーも次々と沢井製薬側への参加を表明。後発医薬品メーカーは以下の15社に上った。
日新製薬株式会社、サンド株式会社、日本ケミファ株式会社、テバ・ホールディングス株式会社、大原薬品工業株式会社、ダイト株式会社、日医工株式会社、ニプロ株式会社、共和薬品工業株式会社、小林化工株式会社、日本ジェネリック株式会社、東和薬品株式会社、Me ファルマ株式会社、辰巳化学株式会社、株式会社フェルゼンファーマ
そして、2020年7月14日、特許庁が下した審決の内容は、「請求項1及び2に係る本件訂正を認めず、請求項1及び2に係る発明についての本件特許を無効とし、他方、請求項3及び4に係る本件訂正を認め、請求項3及び4に係る発明についての審判の請求は成り立たない」というものであった(以下「本件審決」という。)。
参考記事:
この審決に対して、特許権者(原告)は、本件審決のうち請求項1及び2に係る部分(無効)の取消しを求める審決取消訴訟(知財高裁令和2年(行ケ)第10135号)を提起している。なお、本件審決のうち請求項3及び4に係る部分(無効請求不成立)は確定したので、本件特許の請求項3及び4は以下の表1のとおりに訂正された。
| 請求項 | 訂正前 | 訂正後 | 審決での訂正可否判断 |
|---|---|---|---|
| 1 | (本件発明1) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する痛みの処置における鎮痛剤。 | (本件訂正後発明1) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤。 | 否 |
| 2 | (本件発明2) 化合物が,式IにおいてR3およびR2はいずれも水素であり,R1は-(CH2)0-2-iC4H9である化合物の(R),(S),または(R,S)異性体である請求項1記載の鎮痛剤。 | (本件訂正後発明2) 式I (省略)(式中,R3およびR2はいずれも水素であり,R1は-(CH2)0-2-iC4H9である)の化合物の(R),(S),または(R,S)異性体を含有する,神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤。 | 否 |
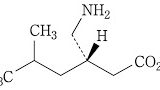
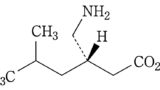
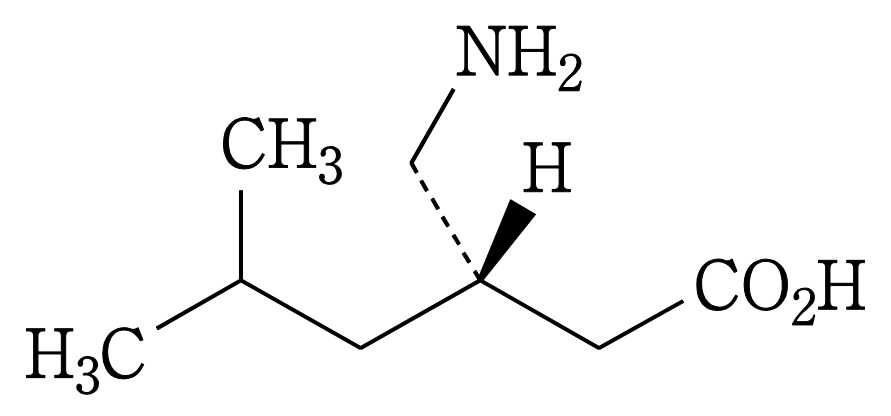
| 3 | (本件訂正前発明3) 化合物が,(S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸である請求項1記載の鎮痛剤。 | (本件発明3) (S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸を含有する,炎症を原因とする痛み,又は手術を原因とする痛みの処置における鎮痛剤。 | 可 (確定) |
| 4 | (本件訂正前発明4) 痛みが炎症性疼痛,神経障害による痛み,癌による痛み,術後疼痛,幻想肢痛,火傷痛,痛風の痛み,骨関節炎の痛み,三叉神経痛の痛み,急性ヘルペスおよびヘルペス後の痛み,カウザルギーの痛み,特発性の痛み,または線維筋痛症である請求項1記載の鎮痛剤。 | (本件発明4) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する,炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における鎮痛剤。 | 可 (確定) |
表1を見てほしい。本事件のポイントは、リリカ®の後発医薬品(被告医薬品)の効能・効果である「神経障害性疼痛・線維筋痛症に伴う疼痛」が、各請求項の「炎症性疼痛」又は「術後疼痛」という構成要件を充足するかどうかである。
上述のとおり本件特許の無効審決は取消訴訟係属中であり、請求項1及び2の無効が確定したわけではなく、訂正により有効と判断された請求項3及び4の属否判断がされたわけでもなかったが、厚生労働省は、この特許庁での一部無効審決を以って、パテントリンケージを働かせることなく、2020年8月17日、リリカ®の後発医薬品(被告医薬品含む22社80品目!)を初承認し、同年12月11日には各後発医薬品メーカーが一斉に後発医薬品を販売するに至った。
厚生労働省がジェネリックを承認した同日、ファイザーは、
「特許庁が2020年7月14日に審決したリリカ用途特許の特許無効審判にて訂正を認めた特許請求項が、リリカが製造販売承認を取得している神経障害性疼痛および線維筋痛症に伴う疼痛の適応症を対象としているため、特許満了前のジェネリック医薬品の承認とそれに続く販売は特許権の侵害にあたると考えています。」
との声明とともに、複数の後発医薬品メーカーを相手取り、東京地裁に特許権侵害訴訟を提起するとともに仮処分命令の申し立てを行ったと発表した(2020.08.17 ファイザー press release: 「リリカ®」に関する特許権侵害訴訟および仮処分命令の申し立てについて)。
この記事で紹介する判決は、その複数の後発医薬品メーカーに対して提起された特許権侵害訴訟のうちのひとつ、武田テバファーマと武田薬品工業を被告とするものである(東京地裁令和2年(ワ)22290/26770)。
2.争点
(1) 本件発明1及び2について
ア 被告医薬品が本件発明1及び2の技術的範囲に属するか(争点1-1)
イ 無効の抗弁
(ア) 実施可能要件違反の成否(争点1-2)
(イ) サポート要件違反の成否(争点1-3)
ウ 訂正の再抗弁
(ア) 本件訂正が訂正要件を満たすか(争点1-4)
(イ) 本件訂正により無効理由が解消されるか(争点1-5)
(ウ) 被告医薬品が本件訂正発明1及び2の技術的範囲に属するか(争点1-6)
エ 延長登録された本件発明1及び2に係る本件特許権の効力が被告医薬品の製造等に及ぶか(争点1-7)
(2) 本件発明3及び4について
ア 被告医薬品が本件発明3及び4の技術的範囲に属するか
(ア) 文言侵害の成否(争点2-1)
(イ) 均等侵害の成否(争点2-2)
イ 延長登録された本件発明3及び4に係る本件特許権の効力が被告医薬品の製造等に及ぶか(争点2-3)
3.裁判所の判断
裁判所は、
- 本件発明1及び2については、実施可能要件違反及びサポート要件違反が認められるから、無効の抗弁は理由があり、
- 請求項1及び請求項2に係る本件訂正は訂正要件に違反するものであるから、訂正の再抗弁は理由がないこと、
- 本件発明3及び4については、被告医薬品は各技術範囲に属するとは認められないこと
から、延長登録された本件特許権の効力が被告医薬品の製造等に及ぶかについて判断するまでもなく、原告の被告に対する本件各発明に基づく被告医薬品の製造、販売及び販売の申出の差止請求並びに被告医薬品の廃棄請求はいずれも理由がないとしてこれを棄却する判決をした。
判決の内容は以下の記事で取り上げた判決の内容とほぼ同じであり、結論も同じである。
参照:

(1)本件発明1及び2についての無効の抗弁
ア 実施可能要件違反の成否(争点1-2)
裁判所は、
「いわゆる医薬用途発明・・・において実施可能要件を満たすためには,明細書の発明の詳細な説明に,薬理データの記載又はこれと同視し得る程度の記載をすることなどにより,当該用途の有用性及びそのための当該医薬の有効量を裏付ける記載を要するものと解するのが相当である。
と述べ、本件発明1及び2について実施可能要件を満たすというためには、
「本件明細書の発明の詳細な説明に,薬理データの記載又はこれと同視し得る程度の記載をすることなどにより,上記各痛みに対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載が必要であるというべきである。」
として、
「本件明細書の発明の詳細な説明においては,ホルマリン試験,カラゲニン試験及び術後疼痛試験の各薬理データの記載により,本件化合物が侵害受容性疼痛に分類される痛みに対して鎮痛効果があること及びそのための当該医薬の有効量は裏付けられているといえる。しかし,本件発明1及び2がその内容とする「痛み」,すなわち,少なくとも「炎症性疼痛,術後疼痛,・・・ならびに他の形態の神経痛,神経障害および特発性疼痛症候群」・・・の各痛みに対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載はない。したがって,本件発明1及び2は,実施可能要件に違反するものと認められる。」
と判断した。
イ サポート要件違反の成否(争点1-3)
裁判所は、
「特許請求の範囲の記載が明細書のサポート要件(法36条6項1号)に適合するか否かは,特許請求の範囲の記載と発明の詳細な説明の記載とを対比し,特許請求の範囲に記載された発明が,発明の詳細な説明に記載された発明で,発明の詳細な説明の記載により当業者が当該発明の課題を解決できると認識できる範囲のものであるか否か,また,その記載や示唆がなくとも当業者が出願時の技術常識に照らし当該発明の課題を解決できると認識できる範囲のものであるか否かを検討して判断すべきものである。」
と述べ、本件発明1及び2について、
「本件明細書の発明の詳細な説明の記載は,当業者が,本件発明1及び2の上記課題の解決,すなわち少なくとも上記各痛みの全てに対して鎮痛効果を有することを認識できる範囲のものとはいえず,また,当業者が本件出願当時の技術常識に照らして上記各痛みに対して鎮痛効果を有することを認識できる範囲のものともいえないから,本件発明1及び2は,サポート要件に違反すると認められる。」
と判断した。
(2)本件発明1及び2についての訂正の再抗弁
裁判所は、原告の主張する訂正の抗弁について、請求項2に係る本件訂正のうち、「鎮痛剤」を「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤」と訂正する点については、形式上は、特許請求の範囲を減縮するものといえる、としながらも、
「本件明細書の発明の詳細な説明には,本件化合物について,侵害受容性疼痛に対して鎮痛効果があること及びそのための当該医薬の有効量を裏付ける記載があるものの,その他の痛みに対して鎮痛効果があることなどを裏付ける記載があるとはいえない。そして,・・・「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」とは,侵害受容性疼痛ではなく,神経障害性疼痛又は心因性疼痛に分類されるものである。したがって,上記訂正は,神経障害性疼痛又は心因性疼痛の処置における鎮痛剤という新規事項を追加するものであって,本件明細書に記載した事項の範囲内においてされたものではないので,訂正要件を満たすとは認められない(法134条の2第9項,126条5項)。
・・・請求項2に係る本件訂正は認められないから,請求項1と請求項2は依然として一群の請求項を構成していることになり,請求項1に係る本件訂正も認められない(法134条の2第3項)。 」
と判断した。
(3)本件発明3及び4について被告医薬品が本件発明3及び4の技術的範囲に属するか
裁判所は、被告医薬品は、効能・効果を「神経障害性疼痛及び線維筋痛症に伴う疼痛」とする疼痛治療剤であり、本件発明3及び4の「炎症を原因とする痛み」及び「手術を原因とする痛み」又は「炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における」とする構成を充足せず、また、均等なものとも認められないから、技術的範囲に属するとは認められず、被告医薬品が本件特許権を侵害するとは認められないと判断した。
4.コメント
(1)判決の内容は、小林化工を被告とした侵害訴訟判決と同じ
判決の内容は以下の記事で取り上げた小林化工を被告とする特許権侵害差止請求事件判決とほぼ同じであり、結論も同じである。コメントは、以下の記事を参照。
参照: 2021.12.24 「ワーナー-ランバート v. 小林化工」 東京地裁令和2年(ワ)19927・・・疼痛治療剤リリカ®(プレガバリン)のジェネリック、医薬用途に係る特許権は非侵害と判断
- 医薬用途発明について記載要件を満たすために必要とされる明細書への記載の程度とは
- 特許権侵害訴訟の行方

特許権者(原告)は、本件特許の無効審判請求事件(無効2017-800003号)において、請求項1及び2に係る本件訂正を認めず、請求項1及び2に係る発明についての本件特許を無効とした部分の取消しを求めて審決取消訴訟(知財高裁令和2年(行ケ)第10135号)を提起している。
その判決言渡し期日は、2022年3月7日の予定である。
知財高裁は、本件特許を無効とした審決を支持するのか、それとも審決を取消すのか。本記事で紹介した特許権侵害差止請求事件が東京地裁から知財高裁に上訴されたとしても、まずは特許の無効の是非についての知財高裁判決が先に明らかになる。
(2)延長特許権の効力について、武田薬品工業はだんまり
本件は、先発医薬品メーカーである武田薬品工業が後発医薬品メーカー(被告)側として特許権侵害訴訟の当事者となったという点で珍しいケースかもしれない。通常、先発医薬品メーカーとして後発医薬品メーカーを特許権侵害で訴える側である武田薬品工業だが、本件では、後発医薬品メーカー側として先発医薬品メーカーである原告に対してどのような主張を展開したのか、判決文を興味深く眺めたが、目を引く主張点はなかった。
延長登録された本件特許権の効力が被告医薬品の製造等に及ぶか(争点1-7)についても、特許権者(原告)が、
「延長登録後の特許権の効力は,当該延長登録の理由となった処分の対象物についての特許発明の実施に及ぶほか(法68条の2),その実質同一物にも及ぶ。そして,実質同一性は,製造販売承認の審査事項である「成分,分量,用法,用量,効能及び効果」に基づき判断され,剤形は考慮要素とならないところ,特許発明の内容に基づき,その内容との関連で,技術的特徴及び作用効果の同一性を比較検討して判断すべきであり,両者の差異が技術的特徴や作用効果に関わるものでなければ,実質同一性が肯定されるというべきである。
・・・処分対象物と被告医薬品は,有効成分,分量の大部分,用法,用量,効能及び効果において全く同一であり,特許の技術的特徴及び作用効果とは無関係の添加物及び分量の一部が異なるのみであるから,両者は実質同一である。
したがって,被告医薬品には,本件発明1及び2について,延長登録により存続期間が延長された本件特許権の効力が及ぶ。」
と主張したことに対して、反論の主張をしたのは、武田テバファーマであり、判決文を見る限り、武田薬品工業は被告として何ら主張をしなかったようである。
まだ論点が多く裁判例も乏しい延長された特許権の効力という争点について、武田薬品工業は、先発側としての立場を崩すわけにはいかないだろうから、この争点についてはだんまりを決め込んだのだろう。
なお、原告の「処分対象物と被告医薬品は実質同一である」との主張に対して、武田テバファーマは、
「処分対象物と被告医薬品とでは,剤形が大きく異なり,そのために有効成分以外の成分が大きく異なるから,実質同一であるとはいえない。さらに,被告医薬品は,マンニトールとともに先発医薬品が含有しないイソマルトを含有するところ,被告武田テバは,プレガバリン及びマンニトールを含む錠剤にイソマルトを添加することにより,当該錠剤中の水分の多寡にかかわらず,類縁体の生成を抑制し,当該錠剤中のプレガバリンの安定性を高める発明について,特許権を有する。したがって,処分対象物と被告医薬品との添加物の差異(イソマルトを含有するか否か)は,周知・慣用技術に基づく異なる成分の付加,転換ではなく,新規技術に基づくものであるから,処分対象物と被告医薬品とは,実質同一とはいえない。」
と主張した。



コメント