Summary
効能・効果を「神経障害性疼痛・線維筋痛症に伴う疼痛」とする先発医薬品リリカ®の医薬用途特許を保有する原告(ワーナー-ランバート)とその後発医薬品を販売等する被告ら(日新製薬・Meiji Seika ファルマ)との間で争われていた、延長登録された特許権の侵害差止請求事件。
東京地裁は、
- 全ての「痛み」に関する本件発明1及び2については、実施可能要件違反により無効である
- 本件発明1及び2を「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定する訂正の再抗弁については、新規事項の追加に当たるから認められない
- 「炎症性疼痛又は術後疼痛」に関する本件訂正発明3及び4については、被告医薬品がその発明の技術的範囲に属しない(文言侵害も均等侵害(第1要件)も成立しない)
から、延長登録された本件特許権の効力が被告医薬品の販売等に及ぶか等、その他の争点について判断するまでもなく、原告の請求を棄却した。
1.事件の背景
本件(東京地裁令和2年(ワ)19918/22291)は、発明の名称を「イソブチルGABAまたはその誘導体を含有する鎮痛剤」とする特許第3693258号を保有する原告(ワーナー-ランバート)が、被告ら(日新製薬及びMeiji Seika ファルマ)が承認を受けた後発医薬品「プレガバリンOD錠25mg「明治」」等(被告医薬品)が本件特許発明の技術的範囲に属し、被告らによる被告医薬品の販売等が本件特許発明の実施に当たると主張して、被告医薬品の販売等の差止め及び廃棄を求めた事案である。
先発医薬品はリリカ®(カプセル・OD錠)。プレガバリンを有効成分とし、「神経障害性疼痛・線維筋痛症に伴う疼痛」を効能・効果とする。本件特許権に係る専用実施権者であるファイザーが販売し、2019年度には国内売上が1000億円を超える大型製品となっていた(2021年9月にファイザーからヴィアトリス製薬へ製造販売移管)。
後発医薬品メーカーは、リリカ®の再審査期間終了(2018年4月15日)後にリリカ®の後発医薬品の薬事承認申請をすることができるが、リリカ®を保護する本件特許(効能・効果を保護する医薬用途特許)の問題を回避できなければ、その後発医薬品の承認を取得し販売することはできない。
本件特許は、実は20年の存続期間満了日が2017年7月16日であったところ、特許存続期間の延長が登録され、最長満了日は2022年7月16日となっており、その延長された特許権がリリカ®の後発医薬品参入に対抗する最後の砦となっていた。
このように後発医薬品の参入障壁となっていた本件特許に対して、2017年1月16日、後発医薬品メーカーである沢井製薬は、とうとう特許無効審判を請求した(無効2017-800003号事件)。
参考記事:
審判には、他の後発医薬品メーカーも次々と沢井製薬側への参加を表明。後発医薬品メーカーは以下の15社に上った。
日新製薬株式会社、サンド株式会社、日本ケミファ株式会社、テバ・ホールディングス株式会社、大原薬品工業株式会社、ダイト株式会社、日医工株式会社、ニプロ株式会社、共和薬品工業株式会社、小林化工株式会社、日本ジェネリック株式会社、東和薬品株式会社、Me ファルマ株式会社、辰巳化学株式会社、株式会社フェルゼンファーマ
そして、2020年7月14日、特許庁が下した審決の内容は、「請求項1及び2に係る本件訂正を認めず、請求項1及び2に係る発明についての本件特許を無効とし、他方、請求項3及び4に係る本件訂正を認め、請求項3及び4に係る発明についての審判の請求は成り立たない」というものであった(以下「本件審決」という。)。
参考記事:
この審決に対して、特許権者(原告)は、本件審決のうち請求項1及び2に係る部分(無効)の取消しを求める審決取消訴訟(知財高裁令和2年(行ケ)第10135号)を提起している(判決言渡日は2022年3月7日だが最高裁判所HPにはまだ判決がアップされていない)。なお、本件審決のうち請求項3及び4に係る部分(無効請求不成立)は確定したので、本件特許の請求項3及び4は以下の表1のとおりに訂正された。
| 請求項 | 訂正前 | 訂正後 | 審決での訂正可否判断 |
|---|---|---|---|
| 1 | (本件発明1) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する痛みの処置における鎮痛剤。 | (本件訂正後発明1) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤。 | 否 |
| 2 | (本件発明2) 化合物が,式IにおいてR3およびR2はいずれも水素であり,R1は-(CH2)0-2-iC4H9である化合物の(R),(S),または(R,S)異性体である請求項1記載の鎮痛剤。 | (本件訂正後発明2) 式I (省略)(式中,R3およびR2はいずれも水素であり,R1は-(CH2)0-2-iC4H9である)の化合物の(R),(S),または(R,S)異性体を含有する,神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛みの処置における鎮痛剤。 | 否 |
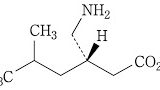
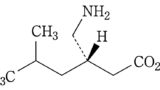
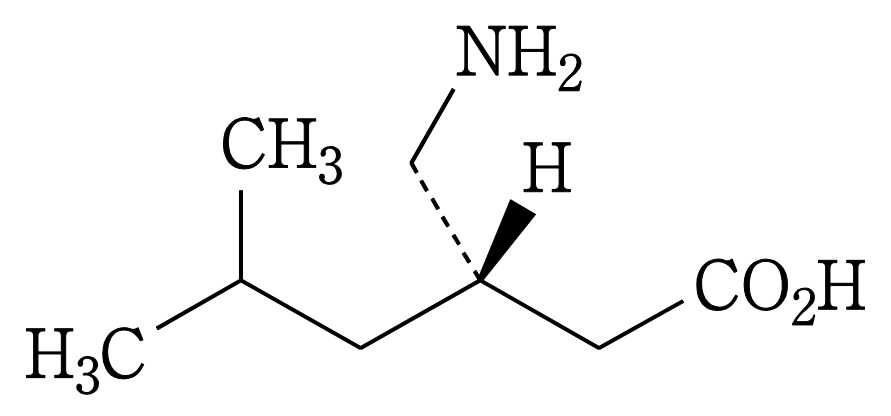
| 3 | (本件訂正前発明3) 化合物が,(S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸である請求項1記載の鎮痛剤。 | (本件訂正発明3) (S)-3-(アミノメチル)-5-メチルヘキサン酸または3-アミノメチル-5-メチルヘキサン酸を含有する,炎症を原因とする痛み,又は手術を原因とする痛みの処置における鎮痛剤。 | 可 (確定) |
| 4 | (本件訂正前発明4) 痛みが炎症性疼痛,神経障害による痛み,癌による痛み,術後疼痛,幻想肢痛,火傷痛,痛風の痛み,骨関節炎の痛み,三叉神経痛の痛み,急性ヘルペスおよびヘルペス後の痛み,カウザルギーの痛み,特発性の痛み,または線維筋痛症である請求項1記載の鎮痛剤。 | (本件訂正発明4) 式I(省略)(式中,R1は炭素原子1〜6個の直鎖状または分枝状アルキルであり,R2は水素またはメチルであり,R3は水素,メチルまたはカルボキシルである)の化合物またはその医薬的に許容される塩,ジアステレオマー,もしくはエナンチオマーを含有する,炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における鎮痛剤。 | 可 (確定) |
表1を見てほしい。本事件のポイントは、
- 全ての「痛み」に関する本件発明1及び2が、実施可能要件を満たすか否か
- 被告医薬品の効能・効果である「神経障害性疼痛・線維筋痛症に伴う疼痛」を充足させるために原告が主張した、本件発明1及び2を「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定する訂正の再抗弁が認められるか否か
- 被告医薬品の効能・効果である「神経障害性疼痛・線維筋痛症に伴う疼痛」が、本件訂正発明3及び4の「炎症性疼痛」又は「術後疼痛」という構成要件を充足するか否か
である。
上述のとおり本件特許の無効審決は取消訴訟が提起され、本件発明1及び2の無効が確定していたわけではなく、訂正により有効と判断された本件訂正発明3及び4の属否判断がされたわけでもなかったが、厚生労働省は、この特許庁での一部無効審決を以って、パテントリンケージを働かせることなく、2020年8月17日、リリカ®の後発医薬品(被告医薬品含む22社80品目!)を初承認し、同年12月11日には各後発医薬品メーカーが一斉に後発医薬品を販売するに至った。
厚生労働省がジェネリックを承認した同日、ファイザーは、
「特許庁が2020年7月14日に審決したリリカ用途特許の特許無効審判にて訂正を認めた特許請求項が、リリカが製造販売承認を取得している神経障害性疼痛および線維筋痛症に伴う疼痛の適応症を対象としているため、特許満了前のジェネリック医薬品の承認とそれに続く販売は特許権の侵害にあたると考えています。」
との声明とともに、複数の後発医薬品メーカーを相手取り、東京地裁に特許権侵害訴訟を提起するとともに仮処分命令の申し立てを行ったと発表した(2020.08.17 ファイザー press release: 「リリカ®」に関する特許権侵害訴訟および仮処分命令の申し立てについて)。
この記事で紹介する判決は、その複数の後発医薬品メーカーに対して提起された特許権侵害訴訟のうちのひとつ、日新製薬及びMeiji Seika ファルマを被告とするものである(東京地裁令和2年(ワ)19918/22291)。
2.争点
(1) 本件発明1及び2に係る特許について
ア 特許無効の抗弁:特許無効審判により無効にされるべきものか(争点1)
(ア) 無効理由1:実施可能要件違反があるか(争点1-1)
(イ) 無効理由2:サポート要件違反があるか(争点1-2)
イ 訂正の再抗弁:訂正の再抗弁の当否(争点2)
(ア) 訂正事項1及び2に係る訂正は新規事項の追加に当たるか(争点2-1)
(イ) 訂正事項1及び2に係る訂正による無効理由の解消の有無(争点2-2)
(ウ) 被告医薬品は本件訂正発明1及び2の技術的範囲に属するか(争点2-3)
(2) 本件訂正発明3及び4に係る特許について
ア 被告医薬品は本件訂正発明3及び4の技術的範囲に属するか(争点3)
(ア) 文言侵害に当たるか(争点3-1)
(イ) 均等侵害に当たるか(争点3-2)
イ 本件訂正発明3及び4に係る特許に無効理由があるか(争点4)
(3) 延長登録後の本件発明ないし本件訂正発明の効力が被告医薬品に及ぶか(争点5)
ア 本件特許は,延長登録により存続期間が延長され,その効力が被告医薬品に及ぶか(争点5-1)
イ 本件特許に係る延長登録に無効理由があるか,あるいは権利濫用に当たるか-旧特許法125条の2第1項第3号「その特許発明の実施をすることができなかつた期間」の始期は,いつか(争点5-2)
3.裁判所の判断
裁判所(東京地裁・民事第47部)は、
- 全ての「痛み」に関する本件発明1及び2は実施可能要件違反があるから、被告らの主張する無効の抗弁は理由がある
- 本件発明1及び2を「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定することは新規事項の追加に当たるから、原告の主張する訂正の再抗弁は理由がない
- 「炎症性疼痛又は術後疼痛」に関する本件訂正発明3及び4について、被告医薬品はその特許発明の技術的範囲に属しない(文言侵害も均等侵害も成立しない)
から、延長登録された本件特許権の効力が被告医薬品の製造等に及ぶか等、その他の争点について判断するまでもなく、原告の被告らに対する本件各発明に基づく被告医薬品の販売等の差止請求並びに被告医薬品の廃棄請求はいずれも理由がないとしてこれを棄却する判決をした。
原告の差止め等請求を棄却した本件判決の内容は、以下の記事で取り上げた、各被告に対する侵害差止請求事件判決(東京地裁・民事第29部)の内容と若干の違いはあるものの、結論(請求棄却)は同じである。
参照:


以下に、裁判所の判断を抜粋する。
(1)本件発明1及び2に実施可能要件違反があるか(争点1-1)
(1) 特許法36条4項は,明細書の発明の詳細な説明の記載要件について,当該記載は,その発明の属する技術の分野における通常の知識を有する者(当業者)がその実施をすることができる程度に明確かつ十分に記載したものでなければならない旨規定し,これに違反するときは,当該特許は,特許無効審判により無効にされるべきものと認められ(特許法123条1項4号),特許法104条の3第1項により,その権利を行使することができないこととなる(無効の抗弁)。そして,かかる「明確かつ十分」という特許法36条4項の要件を充足すると評価できるためには,発明の詳細な説明が,当業者において,その記載及び出願当時の技術常識に基づいて,過度の試行錯誤を要することなく,その発明を実施することができる程度に記載されていることを要すると解するのが相当である。
(2) そこで検討すると,まず,特許請求の範囲の記載文言をみるに,本件発明1は「痛みの処置における」(構成要件1B’)鎮痛剤であり,本件発明2はこれを引用している(構成要件2A’)。しかして,ここでは「痛み」の種類や原因について,文言上,何ら限定されていない。
そして,対象となる痛みについて,本件明細書の記載をみると,・・・対象とする「痛み」とは,あらゆる全ての痛みが含まれるものというべきである。そのため,本件発明1及び2に係る特許が実施可能要件を充足するためには,本件明細書の発明の詳細な説明に,当業者が,同詳細な説明の記載及び本件出願日当時の技術常識に基づいて,過度の試行錯誤を要することなく,本件発明1及び2が全ての「痛み」に対して鎮痛効果を有することを理解できる程度の記載があることを要するというべきである。
(3) そこで,次に,上記のような「痛み」の具体的な機序・分類や,本件化合物に係る本件各薬理試験がどのような「痛み」について鎮痛効果を有することを示すものといえるのかに関し,本件出願日当時の技術常識の内容について検討する。
・・・
(4) 検討
・・・本件明細書には,・・・「痛み」とは,あらゆる全ての痛みが含まれるものであることがうかがわれる。しかし,当該箇所には,各痛みの名称や,神経障害性の痛みの原因等についての簡単な説明の記載があるにすぎず,それらの痛みに対して,本件化合物がどのように作用して鎮痛効果をもたらすのかについての記載はなく,本件化合物がそれらの各痛みに対して鎮痛効果を有することの裏付けになるような記載もない。そうすると,当業者においては,これらの記載を見ても,本件発明に係る本件化合物がこれらの各痛みに対する鎮痛効果を有することは理解できないというほかない。
そこで,さらに,本件明細書中・・・本件各薬理試験は,前記認定の本件出願日当時の技術常識に照らせば,いずれも侵害受容性疼痛に分類される炎症性疼痛に対する薬物の鎮痛効果を測定する試験であるというべきであるから,当業者が,このような本件各薬理試験についての記載から理解できる本件化合物の鎮痛効果は,侵害受容性疼痛に分類される炎症性疼痛に対するものに限られるというほかない。しかして,前記説示のとおり,本件出願日当時の技術常識として,侵害受容性疼痛,神経障害性疼痛及び心因性疼痛は,原因も治療法も異なると理解されていたと認められるものである。
そうすると,当業者は,上記の本件明細書の記載から,本件化合物が神経障害性疼痛又は心因性疼痛に分類される痛みに対する鎮痛効果を有することは理解できないというべきである。そして,その他,本件明細書において,当業者が,本件化合物が神経障害性疼痛又は心因性疼痛に分類される痛みに対する鎮痛効果を有することを理解できる根拠となるに足りる記載があるとは認められない。
したがって,本件明細書は,当業者が,明細書の発明の詳細な説明の記載及び本件出願日当時の技術常識に基づいて,過度の試行錯誤を要することなく,本件発明が全ての「痛み」に対して鎮痛効果を有することを理解できる程度の記載があるものとはいえないというべきであるから,本件発明1及び2に係る特許は,特許法36条4項(実施可能要件)に違反し,特許無効審判により無効にされるべきものと認められ,特許法104条の3第1項により,原告は,被告に対し,その権利を行使することができないことに帰する。
(2)本件発明1及び2の訂正は新規事項の追加に当たるか(争点2-1)
(1) 特許法126条5項(134条の2第9項が準用)は,「第1項の明細書,特許請求の範囲又は図面の訂正は,願書に添付した明細書,特許請求の範囲又は図面…に記載した事項の範囲内においてしなければならない。」と規定するところ,これに違反するときは,当該訂正は,訂正の適法要件を欠き,原告の訂正の再抗弁が認められないこととなる。しかして,特許法126条5項の明細書,特許請求の範囲又は図面に記載した事項とは,当業者によって,明細書,特許請求の範囲又は図面の全ての記載を総合することにより導かれる技術的事項であり,訂正がこのようにして導かれる技術的事項との関係において新たな技術的事項を導入しないものであるときは,当該訂正は,明細書,特許請求の範囲又は図面に記載した事項の範囲内においてするものということができると解される(知財高裁平成20年5月30日特別部判決・判例時報2009号47頁参照)。
(2) まず,訂正事項1及び2に係る技術的事項について検討する。
ア 訂正事項1は,訂正前の請求項において「痛みの処置における鎮痛剤」としていた部分に,「痛覚過敏又は接触異痛の」という文言を付け加えることで,本件発明1及び2の処置の対象となる痛みを「痛覚過敏又は接触異痛の痛み」に特定するものである。
イ 訂正事項2は,訂正事項1に更に「神経障害又は線維筋痛症による,」という文言を付け加えることで,本件発明2の処置の対象となる「痛覚過敏又は接触異痛の痛み」の原因を,「神経障害又は線維筋痛症」に特定するものであり,神経障害性疼痛又は心因性疼痛である線維筋痛症による痛覚過敏又は接触異痛の痛みを処置の対象とするものである。
(3) そこで,これらの技術的事項と,本件明細書の記載との関係が問題となるところ,前記説示のように,本件明細書において,当業者が,本件化合物が神経障害性疼痛又は心因性疼痛に分類される痛みに対する鎮痛効果を有することを理解できる根拠となるに足りる記載があるとは認められない。そして,本件明細書の全ての記載を精査しても,本件発明1及び2が,神経障害性疼痛や心因性疼痛に分類される「痛覚過敏又は接触異痛の痛み」(訂正事項1)に対して鎮痛効果を有するという技術的事項や,神経障害性疼痛又は心因性疼痛に分類される「神経障害又は線維筋痛症による,痛覚過敏又は接触異痛の痛み」(訂正事項2)に対して鎮痛効果を有するという技術的事項については,記載されていない。
また,前記説示のとおり,本件優先日当時の技術常識に関する原告の主張は採用できず,訂正事項1及び2の技術的事項が,本件明細書の記載から自明なものであるということもできない。
以上によれば,訂正事項1及び2の技術的事項は,本件明細書の全ての記載を総合することにより導かれる技術的事項との関係において,新たな技術的事項を導入するものというほかなく,訂正事項1及び2に係る訂正は,「願書に添付した明細書,特許請求の範囲又は図面…に記載した事項の範囲内」(特許法134条の2第9項,126条5項)での訂正とはいえない。
したがって,本件発明1及び2にかかる特許について,原告の主張する訂正の再抗弁は理由がないこととなるから,同特許に係る特許権に基づく原告の請求は,理由がないことに帰する。
(4) 原告の主張について
原告は,①訂正事項1について,本件明細書に,カラゲニン試験が記載され,機械的痛覚過敏及び熱痛覚過敏に対する本件化合物の効果が確認されており,また術後疼痛試験が記載され,熱痛覚過敏及び接触異痛に対する本件化合物の効果が確認されているから,「痛覚過敏又は接触異痛の痛み」に対して本件化合物を用いることが開示されている,②訂正事項2について,本件明細書に,本件化合物の処置対象となる慢性疼痛に含まれる痛みとして,「神経障害」の痛み,「線維筋痛症」が記載されており,しかも,神経障害の痛みや線維筋痛症において痛覚過敏や接触異痛を生じることは,本件優先日当時の技術常識であったなどと主張する。
しかし,上記主張①については,前記説示のとおり,・・・カラゲニン試験及び術後疼痛試験に関する記載をもって,本件明細書に,本件化合物が,神経障害性疼痛や心因性疼痛に分類される痛みに対する鎮痛効果を有するという技術的事項が記載されているとみることはできない。
また,上記主張②については, 確かに,本件明細書には,本件化合物の処置対象となる慢性疼痛に含まれる痛みの名称を列挙した箇所があり(前記2(2)),「神経障害」の痛みと「線維筋痛症」も当該箇所に記載されている。しかし,前記説示のとおり,当業者においては,当該箇所に,各痛みの名称等が記載されていることのみをもって,本件発明1及び2に係る本件化合物の,当該痛み(「神経障害」の痛みと「線維筋痛症」)に対する鎮痛効果を理解することはできない。そうすると,当該箇所をもって,本件発明1及び2に係る本件化合物が,神経障害の痛みや線維筋痛症による痛みに対する鎮痛効果を有するという技術的事項が記載されていると評価することはできず,こうした事項が,本件明細書,特許請求の範囲の記載の全てを総合することにより導かれるということもできない。
以上によれば,原告の上記主張はいずれも採用することができない。
(3)被告医薬品は本件訂正発明3及び4の技術的範囲に属するか(文言侵害)(争点3-1)
(1) 本件訂正発明3に係る構成要件3Bの文言は,「炎症を原因とする痛み,又は手術を原因とする痛みの処置における,」というものであり,本件訂正発明4に係る構成要件4Bの文言は,「炎症性疼痛による痛覚過敏の痛み,又は術後疼痛による痛覚過敏若しくは接触異痛の痛みの処置における,」という文言である。
そこで検討するに,前記説示のとおり,本件出願日当時の技術常識として,痛みはその原因によって,侵害受容性疼痛及び神経障害性疼痛の2つ,又はそれらに心因性疼痛(線維筋痛症はこれに分類される。)を加えた3つに大別され,それぞれ治療法が異なるものであり,炎症性疼痛及び術後疼痛は侵害受容性疼痛に分類される痛みと理解されていたものであることが認められ(前記2(3)ア(イ)),また,本件明細書に記載された本件各薬理試験は,いずれも侵害受容性疼痛に分類される炎症性疼痛に対する薬物の鎮痛効果を測定する試験であるため,当業者が本件明細書の記載から理解できる本件化合物の鎮痛効果は,侵害受容性疼痛に分類される炎症性疼痛に対するものに限られるものと認められる(前記2(4))。
これらに照らせば,「炎症を原因とする痛み」(構成要件3B)及び「炎症性疼痛による痛覚過敏の痛み」(構成要件4B)は,いずれも侵害受容性疼痛に分類される炎症性疼痛を意味するものであり,「手術を原因とする痛み」(構成要件3B)及び「術後疼痛による痛覚過敏若しくは接触異痛の痛み」(構成要件4B)は,いずれも侵害受容性疼痛に分類される術後疼痛を意味するものであると解される。
しかして,これらに対応する被告医薬品の構成bは,「効能・効果を神経障害性疼痛及び線維筋痛症に伴う疼痛とする,」というものであるところ,上記説示に照らせば,被告医薬品が効能・効果を有する「神経障害性疼痛」は神経障害性疼痛を意味するものであり,「線維筋痛症」は心因性疼痛に分類される痛みであると認められる。
(2) 原告の主張について
・・・原告は,本件優先日当時,炎症で神経の病変や疾患を生じ,手術で末梢神経や神経終末を損傷し,神経の損傷によっても炎症が生ずることなどから,痛みを原因で区別できず,炎症性疼痛や術後疼痛と,神経障害性疼痛や線維筋痛症に伴う疼痛とは,相互に重複することが知られていたから,本件訂正発明3及び4の技術的範囲が侵害受容性疼痛に限られるか否かにかかわらず,被告医薬品は本件訂正発明3及び4の技術的範囲に属するなどと主張・・・する。
そこで検討するに,甲93文献(神経障害性疼痛薬物療法ガイドライン改訂第2版)には,「神経障害性疼痛と侵害受容性疼痛の分類とその臨床的意義は?」という問いに対する回答ないし解説として,次のような記載がある。
「器質的な原因による痛みは,侵害受容性疼痛と神経障害性疼痛に分類される。ただし,これらの痛みの病態は臨床的にオーバーラップすることも少なくなく,混合性疼痛と称されており,それぞれの病態に応じた薬物療法が求められる。」,「侵害受容性疼痛と神経障害性疼痛を分類して評価する意義は,その原因に対する根治的治療法の可能性を検討するのに役立つことを期待していることにある。痛みを伴う疾患は,このように侵害受容性疼痛と神経障害性疼痛の2つに大別されるが,痛みの重症度や遷延化によって神経系の過敏性が発現したり,神経組織内の炎症が侵害受容器を興奮させ痛みを引き起こしたりするため,両病態は混在し得る概念であることが理解されなければならない。」
しかし,まず,甲93文献の第1版が発行されたのは平成23年であるため,本件優先日である平成8年当時の技術常識を示すものとはいえない。また,「臨床的にオーバーラップすることも少なくなく,混合性疼痛と称されており,それぞれの病態に応じた薬物療法が求められる」という記載は,侵害受容性疼痛と神経障害性疼痛が必ず混在することを示すものではなく,混在する場合にそれらの痛みが区別できなくなることを示すものでもない。加えて,同記載は,侵害受容性疼痛と神経障害性疼痛を分類して評価する意義について,「その原因に対する根治的治療法の可能性を検討するのに役立つことを期待していることにある」と説明しており,飽くまで,そのような分類に治療上の意義があることを前提とするものにすぎないといえる。そうすると,同文献から,原告が主張する本件優先日当時の技術常識,すなわち,痛みを,組織損傷,炎症,神経損傷,心因性の要因といった原因によって明確に区別することはできず,炎症性疼痛や術後疼痛と神経障害性疼痛や線維筋痛症に伴う疼痛とは,相互に重複する痛みであるという技術常識を認定することはできないというほかない。原告が提出するその他の文献(甲92,94,95,96等)も,いずれも本件優先日後に出版ないし作成されたものであり,その内容をみても,本件優先日である平成8年当時の技術常識を示すに足りるものとはいえない。その他の証拠を精査しても,原告が主張する前記技術常識を認定することはできない。
以上によれば,原告の上記主張は,採用することができない。
(4)被告医薬品は本件訂正発明3及び4の技術的範囲に属するか(均等侵害)(争点3-2)
(1) 前記説示のとおり,・・・被告医薬品は,構成要件3B及び4Bの各文言を充足せず,本件訂正発明3及び4と被告医薬品は,この点において相違するものであるといえる(以下,この相違部分を「本件相違部分」という。)。
しかるに,特許請求の範囲に記載された構成中に,相手方が製造等をする製品又は用いる方法(以下「対象製品等」という。)と異なる部分が存する場合であっても,①同部分が特許発明の本質的部分ではなく(以下「第1要件」という。),②同部分を対象製品等におけるものと置き換えても,特許発明の目的を達することができ,同一の作用効果を奏するものであって,③そのように置き換えることに,当業者が対象製品等の製造等の時点において容易に想到することができたものであり,④対象製品等が,特許発明の特許出願時における公知技術と同一又は当業者がこれから同出願時に容易に推考できたものではなく,かつ,⑤対象製品等が特許発明の特許出願手続において特許請求の範囲から意識的に除外されたものに当たるなどの特段の事情もないときは,同対象製品等は,特許請求の範囲に記載された構成と均等なものとして,特許発明の技術的範囲に属するものと解される(最高裁平成10年2月24日第三小法廷判決・民集52巻1号113頁参照)。
そこで,本件相違部分につき,均等の第1要件を充足するかについて検討する。
(2) 均等の第1要件にいう「本質的部分」とは,当該特許発明の特許請求の範囲の記載のうち,従来技術に見られない特有の技術的思想を構成する特徴的部分であると解すべきところ(知財高裁平成28年3月25日特別部判決・判時2306号87頁参照),前記説示に照らし,特許請求の範囲の記載,明細書の記載を踏まえると,本件訂正発明3及び4も,本件発明と同様に,てんかん等の中枢神経系疾患に対する抗発作療法に有用な既知の薬物であった本件化合物について,既存の鎮痛剤では不十分な効果又は副作用からの限界により不完全な処置しか行われていなかった慢性の疼痛性障害に対して,その痛みの処置に係る鎮痛剤としての有用性を見出した医薬の用途発明であるということができるものである。そして,前記説示の本件出願日当時の技術常識を踏まえれば,本件訂正発明3及び4においては,慢性の疼痛性障害の中でも,本件化合物を・・・侵害受容性疼痛に分類される炎症性疼痛,術後疼痛という用途に用いる点が,その課題解決原理の中核的部分を構成するものというべきである。
しかして,前記説示のとおり,被告医薬品の効能・効果とされている「神経障害性疼痛及び線維筋痛症に伴う疼痛」(構成b)は,いずれも神経障害性疼痛又は心因性疼痛に分類される痛みを意味するものであって,被告医薬品は,上記のような,侵害受容性疼痛に分類される痛みに係る鎮痛剤の用途に用いるものではない。そうすると,本件相違部分は,医薬品の用途を,侵害受容性疼痛に分類される痛みに係る用途から,神経障害性疼痛又は心因性疼痛に分類される痛みに係る用途へと置換するものであり,その両者は,それぞれ治療法も異なる別個の痛みに係る用途というべきものである。
そうすると,本件相違部分は,本件訂正発明3及び4における,従来技術に見られない特有の技術的思想を有する特徴的部分に当たる点を置換するものというほかなく,これは,まさに本件訂正発明3及び4の本質的部分を置換したものというべきであるから,本件相違部分に係る置換は,均等の第1要件を充足しないというべきである。
したがって,被告医薬品は,他の要件を検討するまでもなく,本件訂正発明3及び4の特許請求の範囲に記載された構成と均等なものとはいえず,本件訂正発明3及び4の特許発明の技術的範囲に属するとは認められない。
4.コメント
(1)医薬用途発明の実施可能要件を満たすためには明細書に「効果を有することの裏付け」の記載が必要
以下の記事で取り上げた本件特許権での侵害差止請求事件で、東京地裁・民事第29部は、いわゆる医薬用途発明の実施可能要件を満たすために必要な明細書への記載について判示した。
- 2021.12.24 「ワーナー-ランバート v. 小林化工」 東京地裁令和2年(ワ)19927・・・疼痛治療剤リリカ®(プレガバリン)のジェネリック、医薬用途に係る特許権は非侵害と判断
- 2022.01.19 「ワーナー-ランバート v. 武田テバファーマ・武田薬品工業」 東京地裁令和2年(ワ)22290/26770・・・疼痛治療剤リリカ®(プレガバリン)のジェネリック、医薬用途に係る特許権は非侵害と判断
本事件で、東京地裁・民事第47部は、実施可能要件を満たすために必要な明細書への記載について、上記判決にて民事第29部が「薬理データによる裏付け」というキーワードを用いたのと同様に、「効果を有することの裏付けになるような記載」というキーワードを用いて言及し、結果、当業者においては、明細書の記載を見ても、本件発明に係る本件化合物がこれらの各痛みに対する鎮痛効果を有することは理解できないから、本件発明1及び2に係る特許は、実施可能要件に違反すると判断した。
「本件明細書には・・・それらの痛みに対して,本件化合物がどのように作用して鎮痛効果をもたらすのかについての記載はなく,本件化合物がそれらの各痛みに対して鎮痛効果を有することの裏付けになるような記載もない。」
これまで、医薬用途発明について明細書の記載の程度が問題となり、実施可能要件が争われた事件は種々あるが(記事「記載要件/引例適格/データは必要か」1.(2)参照)、特に、本件のように、技術常識を踏まえても明細書に記載された薬理試験結果がその医薬用途発明(疾患への有用性)への範囲までは裏付けられていないとされた典型的な事件を以下に例示する。


医薬用途発明について実施可能要件を満たすために必要とされる明細書の記載の程度についての争いとなったら、明細書に記載する薬理試験データの存在はもちろんのこと、その試験結果から考察できる疾患範囲について説明可能な出願当時の技術常識の裏付けをどれだけ主張できるるかが、勝敗の分かれ目となる。
(2)明細書記載事項を訂正事項とする訂正可否に実施可能要件?
本判決で引用されている知財高裁平成20年5月30日特別部判決は、明細書又は図面に具体的に記載されていない事項を訂正事項とする訂正についても、明細書又は図面の記載によって開示された技術的事項に対し、新たな技術的事項を導入しないものであると認められる限り 「明細書又は図面に記載した事項の範囲内において」する訂正であるというべきである、として訂正が許容された事例であった。
しかし、本事案では、本件明細書に具体的に記載されている「神経障害」の痛みと「線維筋痛症」を訂正事項とする訂正(の再抗弁)の是非が争点のひとつとなった。
本発明は、以下の式Iの化合物の、痛みの処置とくに慢性の疼痛性障害の処置における使用方法である。このような障害にはそれらに限定されるものではないが炎症性疼痛、術後疼痛、転移癌に伴う骨関節炎の痛み、三叉神経痛、急性疱疹性および治療後神経痛、糖尿病性神経障害、カウザルギー、上腕神経叢捻除、後頭部神経痛、反射交感神経ジストロフィー、線維筋痛症、痛風、幻想肢痛、火傷痛ならびに他の形態の神経痛、神経障害および特発性疼痛症候群が包含される。
・・・痛みにはとくに炎症性疼痛、神経障害の痛み、癌の痛み、術後疼痛、および原因不明の痛みである特発性疼痛たとえば幻想肢痛が包含される。神経障害性の痛みは末梢知覚神経の傷害または感染によって起こる。これには以下に限定されるものではないが、末梢神経の外傷、ヘルペスウイルス感染、糖尿病、カウザルギー、神経叢捻除、神経腫、四肢切断、および血管炎からの痛みが包含される。神経障害性の痛みはまた、慢性アルコール症、ヒト免疫不全ウイルス感染、甲状腺機能低下症、尿毒症またはビタミン欠乏からの神経障害によっても起こる。神経障害性の痛みには、神経傷害によって起こる痛みに限らず、たとえば糖尿病による痛みも包含される。
– 本件特許第3693258号の明細書の記載より
裁判所は、
「当業者においては,当該箇所に,各痛みの名称等が記載されていることのみをもって,本件発明1及び2に係る本件化合物の,当該痛み(「神経障害」の痛みと「線維筋痛症」)に対する鎮痛効果を理解することはできない。そうすると,当該箇所をもって,本件発明1及び2に係る本件化合物が,神経障害の痛みや線維筋痛症による痛みに対する鎮痛効果を有するという技術的事項が記載されていると評価することはできず,こうした事項が,本件明細書,特許請求の範囲の記載の全てを総合することにより導かれるということもできない。」
として、痛みを「痛覚過敏又は接触異痛の痛み」やその原因を「神経障害又は線維筋痛症による」痛みに特定する訂正事項1及び2の技術的事項は、本件明細書の全ての記載を総合することにより導かれる技術的事項との関係において、新たな技術的事項を導入するものであり、新規事項の追加に当たるから、訂正の再抗弁については認められないと判断した。
訂正事項が明細書に具体的に記載されていたとしても、その技術的事項の効果を理解することができなければ、すなわち、本件の場合、医薬用途発明として効果を有することの裏付けになるような記載がなければ、新たな技術的事項を導入するものであり、新規事項の追加に当たると裁判所が示したことになる。
本件特許についての以下の関連事件判決でも同様な訂正可否判断をしている。
- 2021.12.24 「ワーナー-ランバート v. 小林化工」 東京地裁令和2年(ワ)19927・・・疼痛治療剤リリカ®(プレガバリン)のジェネリック、医薬用途に係る特許権は非侵害と判断
- 2022.01.19 「ワーナー-ランバート v. 武田テバファーマ・武田薬品工業」 東京地裁令和2年(ワ)22290/26770・・・疼痛治療剤リリカ®(プレガバリン)のジェネリック、医薬用途に係る特許権は非侵害と判断
このように、明細書に具体的に記載されている事項を訂正事項とする場合において、その訂正事項に係る技術的事項に実施可能要件と同様なハードルを設けて訂正の可否を判断した本判決の論理は、前記知財高裁平成20年5月30日特別部判決以降の裁判例でも採用されたことのある論理なのか不明だが、少なくとも、本件判決(及び関連判決)以外、医薬系判決では見たことがない(参考: 訂正・補正が争点となった判決記事)。
明細書に具体的に記載されている事項を訂正事項とする場合においては、当然に新たな技術的事項を導入するものではなく、訂正を認めるべきではなかろうか。そして訂正を認めた上で、訂正後発明についての実施可能要件等の適否を判断することが適切ではなかろうか。
明細書に具体的に記載されている訂正事項の訂正の可否に対して、実施可能要件と同様な要件を課すことは妥当と思えない。訂正要件と実施可能要件はその趣旨も異なるのであるから、独立に判断されるべきではないか。
(3)痛みは原因で区別できず相互に重複するとの議論
原告は、
「本件優先日当時,炎症で神経の病変や疾患を生じ,手術で末梢神経や神経終末を損傷し,神経の損傷によっても炎症が生ずることなどから,痛みを原因で区別できず,炎症性疼痛や術後疼痛と,神経障害性疼痛や線維筋痛症に伴う疼痛とは,相互に重複することが知られていたから,本件訂正発明3及び4の技術的範囲が侵害受容性疼痛に限られるか否かにかかわらず,被告医薬品は本件訂正発明3及び4の技術的範囲に属する」
などと主張した。
「炎症性疼痛や術後疼痛」と「神経障害性疼痛や線維筋痛症に伴う疼痛」は、形式的には疼痛の分類としてそれぞれ区分されている。
そうであっても、原告が提出した文献のとおり、「痛みの重症度や遷延化によって・・・両病態が混在しうる概念である」のであれば、境界線を引くことができない相互に重複することがある場合と、発明の技術的範囲の属否判断・被告医薬品の差止めの是非という白黒つけなければならない判断との間を、どのように整合させるべきなのか。この点は、本件での文言侵害の是非を判断する際の重要なポイントであったと思う。
裁判所は、まず、原告が提出した各文献はいずれも本件優先日後のものであり、本件優先日当時の技術常識を示すものとはいえないと判示し、さらに、
「記載は・・・必ず混在することを示すものではなく,混在する場合にそれらの痛みが区別できなくなることを示すものでもない。・・・飽くまで,そのような分類に治療上の意義があることを前提とするものにすぎないといえる。」
として、相互に重複する痛みであるという技術常識を認定することはできないと判断した。
本件の両疼痛の区別は比較的明確であったことから、裁判所の下した結論に異論はない。
仮に、医薬用途発明の疾患と被疑侵害品の疾患とが形式上区分されるものであっても、互いに極めて密接且つ混在した病態として重複する部分が少なくない場合であったなら、発明の技術的範囲の属否判断および差止め判断は、特許権者に肯定的なものへと傾いたのだろうと想像される。
(4)延長登録された特許権の効力についての議論
延長された特許権の効力が被告医薬品に及ぶか否かの争点は、裁判所によって判断されなかったが、争点となった貴重なケースであるため、原告及び被告らの一部主張を以下に抜粋し、コメントを付した。
ア 延長された医薬用途特許権の効力は剤形違いの後発医薬品に及ぶか否か
<原告の主張>(抜粋)
ア 延長登録の効力が及ぶ範囲に係る実質同一性については,「成分,分量,用法,用量,効能及び効果」に関し,特許発明の内容に基づき,その内容との関連で,技術的特徴及び作用効果の同一性を比較検討して判断すべきであり,処分対象物と被告医薬品との差異が,技術的特徴や作用効果に関わるものでなければ,実質同一性が肯定される。
・・・剤形は実質同一性の考慮要素ではないから,剤形の違いは実質同一性に影響を及ぼさない。延長登録の制度趣旨からも,カプセルに係る延長登録の効力範囲を市場の競合するOD錠に及ぼさなければ,先発医薬品が保護されないこととなるし,延長登録の要件と延長登録の効力範囲の問題は,別個の問題であるから,カプセルとOD錠とでそれぞれ登録が可能であったとしても,カプセルの延長登録の効力範囲は,OD錠にも及ぶと解すべきである。
<被告らの主張>(抜粋)
OD錠は口腔内で崩壊し有効成分が放出されることを特徴としており,水なしでも安全に服用できることや,そのことが有効成分の吸収性・有効性・保存安定性に悪影響を及ぼさないという見地から,有効成分以外の成分及びその構造が決せられるのに対し,本件処分対象物のようなカプセル剤の場合,口の中で崩壊することなく,その形状を維持したまま経口で摂取され,体内で胃液などによって効率よく分解され,有効成分を放出するという観点から有効成分以外の成分及びその構造が決せられるものである。このように,両者は,品質,有効性及び安全性に関する検討のポイントが異なり,有効成分以外の成分の選択や薬剤の設計思想も全く異なっており,カプセル剤とOD錠とを同一に扱うことができないことは明らかである。
<コメント>
現時点で、延長された「医薬用途発明」に係る特許権の効力範囲について具体的に判断された裁判例はない。
しかし、延長された製剤特許権の効力について争われた「オキサリプラティヌム事件」知財高裁大合議判決(2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046)では、以下のように、「特許発明の内容に基づき、その内容との関連で」実質同一性を検討し判断すべきであることを判示している。
従って、本件のような「医薬用途発明」の事案であれば、「医薬用途発明」に基づき、その関連で実質同一性が判断されるものと考えるのが妥当ではないだろうか。
イ 特許発明を実施することができなかった期間の始期は実施権設定登録を要するか
<被告らの主張>(抜粋)
平成23年法律第63号による改正前の特許法(以下「旧特許法」という。)125条5 の2第1項第2号において,「その延長登録が,その特許権者又はその特許権についての専用実施権若しくは登録した通常実施権を有する者が第六十七条第二項の政令で定める処分を受けていない場合の出願に対してされたとき」と規定されていることからすると,延長登録のための試験は専用実施権者らによってされなければならないことはいうまでもない。
当該処分のための試験を行っている者が特許権者以外の者である場合,専用実施権などの実施許諾がなければ,当該第三者の行為が,特許権者の意思及び能力によるものと客観的に判断することは不可能であるから,現に当該第三者が専用実施権等の設定を受けている期間に限って,旧特許法125条の2第1項第3号に規定する「その特許発明の実施をすることができなかつた期間」に該当すると解すべきである。
したがって,・・・「その特許発明の実施をすることができなかつた期間」の始期は,ファイザー株式会社が専用実施権の設定を受けた平成22年5月6日であり,そうすると,用途を「帯状疱疹後神経痛」とする3件の延長登録出願・・・,他の9件に関しても・・・いずれも現時点ないし本件訴訟提起の時点において,既にその期間は満了していることになる・・・
<原告の主張>(抜粋)
旧特許法125条の2第1項2号及び3号は,政令処分を受けるために必要な試験が特許権者等によってなされたものであることを求めていない。実際にも,臨床試験が製造販売承認を受ける主体によって実施されるとは限らない。そのため,旧特許法125条の2第1項3号の「その特許発明の実施をすることができなかつた期間」の始期は,最終的に製造販売承認を受けるために必要となった試験が開始された日と解することで足り,試験開始日において当該試験が特許権者等の名義でされることを要しない。
仮に,旧特許法125条の2第1項2号及び3号の解釈として,政令処分を受けるための試験が特許権者の意思に基づくものであることを要するとしても,本件では,特許権者の意思により試験がされたことが明らかであるから,延長登録に無効理由はない。
<コメント>
実施権者との関係性が延長登録要件(延長期間)の問題となった事件としては以下のものがある。
(5)パテントリンケージの運用が抱える問題が顕在化する可能性があった
上述(1.事件の背景)のとおり本件特許についての別件無効審判請求事件における一部無効審決時点では、本件発明1及び2の無効が確定していたわけではなく、訂正により有効と判断された本件訂正発明3及び4の属否判断がされたわけでもなかったが、厚生労働省は、この特許庁での一部無効審決を以って、パテントリンケージを働かせることなく、2020年8月17日、リリカ®の後発医薬品を初承認し、同年12月11日には各後発医薬品メーカーが一斉に後発医薬品を販売するに至った。
これに対し、リリカ®を製造販売するファイザーは、プレスリリースにおいても
「本日2020年8月17日に、厚生労働省により、リリカのジェネリック医薬品の製造販売が承認されました。
・・・
ファイザーは、今回の決定を大変遺憾に思います。私たちはジェネリック医薬品の製造販売承認はリリカの特許権の侵害につながる可能性が高いと考えており、知的財産を強力に保護するために適切な法的・薬事的措置を講じています。・・・私たちは、すべてのステークホルダーの権利を保護するために、関連する法規制に基づく適切なタイミングでのジェネリック医薬品の参入、および、イノベーションと特許を保護する安定した信頼性の高い制度を支持しています」
と発表しており、厚生労働省の承認判断(今回の決定)を批判し、日本のパテントリンケージが信頼性の高い制度として機能していないことへの不満・憤りを述べた(ように見える)。
仮に、ファイザーの主張するとおり、リリカ®のジェネリックの販売行為が本件特許権の侵害に当たるとの判決に至っていれば、リリカ®の全てのジェネリックの販売は停止せざるを得なくなり、結果、医薬品の安定供給に支障をきたす可能性があった。
別の見方でいえば、そもそも特許紛争を事前に整理することによって後発医薬品の市場への安定供給を実現することを目的とするパテントリンケージ制度であるにもかかわらず、特許権侵害に該当するジェネリックを特許が存在するにもかかわらず承認した厚生労働省のパテントリンケージの運用が抱える問題によって医薬品供給に混乱を招くおそれ・・・がまさに顕在化する可能性もあった。
参考記事:

(6)本件特許第3693258号に関連する判決
発明の名称を「イソブチルGABAまたはその誘導体を含有する鎮痛剤」とする本件特許第3693258号に関連する判決についての記事は以下のとおり。


- 【本記事】2021.11.30 「ワーナー-ランバート v. 日新製薬・Meiji Seika ファルマ」 東京地裁令和2年(ワ)19918/22291・・・疼痛治療剤リリカ®(プレガバリン)のジェネリック、医薬用途に係る特許権は非侵害と判断
その他の侵害差止請求事件については判決文の公開が待たれる。
また、特許権者(原告)は、本件特許の無効審判請求事件(無効2017-800003号)において、請求項1及び2に係る本件訂正を認めず、請求項1及び2に係る発明についての本件特許を無効とした部分の取消しを求めて審決取消訴訟(知財高裁令和2年(行ケ)第10135号)を提起している。
その判決言渡日は、2022年3月7日だが、現時点で最高裁判所HPにはまだ判決がアップされていない。
知財高裁は、本件特許を無効とした審決を支持するのか、それとも審決を取消すのか。本記事で紹介した特許権侵害差止請求事件が東京地裁から知財高裁に上訴されたとしても、まずは特許の無効の是非についての知財高裁判決が先に明らかになる。


コメント