1.謹告「リバーロキサバンに関する特許権について」の再々掲載
2022年2月1日、バイエル薬品より「リバーロキサバンに関する特許権について」の謹告文が掲載されました(2022.02.01 日刊薬業 【謹告】リバーロキサバンに関する特許権について)。
リバーロキサバンに関する特許権について
バイエル薬品株式会社(以下「当社」)は、リバーロキサバンを有効成分とする「イグザレルト®錠10mg/15mg」、「イグザレルト®細粒分包10mg/15mg」、「イグザレルト®OD錠10mg/15mg」、および「イグザレルト®ドライシロップ小児51.7mg/103.4mg」を製造販売しております。
当社は、リバーロキサバンを有効成分とする製品を保護する特許として、日本特許第4143297号、第4852423号、同第5147703号、同第5311742号、および同第5416408号の5件の特許を保有しており、そのうち同第4143297号、同第4852423号および同第5311742号については、特許延長登録を取得済みです。当社は、これら特許および特許延長登録は有効であると共に、実効性があるものと確信しております。とくに、有効成分リバーロキサバンにかかる特許第4143297号の特許存続期間は5年延長されております点には是非ご留意ください。
当社は、これら特許権(存続期間延長にかかる部分を含む)を侵害する行為、または侵害するおそれのある行為に対し、厳正かつ厳格なる法的処置を講じる所存です。
リバーロキサバンを有効成分とする製品の製造、販売、輸入等を計画されている企業におかれましては、当社の知的財産権の侵害行為のなきよう、十分ご留意いただきたくお願い申し上げます。
2022年2月1日
バイエル薬品株式会社
2020年12月4日(過去記事)、2021年6月28日(過去記事)に続いて再々度の謹告となります。
2.リバーロキサバンを有効成分とするイグザレルト®について
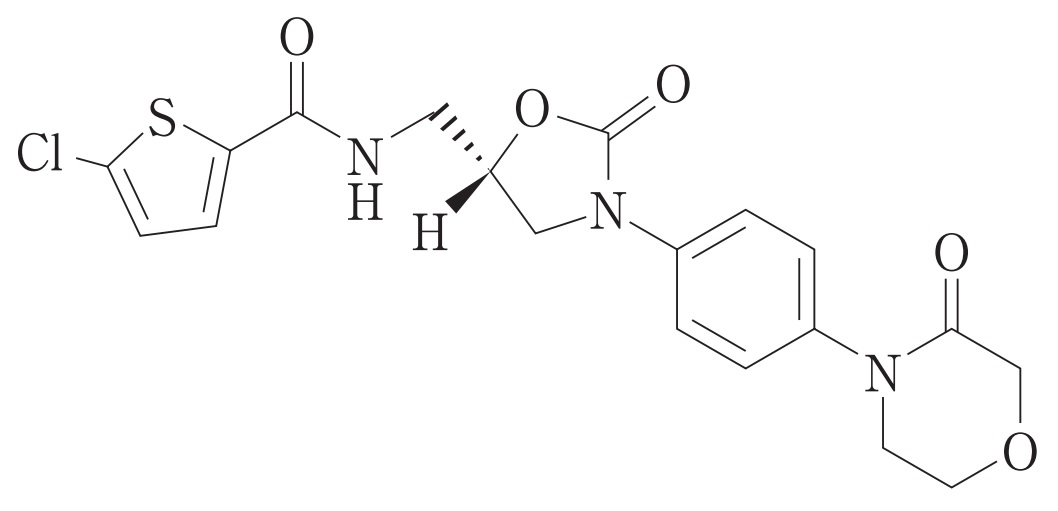 リバーロキサバン(rivaroxaban)は、Bayer社で開発された選択的直接作用型第Ⅹa因子阻害剤イグザレルト®(Xarelto®)の有効成分です。
リバーロキサバン(rivaroxaban)は、Bayer社で開発された選択的直接作用型第Ⅹa因子阻害剤イグザレルト®(Xarelto®)の有効成分です。
イグザレルト®(Xarelto®)は、Bayer社の主力製品で、2020年には同社による世界売上高は4,515M€となりました(Bayer 2020 Annual report)。また、イグザレルト®(Xarelto®)は、2020年世界で最も売れた医薬品(トップ5)のひとつといわれています(AnswersNews 更新日2021.06.21 2020年 世界で最も売れた医薬品は)。
国内では、イグザレルト®錠10mg、15mgが、2012年1月18日に「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」を適応として承認され、2015年9月24日に「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」の効能又は効果及び用法及び用量が追加承認されました。
また、イグザレルト®細粒分包10mg、15mgが、2015年9月28日に「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」、2015年12月2日に「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」を適応症として承認され、その後、口腔内崩壊(OD)錠が、2020年8月6日に「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制」及び「深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制」を適応として承認されまた。
再審査期間は、イグザレルト®錠が「8年(2012年1月18日~2020年1月17日)」、イグザレルト®細粒分包が「錠の残余期間(2015年9月28日~2020年1月17日)」、イグザレルト®OD錠は「該当しない」となっています。
3.イグザレルト®ジェネリック参入と延長特許権の効力の問題
イグザレルト®の再審査期間は終了していることから、イグザレルト®のジェネリックの承認申請は既に可能となっており、特許権の問題をクリアできればジェネリックが初承認となる可能性があります。
特許権の問題をクリアするための主なポイントは・・・
- 結晶特許第5416408号(2026年満了。延長出願していないため製品保護しないのか?)をジェネリックメーカーは回避できるかどうか
- 上記結晶特許を回避できるとして、「とくに、有効成分リバーロキサバンにかかる特許第4143297号の特許存続期間は5年延長されております点には是非ご留意ください。」と謹告文に強調されていますが、物質特許第4143297号の延長は適応症と製剤とで短冊的に延長されているため(下記)、ジェネリックメーカーがその効力の間隙を突くのか(短くても、OD錠承認に基づいた延長は、20年の満了日である2020年12月11日に1年6月21日延長分を加えた2022年7月まで)
物質特許第4143297号の存続期間延長状況
1. 非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制
・普通錠10mg/15mg: 2020.12.11+3y6m28d延長
・細粒分包10mg/15mg: 2020.12.11+1y8m7d延長
・OD錠10mg/15mg: 2020.12.11+1y6m21d延長
2. 深部静脈血栓症及び肺血栓塞栓症の治療及び再発抑制
・普通錠10mg/15mg: 2020.12.11+5y延長
・細粒分包10mg/15mg: 2020.12.11+1y10m11d延長
・OD錠10mg/15mg: 2020.12.11+1y6m21d延長
- 仮に、イグザレルト®OD錠の承認に基づく物質特許権の延長期間(~2022年7月)が満了した後に、ジェネリックOD錠が承認された場合、最初のイグザレルト®普通錠の承認に基づいて延長された物質特許権の効力を剤形違いであるジェネリックOD錠にも及ぶとする主張が裁判所においてどのような結論に導かれるか
- そもそも、裁判所での争いとなる前に、ジェネリックの承認審査において、厚生労働省/PMDAが(延長特許の効力範囲を解釈・判断して)パテントリンケージをしっかり運用できるのか。「医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(各都道府県衛生主管部(局)長あて厚生労働省医政局経済課長・厚生労働省医薬食品局審査管理課長通知)(平成21年6月5日付医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号審査課長通知)」において、ジェネリックの薬事法上の承認審査にあたっては、以下の点を定めています(日本版パテントリンケージについては2021.03.08記事「日本のパテントリンケージの現状の課題とその解決に向けた提案」をご参照ください)。
- 先発医薬品の有効成分に特許が存在する場合には後発医薬品を承認しないこと
- 先発医薬品の特許が存在する効能・効果、用法・用量(効能・効果等)については承認しない方針であること
- 特許の存否は承認予定日で判断するものであること
・・・いろいろと想像が膨らみます。大変興味あるところです。

コメント
【追加情報】
2022.02.17 ミクスOnline: バイエルホールディング イグザレルト後発品はAG 子会社が承認取得
https://www.mixonline.jp/tabid55.html?artid=72581
バイエルホールディング100%子会社のバイエル薬品販売が2022年2月15日に承認を取得した抗凝固薬イグザレルト(一般名:リバーロキサバン)の初の後発品について、バイエルホールディングがAGであること明らかにしたとのこと。
【参考】
2022.02.19 ジェネリック医薬品と特許「リバーロキサバン」
https://gemedicines.blogspot.com/2022/02/blog-post.html
延長登録と効力との間の問題点を今回のイグザレルイトAGの件でとても分かりやすくご説明されています。先発が新規格追加承認得れば得るほどそれぞれが期間延長登録短くなる(=ジェネリック早く参入してしまう)というインセンティブを減退させる延長特許の効力解釈であってはならないと感じます。