本件(知財高裁令和2年(行ケ)10122)は、発明の名称を「ウデナフィル組成物を用いてフォンタン患者における心筋性能を改善する方法」とする特許出願(特願2017-504434号、特表2017-524705、WO2016/025100)の拒絶査定不服審判事件(不服2019-1474号)について、実施可能要件違反及びサポート要件違反により拒絶すべきものであるとして出願人(メジオン ファーマ/MEZZION PHARMA CO LTD [KR])の請求を不成立とした審決の取消訴訟である。
1.本願の請求項1
【請求項1】
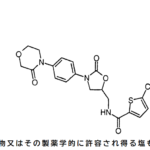
フォンタン手術を受けた患者における,最大努力時VO2により測定される運動耐容能の改善用の医薬組成物であって,ウデナフィル又はその薬剤的に許容可能な塩を含み,該ウデナフィル又はその薬剤的に許容可能な塩の投与量が1回当り87.5mgであり,前記組成物が1日2回投与される,医薬組成物。
2.フォンタン手術とウデナフィル(udenafil)
「フォンタン手術」は、「(使える)心室が一つしかない」心臓病に対して行われる手術である(国立成育医療研究センターホームページより)。
出願人であるメジオン ファーマは、フォンタン手術を受けた単心室症(single ventricle heart disease; SVHD)患者の運動機能を向上させるための医薬品として、ウデナフィル(udenafil)を米国食品医薬品局(FDA)に承認申請している。
本願は、上記FDAに申請しているウデナフィルの医薬用途を日本で保護しようと試みたものと考えられる。
 ウデナフィルは、東亞製薬/Dong-A Pharmaceutical(韓国)が創出した5型ホスホジエステラーゼ(PDE5)の選択的阻害剤。韓国などでは勃起不全(ED)治療薬として販売されている。
ウデナフィルは、東亞製薬/Dong-A Pharmaceutical(韓国)が創出した5型ホスホジエステラーゼ(PDE5)の選択的阻害剤。韓国などでは勃起不全(ED)治療薬として販売されている。
日本では、2011年、Meiji Seika ファルマが、既に韓国などでED治療薬として販売されていたウデナフィルの日本国内における開発および販売に関するライセンス契約を東亞製薬と締結し、前立腺肥大症治療薬として日本での開発(開発番号ME3113)を進めていた。しかし、2016年に本剤の開発中止を発表した。
- 2011.12.19 Meiji Seikaファルマ press release: 「ウデナフィル」に関するライセンス契約締結のお知らせ
- 2016.05.10 Meiji Seikaファルマ press release: 前立腺肥大症治療薬ME3113(udenafil)の開発中止に関するお知らせ
現在、日本ではウデナフィルは医薬品として承認されていない。
3.裁判所の判断
裁判所は、本願発明には実施可能要件違反があるとした本件審決の判断に誤りはないとして、その余の取消事由について判断すせず(サポート要件違反に関する原告の主張も採用できないことは明らかと言及)、原告の請求を棄却した。
以下に、裁判所の判断を抜粋して紹介する。
(1)物の発明について実施可能要件を満たすためには
「特許法36条4項1号は,明細書の発明の詳細な説明の記載は,その発明の属する技術の分野における通常の知識を有する者がその実施をすることができる程度に明確かつ十分に記載したものでなければならないと定めるところ,この規定にいう「実施」とは,物の発明においては,その物を作り,使用をする行為をいうものであるから(同法2条3項1号),物の発明について実施可能要件を満たすためには,明細書の発明の詳細な説明の記載は,当業者が,その記載及び出願時の技術常識に基づいて,過度の試行錯誤を要することなく,当該発明に係る物を作り,使用をすることができる程度のものでなければならない。」
(2)医薬の用途発明について実施可能要件を満たすためには
「そして,医薬の用途発明においては,一般に,物質名,化学構造等が示されることのみによっては,その有用性を予測することは困難であり,発明の詳細な説明に,有効量,投与方法,製剤化のための事項がある程度記載されていても,それだけでは,当業者は当該医薬が実際にその用途において利用できるかどうかを予測することは困難であり,当業者が容易にその実施をすることができる程度に記載されているというためには,明細書において,当該物質が当該医薬用途に利用できることを薬理データ又はこれと同視することができる程度の事項を記載して,その医薬を製造することができるだけでなく,出願時の技術常識に照らして,当該用途の医薬として使用できることを当業者が理解できるように記載される必要がある。」
(3)本願発明について実施可能要件を満たすためには
「本願発明は,・・・フォンタン手術を受けた患者における,最大努力時VO2により測定される運動耐容能の改善のため,シルデナフィルに比べ長い半減期を持つPDE5阻害剤の投与がフォンタン手術後に患者の有酸素運動能力の低下を防止又は改善することになるとの仮説の下に,PDE5阻害剤ウデナフィルが様々な病態に対して1日1回治療として有用であり得ることから,フォンタン患者に対してウデナフィルを特定量投与する医薬組成物としたものであり,医薬についての用途発明である。
そうすると,本願発明が実施可能要件を満たすためには,本願明細書の発明の詳細な説明に,ウデナフィル又はその薬剤的に許容可能な塩の,1回当たり87.5mg,1日2回の投与により,フォンタン手術を受けた患者において,最大努力時VO2により測定される運動耐容能の改善に使用できることが,当業者が理解できるように記載されている必要がある。」
(4)本願明細書の記載について
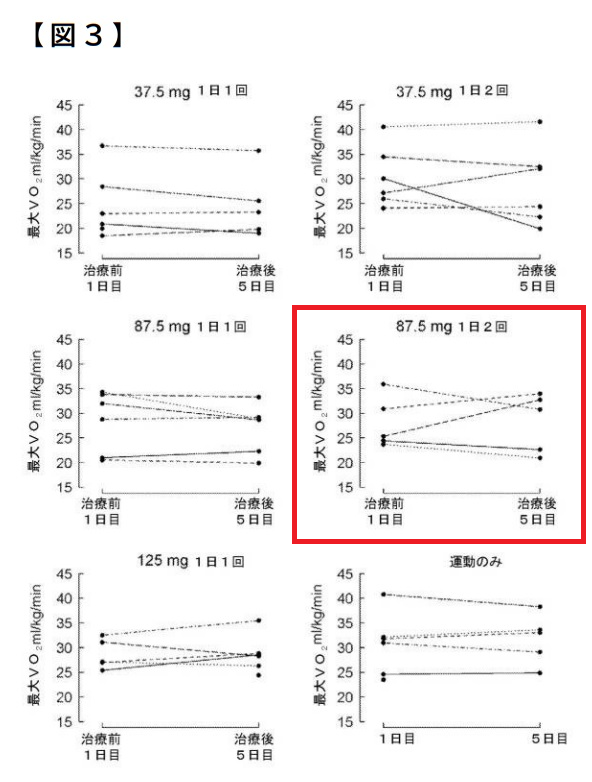
「本件処方が,運動耐容能の改善をもたらし得ることに関して,本願明細書には,具体例として,最大努力時VO2を主要アウトカムとした「運動負荷試験」である実施例3が記載されている(【0180】ないし【0182】,図2,図3)。
当該試験では,フォンタン患者36名を,「投与量37.5mg,1日1回」(コホート1),「投与量37.5mg,1日2回」(コホート2),「投与量87.5mg,1日1回」(コホート3),「投与量87.5mg,1日2回」(コホート4,本件処方),「投与量125mg,1日1回」(コホート5),「対照(薬剤なし)」(コホート6)の6つのコホートに分け(【0157】),投与前の最大努力時VO2(ベースライン測定)及び5日間投与後の最大努力時VO2(追跡調査測定)が測定され,試験結果は,表14,図2及び図3に記載されている。
・・・本願明細書には,PDE5阻害剤の,フォンタン患者における薬効の作用機序として,・・・肺血管抵抗を低下させ,心室機能を改善すること等が記載されており,実際,シルデナフィルに関しては,フォンタン患者の運動能力を改善する重要な薬剤であることが示唆されることも記載されている(【0009】)。」
(5)本件処方により最大努力時VO2が改善したとまで理解はできない
「しかしながら,一方で,同じPDE5阻害剤であっても,タダラフィルのように,フォンタン手術を受けた患者における,最大努力時VO2により測定される運動耐容能が不変であった(【0012】)ものも知られているところ,本願明細書には,ウデナフィルが,PDE5阻害剤の中で,タダラフィルとは異なって,シルデナフィルと同様に,フォンタン手術を受けた患者における,最大努力時VO2により測定される運動耐容能を改善する作用機序は記載されていない。
また,ウデナフィルが,フォンタン手術を受けた患者における,最大努力時VO2により測定される運動耐容能を改善するとの技術常識があるとも認められない。
以上のように,
- 本件処方における変化スコアの平均値は小さい一方で,ばらつきを示す標準偏差が非常に大きな値であること,
- 本件処方を受けた者,そのほかの用量・用法の処方を受けた者,ウデナフィルを投与されなかった者のそれぞれについて,最大努力時VO2が正に変化した場合と負に変化した場合があるが,その理由は明らかでないこと,
- 本件処方においては,むしろ最大努力時VO2が悪化した者の方が多いこと,
- 最大努力時VO2が正あるいは負に変化した例数や程度と,ウデナフィルの投与量や投与回数との間の技術的関係についても明らかでないこと,
- ウデナフィルが,フォンタン手術を受けた患者における最大努力時VO2により測定される運動耐容能を改善することの作用機序が明らかでなく,ウデナフィルが上記のような運動耐容能を改善するとの技術常識があるとも認められないこと
を踏まえると,コホート4において,5名中2名の最大努力時VO2が正に変化したという試験結果のみをもって,ウデナフィルの本件処方により,最大努力時VO2が改善したものであるとまで理解することはできない。
原告は,前記第3の1(1)アのとおり,有意差がないから,医薬としての有効性が認められず,実施可能要件が認められないということにはならないし,ヒト臨床試験を必要とする発明について,特許出願前に有意差を伴う実験データを出すことは非現実的であると主張する。
しかし,本件においては,有意性の問題は措いたとしても,ウデナフィルの本件処方により,最大努力時VO2が改善したこと自体を認め難いことは,前記(2)のとおりである。原告は,実際に症状が大幅に改善した患者がいるとするが(甲11,12),本願明細書には,実施例3における試験結果全体が記載されているのであり,その記載内容を全体としてみれば,フォンタン手術を受けた患者に対し,本件処方が最大努力時VO2により測定される運動耐容能の改善に使用できることを当業者が理解できるとはいえないというべきである。したがって,原告の主張は採用できない。」
4.コメント
(1)医薬の用途発明について実施可能要件が争われた過去判決例との整合
物の発明について実施可能要件を満たすためには、明細書の発明の詳細な説明の記載は、当業者が、その記載及び出願時の技術常識に基づいて、過度の試行錯誤を要することなく、当該発明に係る物を作り、使用をすることができる程度のものでなければならない。
そして、医薬用途発明について実施可能要件を満たすためには、明細書において、当該物質が当該医薬用途に利用できることを薬理データ又はこれと同視することができる程度の事項を記載して、その医薬を製造することができるだけでなく、出願時の技術常識に照らして、当該用途の医薬として使用できること(有用性)を当業者が理解できるように記載される必要がある。
本件での裁判所の判示した医薬の用途発明についての実施可能要件の考え方は、これまでの判決例、例えば以下の最近の判決と同様である。
- 2017.10.13 「アーシャ ニュートリション サイエンシーズ v. 特許庁長官」 知財高裁平成28年(行ケ)10216
- 2015.10.13 「キメリクス v. 特許庁長官」 知財高裁平成27年(行ケ)10021
医薬用途発明に関する過去の判決のうち、記載要件に実験データの記載がどの程度必要かについて争われた事件はこちら「記載要件/引例適格/データは必要か」の項1.(2)を参照。
また、現在の特許・実用新案審査ハンドブック 附属書B第3章 医薬発明には、医薬の用途発明について実施可能要件(第36条第4項第1号)を満たすためには、以下のとおり、「医薬用途を裏付ける実施例として、通常、薬理試験結果の記載が求められる」とされ、薬理試験結果として明らかにされなくてはならない事項が列挙されている。
医薬発明は、一般に物の構造や名称からその物をどのように作り、どのように使用するかを理解することが比較的困難な技術分野に属する発明である。そのため、当業者がその発明を実施することができるように発明の詳細な説明を記載するためには、出願時の技術常識から、当業者が化合物等を製造又は取得することができ、かつ、その化合物等を医薬用途に使用することができる場合を除き、通常、一つ以上の代表的な実施例を記載することが必要である。そして、医薬用途を裏付ける実施例として、通常、薬理試験結果の記載が求められる(審査基準「第 II 部第 1 章第 1 節 実施可能要件」の 3.1.1(3)参照)。
以下に薬理作用を裏付けるに足る薬理試験結果の記載についての具体的な考え方を示す。
(1) 薬理試験結果についての記載の程度
薬理試験結果は、請求項に係る医薬発明における化合物等に薬理作用があることを確認するためのものである。したがって、原則、(i)どの化合物等を、(ii)どのような薬理試験系において適用し、(iii)どのような結果が得られたのか、そして、(iv)その薬理試験系が請求項に係る医薬発明の医薬用途とどのような関連性があるのか、の全てが、薬理試験結果として明らかにされなくてはならない。なお、薬理試験結果は、数値データで記載されることを原則とするが、薬理試験系の性質上、結果を数値データで記載することができない場合には、数値データと同視すべき程度の客観的な記載で許容される場合もある。数値データと同視すべき程度の客観的な記載とは、例えば、医師による客観的な観察結果などの記載である。また、用いられる薬理試験系としては、臨床試験、動物実験あるいは試験管内実験が挙げられる。
上記のとおり、医薬の用途発明についての実施可能要件は、明細書に、薬理試験結果が記載されていること、そしてその結果から当業者が当該医薬用途に使用できることを理解することができるものであることが重要となることは、昔から変わることのない考え方であろう。
(2)医薬用途に使用できることを理解することができるとは
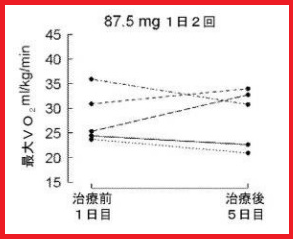 「医薬用途に使用できることを理解することができる」かどうかの判断には、明細書の記載や技術常識に基づいて、「当業者」が、その試験結果をどのように理解するのか、ということを検討する必要がある。
「医薬用途に使用できることを理解することができる」かどうかの判断には、明細書の記載や技術常識に基づいて、「当業者」が、その試験結果をどのように理解するのか、ということを検討する必要がある。
本件では、薬理試験結果が記載されていたが(左記は本件処方の試験結果を示した図3)、審決では、「【表14】の「87.5mg1日2回」欄の測定結果を参照しても、・・・ベースライン測定と追跡調査測定で有意差があるものとは認められず、また、図2の「87.5mg1日2回」欄を参照しても、平均値及び中央値共に、最大努力時VO2が有意差をもって正に変化しているものとは認められない。図3には、被験者ごとのベースライン(治療前1日目)及び治療後5日目の結果が示されているが、当該記載も最大努力時VO2が有意差をもって正に変化しているものとは認められない。」ことを問題視し、「本願明細書には、当業者が、フォンタン手術を受けた患者において、ウデナフィル又はその薬剤的に許容可能な塩を、1回当り87.5mgを1日2回投与した際に、最大努力時VO2により測定される運動耐容能を改善することを理解することができるように記載されているとはいえない。」と判断した。
原告は、「5名のうち2名は,明らかに最大VO2が正に変化しており,本願発明の医薬が有効であったことを示している。・・・5名中2名しか効いていないので,「有意差がない」ということ自体は正しいと考えられる。しかしながら,有意差がないから,医薬としての有効性が認められず,実施可能要件が認められないということにはならない。」と主張した。
しかし、裁判所は、有意性の問題は措いたとしても、記載されている試験結果全体の記載内容を全体としてみれば、5名中2名の最大努力時VO2が正に変化したという試験結果のみをもって、当該医薬用途に利用できるとまで当業者が理解することはできないと判断した。
確かに、明細書に記載されている他の処方での試験結果も含めて見ると、処方により、また患者により、正にも負にも変化しており、データにはばらつきがある。全体としてみれば本件処方も含めて全体として当該医薬用途が有用であるのだろうか・・・と当業者は疑念を持つだろう(有用であると理解できないだろう)と思える。
一方で、フォンタン手術を受けた単心室症患者数自体が少なく、その運動機能を向上させることが極めて困難なことであるという背景がもしあるのであれば、患者5名のうち2名も最大VO2が正に変化したことは、当業者は当該医薬用途が一定の患者には改善効果を示す、すなわち有用である・・・と理解するということはないのだろうか(かなり無理があるが・・・)。
フォンタン手術を受けた単心室症患者の運動機能改善の評価を、フォンタン手術患者の運動機能に関する医療分野の「当業者」はどのように見て理解するかということについて、原告からどの程度の主張がされたのか判決文からは分からないが(少なくとも判決及び審決を見る限り原告によるその点の主張は皆無)、裁判所は、明細書の記載から「当業者は理解することはできない」と判断した。
裁判所の判断に異論はない。一方で、原告側にとってはやはり分の悪い裁判だったとは思うものの、原告側から「当業者」と「技術常識」の観点から結果をどう評価するかについてもっと主張できることはなかったのか・・・と思った次第である。
本願(特願2017-504434号)の米国ファミリーは特許として登録されている(US10,137,128B2、US10,653,698B2)。本願の日本ファミリーとして、分割出願である特願2019-017645号及び特願2021-034295号が審査に係属している。
(3)裁判所は「有意性の問題」には踏み込まず
裁判所は、医薬の用途発明について実施可能要件を満たすために、明細書に記載する試験結果に統計学上の有意差を求めるのかどうかという問題には踏み込まなかった。
日本の特許審査実務では、医薬の用途発明の有用性(医薬の用途発明が使用することができるものであること)を説明するために、明細書に記載されるあらゆる試験結果に統計学上の有意差を厳格には要求してはいないと思われる。
統計学上の有意差検定に頼らずとも、当業者が結果を見て又は技術常識を踏まえてその用途が使えると理解できるケースは当然あるだろうし、そうでないとなれば、有意差を示さなければ効果がある(使える)とはいえない(理解できない)、というケースもあるだろう。
一方、進歩性の判断におえる顕著な効果を示すにあたり、先行技術とその効果を比較する必要がある場合には、統計学上の有意な差の意義が重要となる場合はより多くあるだろう。
参考: 進歩性判断で効果の顕著性の議論に有意差の有無の意義が問題となった事件として例えば以下のものが挙げられる。
参考: 米国特許審査基準MPEP 716.02(b) Burden on Applicant には以下の記載がある。The evidence relied upon should establish “that the differences in results are in fact unexpected and unobvious and of both statistical and practical significance.”

コメント