エルプラット®点滴静注液中のオキサリプラチンから遊離して生じたシュウ酸は、オキサリプラチン製剤特許の発明特定事項「緩衝剤」に当たらないとして、知財高裁はエルプラット®点滴静注液についてのオキサリプラチン製剤特許に係る特許権存続期間延長を認めず。
1.本件の概要
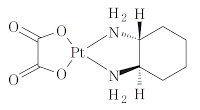 本件(知財高裁令和3年(行ケ)10016; 10017; 10018; 10019; 10020; 10021)は、発明の名称を「オキサリプラチン溶液組成物ならびにその製造方法及び使用」とする特許第4430229号について、白金錯体系抗悪性腫瘍剤エルプラット®点滴静注液(有効成分:オキサリプラチン)(「本件医薬品」)の製造販売承認(「本件処分」)に基づく6つの特許権存続期間延長登録出願(2015-700107; 2015-700108; 2015-700109; 2016-700013; 2016-700014; 2016-700015)をした原告(デビオファーム)が、各拒絶審決の取消を求めた訴訟である。
本件(知財高裁令和3年(行ケ)10016; 10017; 10018; 10019; 10020; 10021)は、発明の名称を「オキサリプラチン溶液組成物ならびにその製造方法及び使用」とする特許第4430229号について、白金錯体系抗悪性腫瘍剤エルプラット®点滴静注液(有効成分:オキサリプラチン)(「本件医薬品」)の製造販売承認(「本件処分」)に基づく6つの特許権存続期間延長登録出願(2015-700107; 2015-700108; 2015-700109; 2016-700013; 2016-700014; 2016-700015)をした原告(デビオファーム)が、各拒絶審決の取消を求めた訴訟である。
裁判所は、本件医薬品は、本件各発明のいずれについても、発明特定事項の全てを備えているといえないから、特許発明の実施に本件処分を受けることが必要であったとは認められないとした本件審決の判断に誤りはない、と判断し、原告の請求を棄却した。
2.本件特許
本件特許4430229号に係る本件各発明は、製薬上安定なオキサリプラチン溶液組成物、癌腫の治療におけるその使用方法、このような組成物の製造方法、およびオキサリプラチンの溶液の安定化方法に関するものであって、従来技術であるオキサリプラチン水溶液の分解による不純物の生成を回避又は有意に減らすことで、2年以上の保存期間中、製薬上安定である、すぐに使える形態のオキサリプラチンの溶液組成物を提供することを目的とするものである。
以下に請求項1を示す。
オキサリプラチン,有効安定化量の緩衝剤および製薬上許容可能な担体を包含する安定オキサリプラチン溶液組成物であって,製薬上許容可能な担体が水であり,
緩衝剤がシュウ酸またはそのアルカリ金属塩であり,
1) 緩衝剤の量が,以下の:
(a)5×10-5 M~1×10-2 M,
(b)5×10-5 M~5×10-3 M,
(c)5×10-5 M~2×10-3 M,
(d)1×10-4 M~2×10-3 M,または
(e)1×10-4 M~5×10-4 M
の範囲のモル濃度である,pH が3~4.5の範囲の組成物,あるいは
2)緩衝剤の量が,5×10-5 M~1×10-4 Mの範囲のモル濃度である,組成物。
3.本件審決の理由
本件審決の理由の要点は、以下のとおり。
4.原告の主張
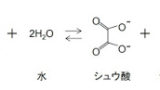
原告は、本件医薬品の有効成分であるオキサリプラチンを水に加えるとオキサリプラチン1分子が水2分子の付加によりシュウ酸1分子が遊離し、平衡状態となって、遊離したシュウ酸は「緩衝剤」としての役割を果たすから、本件審決における「緩衝剤の量」の認定に誤りがあり、本件医薬品は、本件各発明の発明特定事項を全て満たし、その製造販売行為は本件各発明の実施行為に該当する、と主張した。
5.裁判所の判断
裁判所は、本件審決の判断に誤りはないとして、原告の請求を棄却した。
以下に裁判所の判断(知財高裁令和3年(行ケ)10016)から一部を抜粋する。
・・・特許請求の範囲の記載からすると,「緩衝剤」は,溶液に添加したり,混合することを前提とするものと解するのが自然である。また,上記の通り,本件発明1~9及び15~17が,オキサリプラチン,緩衝剤及び担体を含む溶液組成物に係るものであるところ,オキサリプラチンを水に溶解させたときに生じるシュウ酸を緩衝剤と称し,オキサリプラチンや水とは別個の要素として把握するのは不自然である。さらに,「緩衝剤」の「剤」は,「各種の薬を調合すること。また,その薬」(広辞苑〔第6版〕)を意味するから,この一般的な意義に従うと,「緩衝剤」は,「緩衝作用を有する薬」を意味すると解される。そうすると,特許請求の範囲の記載からは,本件各発明における「緩衝剤」に,オキサリプラチンから遊離したシュウ酸は含まれないと解するのが相当である。
・・・特許請求の範囲に記載された用語の意義は,明細書の記載を考慮して解釈するものとされる(特許法70条2項)ので,本件明細書(甲1)の記載をみると,・・・「緩衝剤という用語」について,「オキサリプラチン溶液を安定化し,それにより望ましくない不純物,例えばジアクオDACHプラチンおよびジアクオDACHプラチン二量体の生成を防止するかまたは遅延させ得るあらゆる酸性または塩基性剤を意味する。」(【0022】)として,これを定義付ける記載があり,上記の「剤」の一般的意義に照らしても,「緩衝剤」について,「緩衝作用を有する薬」を意味するものと理解することは,本件明細書の記載にも整合する。
・・・本件各発明が,オキサリプラチンと水からなる従来技術よりも安定したオキサリプラチン溶液組成物を提供することを目的とするものであることに加え,本件明細書には,緩衝剤としてシュウ酸が二水和物として付加される実施例1~17が記載され,オキサリプラチン及び水のみからなる実施例18は従来技術である比較例とされていることなどの本件明細書のその余の記載を考慮しても,「緩衝剤」にオキサリプラチンから遊離したシュウ酸を含むと認めることはできない。
・・・そうすると,「緩衝剤の量」に,オキサリプラチンから遊離したシュウ酸の量を含めるべきであるという原告の主張を採用することはできず,本件発明1の「緩衝剤の量」について,「オキサリプラチン溶液組成物の作製時に,オキサリプラチン及び担体に添加,混合された緩衝剤の量を意味し,オキサリプラチン溶液組成物中のオキサリプラチンが経時的に分解することで生じたシュウ酸の量は,当該『緩衝剤の量』に含まれない」とする本件審決の認定に誤りはない。
・・・本件医薬品は,オキサリプラチンと注射用水のみを成分とし,その他の添加物はないことが認められるから,本件各発明における「緩衝剤」すなわち「オキサリプラチン溶液組成物の作製時に,オキサリプラチン及び担体に添加,混合された緩衝剤」を含有しないというほかないから,本件医薬品は,本件各発明における「緩衝剤の量」の範囲を満たす量の「緩衝剤」を含有しない。
・・・そうすると,本件医薬品を製造・販売することは,本件各発明の実施に当たらないから,本件医薬品には緩衝剤が外から添加されていないとして,特許発明の実施に本件処分を受けることが必要であったとは認められないとした本件審決の判断に誤りはない。
6.コメント
(1)特許延長対象医薬品が発明特定事項を備えているか争われた最近の事例
「本件医薬品が本件発明の発明特定事項を備えていないから、本件発明の実施に本件処分を受けることが必要であったとは認められない」という主張が争われた最近の事件として、2021.03.25 「東レ v. 沢井製薬・ニプロ」 知財高裁令和2年(行ケ)10098事件及びその関連事件がある。

当該事件では、発明特定事項の「有効成分」の解釈が問題となった。現在、同特許権については侵害訴訟が知財高裁に係属中である(10/26記事: レミッチ®用途特許の延長登録に関する審決取消請求事件 最高裁が上告棄却・上告不受理決定したことにより知財高裁の審決取消(延長登録有効)判決が確定)。
(2)本件特許4430229に係る特許発明の技術的範囲を争点とした別事件
本件特許4430229号に係る特許発明の技術的範囲を争点としたいくつかの別事件が既に知財高裁で争われ判断が下されている。
「2017.04.27 「デビオファーム v. サンド」 知財高裁平成28年(ネ)10103」、「2017.04.27 「デビオファーム v. 日医工」 知財高裁平成28年(ネ)10111」、「2017.06.29 「デビオファーム v. 第一三共エスファ・富士フイルムファーマ・ニプロ」 知財高裁平成29年(ネ)10010」、「2017.06.29 「デビオファーム v. 共和クリティケア」 知財高裁平成29年(ネ)10008」、「2017.07.20 「デビオファーム v. 沢井製薬」 知財高裁平成29年(ネ)10015」及び「2017.07.20 「デビオファーム v. 武田テバファーマ」 知財高裁平成29年(ネ)10014」は、デビオファームが、被控訴人ら各製品の生産等が特許権侵害に当たると主張して、それらの生産等の差止及び廃棄を求めた事案であり、知財高裁(第2部)は、
本件発明における「緩衝剤」としての「シュウ酸」は,添加シュウ酸に限られ,解離シュウ酸を含まないものと解されるから,解離シュウ酸を含むのみで,シュウ酸が添加されていない被控訴人各製品は,構成要件・・・の「緩衝剤」を含有するものではなく,したがって,本件発明の技術的範囲に属せず,本件訂正発明の技術的範囲にも属しない
と判断し、デビオファームの控訴を棄却した。




また、「2016.12.08 「日本化薬 v. デビオファーム」 知財高裁平成28年(ネ)10031」、「2017.06.28 「ヤクルト・デビオファーム v. 日本化薬」 知財高裁平成28年(ネ)10112」及び「2017.07.12 「デビオファーム v. ホスピーラ・ファイザー」 知財高裁平成29年(ネ)10009・平成29年(ネ)10023」では、知財高裁(第3部)は、
本件・・・発明における「緩衝剤」としての「シュウ酸」は,添加シュウ酸に限られ,解離シュウ酸を含まないものと解されるから,解離シュウ酸を含むのみで,シュウ酸又はそのアルカリ金属塩が添加されていない被告各製品は,構成要件・・・の「緩衝剤」を含有するものではなく,これらの構成要件を充足しない
と判断し、被控訴人ら各製品は本件特許発明の技術的範囲に属しないとして、デビオファームの控訴を棄却した。



また、「2017.07.11 「デビオファーム v. ナガセ医薬品・日本ケミファ」 知財高裁平成29年(ネ)10034」及び「2017.07.11 「デビオファーム v. マイラン」 知財高裁平成29年(ネ)10013」では、知財高裁(第4部)は、
本件各発明における「緩衝剤」としての「シュウ酸」は,添加シュウ酸に限られ,解離シュウ酸を含まないものと解されるところ,解離シュウ酸を含むのみで,シュウ酸が添加されていない被告製品は・・・本件各発明の技術的範囲に属するものではないから,控訴人の請求はいずれも棄却すべき
と判断し、請求を棄却した原判決は結論において相当であるから、デビオファームの控訴を棄却した。


上記過去の事件と本件とでは、対象が「被疑侵害品」であるか「特許権存続期間延長登録出願の処分の対象となった物(本件医薬品)」であるかの違いはあるものの、同じ特許発明の技術的範囲の属否を争う点では共通する事件である。
上記過去の事件における知財高裁判決は全て、「本件発明における「緩衝剤」としての「シュウ酸」は、添加シュウ酸に限られ、解離シュウ酸を含まないものと解されるから、解離シュウ酸を含むのみで、シュウ酸が添加されていない製品は、構成要件の「緩衝剤」を含有するものではなく、したがって、本件発明の技術的範囲に属しない」と判断しており、本件での裁判所の判断はこれらと整合するものだった。
このように、本件発明における「緩衝剤」としての「シュウ酸」は添加シュウ酸に限られるという認定が過去判決でなされている状況では、エルプラット®点滴静注液(本件医薬品)中のシュウ酸も「解離シュウ酸」であって「添加シュウ酸」ではないわけであるから、本事件でも負け戦がかなり濃厚であったはずである。
それでも敢えて本件拒絶審決取消訴訟まで提起して争ったデビオファームの心理として、後発医薬品を本件特許に係る特許権で抑えることはできなかったが、せめてエルプラット®点滴静注液(本件医薬品)だけでも保護するものとして特許権存続期間を延長できれば、日本において本件医薬品の独占的ライセンスを与えているヤクルト本社から(後発医薬品参入後、売上は減少してはいるとはいえ)少しでも長くロイヤルティ収入を取得できるといった狙いがあったのかもしれない(ライセンス契約内容が明らかでないためこの点はあくまで想像である)。
本件特許4430229の出願日は1999年2月25日であり、20年満了日は2019年2月25日。もし本件で延長登録が認められていれば、本件特許に係る延長された特許権により、最長で2024年までエルプラット®点滴静注液はカバーされるはずだった。
ヤクルト本社の医薬事業は、抗悪性腫瘍剤エルプラット®の売上に大きく依存しているが、エルプラット®の売上は、後発医薬品の上市後減少している(ヤクルト本社2021年3月期有価証券報告書より)。


コメント