・・・特許6301524(一定の服薬歴がある患者を対象とする医薬用途発明)の進歩性を認めた審決を取り消す。
前回記事:「骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③」

1.はじめに
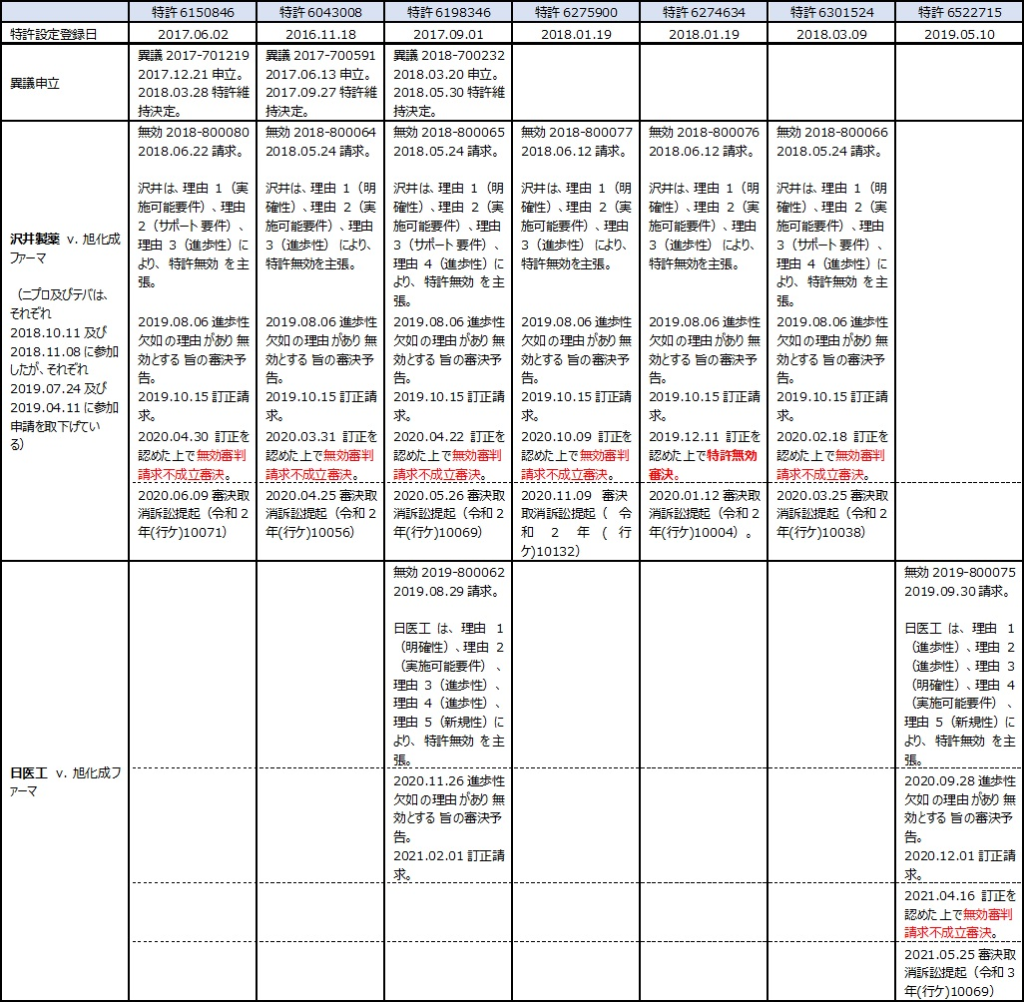
旭化成ファーマが製造販売する週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」(以下、「テリボン®」と略す。)のジェネリック参入障壁となっていると考えられるのが、テリパラチドの週1回投与を特徴とする発明に係る7つの特許(存続期間満了は2030年9月8日)である(表1)。
旭化成ファーマは、2021年6月21日付の「【謹告】テリパラチド酢酸塩に関する特許権について」(日刊薬業)において、テリボン®を製造販売しており、テリパラチド酢酸塩を有効成分とする骨粗鬆症治療剤ないし予防剤に関する特許権7件(日本特許第6522715号、同第6150846号、同第6043008号、同第6198346号、同第6275900号、同第6274634号、同第6301524号)を保有していると発信している(テリパラチド酢酸塩に関する特許権について(3))。
いずれの特許に対してもジェネリックメーカーが無効審判を請求し、それらいずれの事件も審決の取消しを求めて知財高裁での訴訟にまで発展した(表2)。最近になり、それら判決が次々と出てきている。
本記事では、これまでの3つの記事:
- 特許第6274634号についての記事「2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①」
- 特許第6043008号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」
- 特許第6275900号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③」
に続く4回目として、特許第6301524号の無効審判請求事件を判断した知財高裁判決(知財高裁令和2年(行ケ)10038)について紹介する。この事件は、旭化成ファーマの7つの特許の無効審判請求のうち、特許発明の進歩性を認めた審決の取消しを求めて沢井製薬が提訴したものである。
結論としては、進歩性は否定され、審決取消し判決となったが、本件発明は、一定の服薬歴がある患者を対象とする医薬用途に関するものであり、侵害事件に発展はしていないが、患者の服用歴に関係なく使用される対象製品(ジェネリック)の製造販売行為に対して、製品の一部が発明の技術的範囲に属することを理由として(製品の一部は範囲に属しないにもかかわらず)差止めを請求することは認められるのか、について考えさせられる興味深いクレームであった。その点については、参考文献とともに後述したい。

2.背景
本件(知財高裁令和2年(行ケ)10038)は、旭化成ファーマ(被告)が特許権の設定登録を受けた発明の名称を「骨粗鬆症治療剤ないし予防剤」とする特許第6301524号に対して沢井製薬(原告)がした無効審判請求(無効2018-800066号事件)を請求不成立とした審決の取消訴訟である。争点は、訂正に関する判断の誤りの有無、進歩性に関する判断の誤りの有無である。
本件発明(訂正前請求項1):
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎
縮度が萎縮度I度以上である
※本件発明中の下線部は、本件訂正事項に対応する部分である。
本件訂正発明(訂正後請求項1):
骨折抑制のための骨粗鬆症治療剤ないし予防剤。
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である
| 本件発明 | 本件訂正発明 | 甲7発明 | 一致点/相違点 | |
|---|---|---|---|---|
| 1 | 1回当たり200単位のPTH(1-34)又はその塩が週1回投与されることを特徴とする,PTH(1-34)又はその塩を有効成分として含有する,骨粗鬆症治療剤ないし予防剤であって, | 1回当たり200単位のPTH(1-34)又はその塩が週1回投与されることを特徴とする,PTH(1-34)又はその塩を有効成分として含有する,骨粗鬆症治療剤ないし予防剤であって, | 1回当たり200単位のPTH(1-34)酢酸塩が週1回投与されることを特徴とする,PTH(1-34)酢酸塩を有効成分として含有する,骨粗鬆症治療剤ないし予防剤であって, | 一致 |
| 2 | 下記(1)~(3)の全ての条件を満たす骨粗鬆症患者であり,かつ,骨粗鬆症治療薬として,L-アスパラギン酸カルシウム,アルファカルシドール,塩酸ラロキシフェン,エルカトニン,メナテトレノン,及び乳酸カルシウムからなる群より選択される1以上の薬剤の服薬歴を有する骨粗鬆症患者を対象とする,骨折抑制のための骨粗鬆症治療剤ないし予防剤。 (1)年齢が65歳以上である (2)既存の骨折がある (3)骨密度が若年成人平均値の80%未満である,および/または,骨萎 縮度が萎縮度I度以上である | 下記(1)~(3)の全ての条件を満たす骨粗鬆症患者であり,かつ,他の骨粗鬆症治療薬の服薬歴がL-アスパラギン酸カルシウム,アルファカルシドール,及び塩酸ラロキシフェンからなる群より選択される1つの薬剤である骨粗鬆症患者を対象とする, 骨折抑制のための骨粗鬆症治療剤ないし予防剤。 (1)年齢が65歳以上である (2)既存の骨折がある (3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である | 厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被検者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者であって,2mg/dlより高い血清クレアチニン又は30mg/dlより高いBUNによって示される腎機能が低下している患者は除外された患者を対象とする, | 相違点1 |
| 3 | 骨折抑制のための | 骨折抑制のための | (そのような特定がない) | 相違点2 |
| 4 | 骨粗鬆症治療剤ないし予防剤 | 骨粗鬆症治療剤ないし予防剤 | 骨粗鬆症治療剤ないし予防剤 | 一致 |
本件審決は、
「他の骨粗鬆症治療薬の服薬歴がL-アスパラギン酸カルシウム,アルファカルシドール,及び塩酸ラロキシフェンからなる群より選択される1つの薬剤である」(以下、「本件条件(4)」という。)に係る本件訂正は、訂正の要件を満たすと判断したうえで、
- 本件訂正発明の「200単位のPTH(1-34)」は明確であるから、本件訂正発明は明確性要件に違反しない
- 当業者は本件明細書の記載及び出願時の技術常識に基づいて本件訂正発明を実施することができるから、本件訂正発明の発明の詳細な説明の記載は実施可能要件に違反しない
- 本件明細書は、当業者の技術常識も考慮すると、本件訂正発明の課題が解決できると認識できるように記載されているから、サポート要件に違反しない
- 本件訂正発明は、「甲7文献」(「ヒト副甲状腺ホルモン(1-34)の骨粗鬆症に対する間欠週1回投与の効果:3種類の投与量を用いた無作為化二重盲検前向き試験」 Osteoporosis International vol. 9, p296–306 (1999))に記載された発明(以下「甲7発明」という。)及び本件発明の特許要件判断の基準日(平成22年9月8日。以下「本件基準日」という。)当時の技術常識を踏まえても当業者が容易に発明をすることができたものとはいえない
と判断した。
3.裁判所の判断
(1)取消事由1(本件訂正に関する判断の誤り)の有無について
原告は、
本件訂正は,新規事項を追加するものである。
本件明細書には,本件発明が骨粗鬆症治療薬1剤のみの服薬歴を有する患者を対象とする発明であることを示した記載は全くない。これに対し,本件訂正発明は,服薬歴を本件3薬剤のいずれか1つとするものであるが,①本件訂正前薬剤の服薬歴があれば顕著な骨折抑制効果を奏するとの発明と②本件3薬剤のうちのいずれか1剤で顕著な骨折抑制効果を奏するとの発明とは,技術的意義を全く異にしており,本件訂正は,新たな技術的事項を導入するものである。
したがって,本件訂正を訂正要件に適合するとした本件審決の判断には,誤りがある。
と主張した。
しかし、裁判所は、以下のとおり、本件訂正は新規事項追加には該当しないから、本件訂正を訂正要件に適合するとした本件審決の判断には誤りはないと判断した。
本件訂正の内容は,・・・本件条件(4)に係る,服薬歴を有する骨粗鬆症治療薬を,本件訂正前薬剤の6剤のうちいずれか1つ又は複数の組合せとしていたものを,本件訂正前薬剤に含まれる本件3薬剤の3剤のうちいずれか1つと限定したものである。
・・・本件明細書には,服薬歴に係る他の骨粗鬆症治療薬について,本件訂正前薬剤が例示された上で,「他の骨粗鬆症治療薬は単独または併用して投薬実績があってもよい」(【0062】)として,他の骨粗鬆症治療薬が1剤のみであってもよいと記載されているから,本件訂正は,当初から開示されていた,本件3薬剤を除く薬剤の服薬歴及び本件3薬剤の併用態様による服薬歴を有する患者を対象とする部分を単純に除外するものにすぎず,本件明細書,特許請求の範囲又は図面に記載した事項の範囲内の訂正であり,新規事項を追加するものとはいえない。
・・・本件明細書には,他の骨粗鬆症治療薬が1剤のみであってもよいと記載されているのであり,そうである以上,本件訂正により本件訂正発明と本件発明の技術的意義が異なることにもならないから,上記原告の主張を採用することはできない。
(2)取消事由5(進歩性に関する判断の誤り)の有無について
裁判所は、甲7発明に接した当業者が、投与対象患者を本件条件(1)、(2)及び(3)を全て満たす患者と特定すること、そして、甲7発明の骨粗鬆症治療剤の投与対象患者を本件条件(4)を満たす者とすることは、当業者にとって格別困難を要することとはいえず、本件発明の構成は容易想到であると判断した。
甲7文献の記載事項や技術常識を踏まえれば,甲7発明の骨粗鬆症治療薬の投与対象患者が他の骨粗鬆症治療薬の服用を受けている蓋然性があることは当業者には直ちに判明するのであり,甲7発明に接した当業者が,投与対象患者の他の骨粗鬆症治療薬の服薬歴に着目することは,当業者が自然に行うべきことと理解できるのであるから,甲7文献の試験において骨粗鬆症治療薬を投与した対象患者が服薬していた具体的な骨粗鬆治療薬が不明であるからといって,甲7文献に接した当業者が甲7発明の骨粗鬆症治療薬の投与対象患者について,その服薬していた骨粗鬆治療薬を特定しようとする動機付けがなくなるという関係にあるわけではない。そして,PTHを投与する患者の前治療薬が本件3薬剤に限らないからといって,服薬歴とする骨粗鬆症治療薬の中から骨粗鬆症治療薬として一般的な本件3薬剤を選択することができなくなるという関係にあるわけでもない。そうすると,・・・本件基準日において(塩酸ラロキシフェンは既に販売が開始されている〔甲5 27〕。),甲7発明の骨粗鬆症治療薬について,甲7文献の記載や技術常識を踏まえて,本件3薬剤の服薬歴のある患者を投与対象患者とすることは困難なこととはいえない(結局のところ,・・・本件条件(4)には,同一条件のプラセボ投与群に比して生じる骨折抑制効果の発現が妨げられない骨粗鬆症治療薬の服薬歴がある者を投与対象者としたという以上の格別の技術的意義を見出すことはできないのであるから,従来は,本件3薬剤の服薬歴のある患者については同一条件のプラセボ投与群に比して生じる骨折抑制効果の発現が妨げられると考えられていたなどといった事情が認められない限りは,本件条件(4)を加えたことに進歩性が認められる余地はないともいえる。)。
これに対し、被告は、本件訂正発明は、本件3条件を全て満たす患者に対する顕著な骨折抑制効果(効果①)、本件条件(4)の服薬歴がある患者に投与すると、本件条件(4)の服薬歴のない患者に対するよりも骨折抑制効果がより増強される効果(効果②)を奏し、これらの効果は、当業者が予測をすることができなかった顕著な効果を奏するものである旨主張した。
しかし、裁判所は、
- 主張された骨折抑制効果(効果①)については、低リスク患者において有意差がなかったとの結論が少ない症例数をもとに導かれたものである(症例数が不足していることによることを否定できない)ことから優れた効果であることを理解することができず、効果①は、本件明細書の記載に基づかないものというべきである
- 本件明細書の記載から、高リスク患者に対するPTHの骨折抑制効果が、低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することができず、また、これを推認することもできない以上、効果①は対外的に開示されていないものであるから、上記実験成績証明書を採用して、効果①を認めることは相当でない
- 仮に、上記実験成績証明書を参酌するにしても、本件3条件の全てを満たす患者(高リスク患者)のグループと、本件3条件の全部又は一部を満たさない患者(低リスク患者)のグループのうちごく一部のグループとを比較しているものにすぎないから、本件3条件の効果が明らかになっているとはいえない。
- 効果②は本件明細書からうかがうことのできない効果である
こと等からすれば、効果①及び効果②を認めることはできないし、ましてや、予測することのできない顕著な効果が認められるなどといった余地はないと判断した。
以上のとおり、裁判所は、相違点1が容易に想到できないと認定した本件審決の判断には誤りがあるから、相違点2について検討するまでもなく本件発明1(原文ママ)の進歩性を認めた本件審決の判断に誤りがあり、進歩性に関する判断の誤りについての取消事由には理由があるから、その他について判断するまでもなく、本件審決を取り消した。
4.コメント
(1)7訴訟中、旭化成ファーマの0勝4敗(残るは3判決)
本事件で争われた特許第6301524号は元をたどると特願2011-530844(出願日2010年9月8日; 再表2011/030774; WO2011/030774)を原出願とするものであり、テリパラチドの週1回投与を特徴とする発明に係る7つの特許により構成される特許ファミリーのうちのひとつである。
同日に以下のファミリー特許についての判決も出されており、進歩性を否定し、いずれも旭化成ファーマの敗訴という点で共通する。
- 2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004・・・特許第6274634号(参照:2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056・・・特許第6043008号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132・・・特許第6275900号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判③)
コメントについては上記記事を参照してほしい。コメントの主な点は以下のとおり。
- 旭化成ファーマの敗因
- 効果の程度についての判断に参酌できる観点
- 進歩性のための明細書記載要件
- 特許庁は進歩性を認めていた
- 主張立証責任を負う出願人は比較試験の妥当性を慎重に検討すべき
- 欧州特許庁での審査
(2)被告製品(対象患者)の一部が発明の技術的範囲に属する場合の問題点
本件訂正発明は「他の骨粗鬆症治療薬の服薬歴がL-アスパラギン酸カルシウム,アルファカルシドール,及び塩酸ラロキシフェンからなる群より選択される1つの薬剤である骨粗鬆症患者を対象とする」(本件条件(4))をひとつの構成要件とする「骨粗鬆症治療剤ないし予防剤」である。
旭化成ファーマは、2021年6月21日付の「【謹告】テリパラチド酢酸塩に関する特許権について」(日刊薬業)において、テリボン®を製造販売しており、テリパラチド酢酸塩を有効成分とする骨粗鬆症治療剤ないし予防剤に関する特許権として本件特許第6301524号を含む7件を保有すると述べていることから、本件特許に係る特許権に基づき、テリボン®のジェネリックの製造・販売行為に対して権利行使は可能であると考えていると思われる。
そして、本件判決において認定されたとおり、
本件3薬剤はいずれも一般的な骨粗鬆症治療薬で・・・L-アスパラギン酸カルシウムはカルシウム製剤であり,・・・アルファカルシドール・・・は活性型ビタミンD3製剤であり,・・・塩酸ラロキシフェン・・・は,選択的エストロゲン受容体モジュレーター(SERM)であり,・・・甲7文献の記載事項や技術常識を踏まえれば,甲7発明の骨粗鬆症治療薬の投与対象患者が他の骨粗鬆症治療薬の服用を受けている蓋然性があることは当業者には直ちに判明する
のであるから、骨粗鬆症患者がこれら3剤の服薬歴を有する蓋然性は一定程度あると思われる。
しかし、テリボン®の添付文書には、「L-アスパラギン酸カルシウム、アルファカルシドール、又は塩酸ラロキシフェンの服薬歴がある患者」に同剤の投与を限定する旨の記載は一切ない。
テリボン®は、服薬歴に関係なく骨粗鬆症患者を対象とするものである。従って、当該服薬歴のない患者に投与されたり(発明の技術的範囲に属しなかったり)、当該服薬歴のある患者に投与されたり(発明の技術的範囲に属したり)するかもしれない。
以下のとおり、製品の一部が発明の技術的範囲に属する場合に差止めは認められるかどうかについて考察している論文や、医薬品添付文書の記載等に基づいて充足論が争われた事件等がある。
- 新藤圭介 「複数の被告製品の一部が数値限定発明の技術的範囲に属する場合に差止めの必要性を否定した事例」 知的財産法政策学研究 Vol.43, p253-275 (2019)
- 高石秀樹 「数値限定発明の充足論,明確性要件(複数の測定条件が存在する場合,その他の類型について)」 パテント Vol.71, No.6, p21-32 (2018)
- 高石秀樹 「『数値限定発明の充足論,明確性要件』への質問に対する回答」 パテント Vol.71, No.10, p141-145 (2018)
- 2016.07.28 「X v. 興和・興和創薬」 知財高裁平成28年(ネ)10023 (原審: 2016.01.28 「X v. 興和・興和創薬」 東京地裁平成26年(ワ)25013)・・・本件発明の本質と「医師のさじ加減」は異なると判断した。
- 2019.05.29 「ジェネンテック v. サンド・協和発酵キリン」 東京地裁平成29年(ワ)44053・・・添付文書の記載等から構成要件を充足するとはいえないと判断した。
- 2006.11.21 「X v. 大塚製薬」 知財高裁平成17年(ネ)10125・・・「本件製剤の販売の中には,本件製剤が・・・本件用途発明の「PTCA後やステントの血管内留置による冠状動脈再閉塞の予防および治療」の用途に使用されるものとして販売されたものが一定量含まれているものと認めるのが相当であり,そうすると,本件においては,その一定量の販売の限度で,本件用途発明に係る「PTCA後やステントの血管内留置による冠状動脈再閉塞の予防および治療剤」なる発明の実施があったというべきである。そして,本件製剤の後発品を製造販売する会社を含め第三者において,その後発品等を「PTCA後やステントの血管内留置による冠状動脈再閉塞の予防および治療」の用途に使用されるものとして販売することは,本件用途特許権の効力により禁止されているというべきである」
- 1992.10.23 東京地裁平成2年(ワ)12094・・・「仮に被告らの製剤品にアレルギー性喘息の予防剤以外の用途があるとしても、被告らは、被告らの製剤品について、アレルギー性喘息の予防剤としての用途を除外する等しておらず、右予防剤としての用途と他用途とを明確に区別して製剤販売していないのであるから、被告らが、その製剤品についてアレルギー性喘息の予防剤以外の用途をも差し止められる結果となったとしてもやむを得ないものといわざるをえない。」
仮に、テリボン®のジェネリックが承認され、本件特許に係る特許権侵害訴訟に発展したと想定した場合、患者の服薬歴に関係なく骨粗鬆症治療薬として販売されるテリボン®のジェネリックの製造販売行為に対して、患者の服薬歴を限定した本件発明に係る特許権による差止め請求は認められるのか、すなわち、そのジェネリックの一部がその発明の技術的範囲に属すること(当該服薬歴のある患者を対象の一部に含むものであること)を理由として(製品の大部分は範囲に属しないにもかかわらず)差止め請求は認められるのか(範囲に属しない製品が大部分を占めているにもかかわらず差し止められる結果となったとしてもやむを得ないのか)、という点には、もしかすると議論があるかもしれない。
しかし、このようなケースは、ジェネリックメーカーが当該服薬歴のある患者を対象に含むことになるおそれがあることを知りながら敢えてジェネリックの承認を得て故意にそれを製造・販売しようとする行為であることから、たとえ製品の大部分が当該服薬歴のない患者を対象に服用されるものだとしても、一定程度当該服薬歴のある患者を含むことになるおそれがあるのであれば、やはり当該ジェネリックの製造・販売に対して差止めは認められるべきであるように思われる。
個人的な興味としては、差止請求訴訟にまで発展してほしい事件であった。
5.おわりに
骨粗鬆症治療剤テリボン®は旭化成ファーマの主力品である。
ジェネリック参入の障壁となっていると考えられる本件特許について発明の進歩性を認めた審決を取消した今回の知財高裁判決は、まだ判決が出されていない他の3つのファミリー特許で争われている進歩性の判断、さらにそれらの結果次第ではジェネリック参入可能性に極めて大きなインパクトを与えることになるかもしれない。
残り3つの裁判の行く末も目が離せない。
次回記事「骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判⑤」


コメント