・・・予測をすることができなかった顕著な効果を奏するものであると認めることはできない。特許6274634は進歩性なしと判断された。
1.はじめに
旭化成ファーマ(株)は、ヒト副甲状腺ホルモン(PTH)の活性部分であるN端側の1-34ペプチド断片であるテリパラチド(Teriparatide)酢酸塩を有効成分とする週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」を製造販売している(再審査期間は終了、2011年9月26日~2017年9月25日(6年))。
旭化成(株)の2020年度決算説明資料(2021年5月13日)によるとテリボン®の国内売上高2019年度実績は275億円、2020年度実績は310億円である(皮下注用56.5μgだけでなく、皮下注28.2µgオートインジェクターも含むと思われる)。
2019年2月に、子会社の旭化成シンメッドが、テリボン®皮下注用56.5μgのオーソライズド・ジェネリック(AG)の承認を得ているが(薬価未収載)、他のジェネリックメーカーからテリボン®のジェネリックは今だ承認されていない。
そのジェネリック参入の障壁となっていると考えられるのがテリパラチドの週1回投与を特徴とする(特定の患者条件等で限定された)発明に係る7つの特許権の存在である(表1)。これら特許は元をたどると特願2011-530844(出願日2010年9月8日; 再表2011/030774; WO2011/030774)を原出願とするものであり、いずれも存続期間満了日は2030年9月8日である。

しかし、いずれの特許に対してもジェネリックメーカーが無効審判を請求し、それらいずれの事件も審決の取消しを求めて知財高裁での訴訟にまで発展している(表2)。今年中には、判決が次々と出てくると見込まれていた。
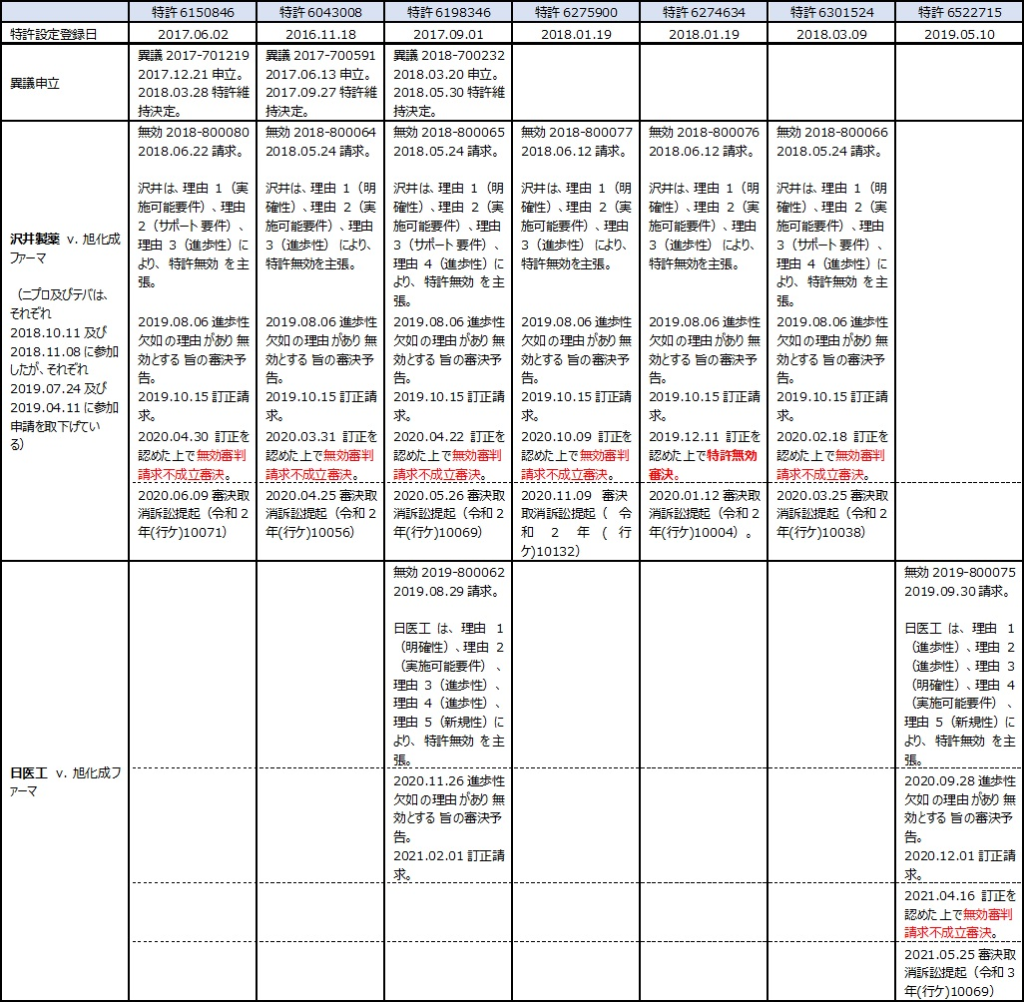
本記事では、それら事件のうちのひとつである特許第6274634号の無効審判請求事件を判断した知財高裁判決(知財高裁令和2年(行ケ)10004)について紹介する。これは7つの特許群のうち、唯一、無効審決となった事件であり、その取消しを求めて旭化成ファーマが提訴したものである。
過去参考記事: テリパラチド酢酸塩に関する特許権について(3)

2.背景
本件(知財高裁令和2年(行ケ)10004)は、旭化成ファーマ(原告)が特許権の設定登録を受けた発明の名称を「骨粗鬆症治療剤ないし予防剤」とする特許第6274634号に対して沢井製薬(被告)がした無効審判請求(無効2018-800076号事件)についての特許無効審決の取消訴訟である。争点は、進歩性に関する判断の誤りの有無である。
本件発明(訂正後請求項1):
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である
(4)クレアチニンクリアランスが50以上80未満ml/minである腎機能障害を有する。
本件審決は、「甲7文献」(「ヒト副甲状腺ホルモン(1-34)の骨粗鬆症に対する間欠週1回投与の効果:3種類の投与量を用15 いた無作為化二重盲検前向き試験」 Osteoporosis International vol. 9, p296–306 (1999))に記載された発明(以下「甲7発明」という。)及び本件発明の特許要件判断の基準日(平成22年9月8日。以下「本件基準日」という。)当時の技術常識から、本件発明は当業者が容易に発明をすることができたものであると判断した。
| 本件発明 | 甲7発明 | 一致点/相違点 | |
|---|---|---|---|
| 1 | 1回当たり200単位のヒトPTH(1-34)又はその塩が週1回投与されることを特徴とする,ヒトPTH(1-34)又はその塩を有効成分として含有する,骨粗鬆症治療剤ないし予防剤であって, | 1回当たり200単位のヒトPTH(1-34)又はその塩が週1回投与されることを特徴とする,ヒトPTH(1-34)又はその塩を有効成分として含有する,骨粗鬆症治療ないし予防剤であって, | 一致 |
| 2 | 下記(1)~(4)の全ての条件を満たす骨粗鬆症患者を対象とする, ・・・ (1)年齢が65歳以上である (2)既存の骨折がある (3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である (4)クレアチニンクリアランスが50以上80未満ml/minである腎機能障害を有する。 | 厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被検者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者であって,2mg/dlより高い血清クレアチニン又は30mg/dlより高いBUNによって示される腎機能が低下している患者は除外された患者を対象とする, | 相違点1 |
| 3 | 骨折抑制のための | (そのような特定がない) | 相違点2 |
| 4 | 骨粗鬆症治療剤ないし予防剤 | 骨粗鬆症治療剤ないし予防剤 | 一致 |
3.裁判所の判断
裁判所は、相違点1及び相違点2に係る本件発明の構成は、いずれも当業者が容易に想到し得たものであるから、本件発明が容易に発明できると判断した本件審決の判断には誤りがなく、取消事由は理由がないとして、旭化成ファーマ(原告)の請求を棄却した。
(1)相違点1の容易想到性について
本件条件(1)、(2)及び(3)(以下、「本件3条件」という。)について、裁判所は、
骨粗鬆症は,加齢とともに発生が増加するとの技術常識があり,高齢者は加齢を重ねた者であるのは明らかであるところ,高齢者を65歳以上の者とすることは常識的なことであり,・・・したがって,これらを参酌し,骨粗鬆症による骨折の複数の危険因子として,低骨密度及び既存骨折に並んで年齢が掲げられていることに着目して投与する骨粗鬆症患者を65歳以上として,本件条件(2)及び本件条件(3)に加えて本件条件(1)のように設定することはごく自然な選択であって,何ら困難を要しない。
として、甲7発明に接した当業者が、投与対象患者を本件3条件を全て満たす患者と特定することは、当業者に格別の困難を要することではない、と判断した。
そして、本件条件(4)についても、裁判所は、
骨粗鬆症と腎機能障害の罹患率はいずれも加齢とともに増加することや,大規模な疫学研究では骨粗鬆症女性の85%が軽度から中等度の腎機能障害を有していたことが知られていたから・・・,重度の腎機能障害患者を除くと明記された甲7文献の記載に接した当業者であれば,甲7発明の投与対象患者に軽度又は中等度の腎機能障害を有する患者が相当程度含まれていると認識することは明らかといえる。さらに,・・・骨粗鬆症治療薬についても腎機能障害を有する患者における安全性の確認が求められていたことが明らかであるから,甲7発明に接した当業者が,投与対象患者の腎機能に着目することは,当業者が当然に行うべきこととして格別なものではない。・・・そして,・・・甲7発明の投与対象患者の中から,腎機能障害の程度をクレアチニンクリアランスの値で表して,「50以上80未満ml/min」の者をその投与対象とすることは,当業者であれば何ら困難を要しないものである。
として、甲7発明の骨粗鬆症治療剤の投与対象患者を本件条件(4)を満たす者とすることは、当業者にとって格別困難を要することとはいえない、と判断した。
原告は、本件4条件を一体として、その技術的意義が判断されなければならない等主張したが、裁判所は、
本件3条件と本件条件(4)とはその目的を異にする独立の条件であると理解するのが相当であるし,・・・本件基準日における技術常識に照らせば,甲7発明に接した当業者が投与対象患者をこれらの条件を全て満たす患者とすることに格別の困難はないところ,本件3条件の組み合わせが客観的観点からその選択において格別なものである,あるいは,他の骨折リスク因子等も含めた様々な組み合わせが想定される中で,本件3条件を組み合わせること自体に特別の意味合いがあると認めるに足りる証拠はない(原告が主張する層別解析は,後述するように,あくまで本件3条件の全てを満たす患者(高リスク患者)のグループと,本件3条件の全部又は一部を満たさない患者(低リスク患者)のグループのうちごく一部のグループとを比較するものにすぎず,また,その結果自体も原告主張の顕著な効果が認められると即断できるものではない。)。
として、上記原告主張は採用することができない、と判断した。
(2)相違点2の容易想到性について
裁判所は、
甲7文献には,「ここに挙げた薬剤を投与することによって骨密度(BMD)が増加するため,骨折予防は飛躍的に進歩した」・・・と骨密度の増加が骨折予防に寄与することが記載され,その上で,48週で骨密度を8.1%増大させたことが開示されているのであるから・・・,甲7発明の骨粗鬆症治療剤を骨折抑制のためのものとすることは,当業者が容易に想到できたものである。
と判断した。
(3)効果について
裁判所は、発明の効果が予測できない顕著なものであるかについて最高裁判決を引用したうえで、その判断に際して引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌することは許されると解した。
発明の効果が予測できない顕著なものであるかについては,当該発明の特許要件判断の基準日当時,当該発明の構成が奏するものとして当業者が予測することのできなかったものか否か,当該構成から当業者が予測することのできた範囲の効果を超える顕著なものであるか否かという観点から検討する必要がある(最高裁判所平成30年(行ヒ)第69号令和元年8月27日第三小法廷判決・集民262号51頁参照)。もっとも,当該発明の構成のみから予測できない顕著な効果が認められるか否かを判断することは困難であるから,当該発明の構成に近い構成を有するものとして選択された引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌することは許されると解される。
裁判所は、本件発明の構成は容易想到であると判断したわけであるが、これに対し、原告は、本件発明は、当業者が予測をすることができなかった以下のような顕著な効果を奏するものである旨主張した。
- 本件3条件を全て満たす患者に対する顕著な骨折抑制効果・・・効果①
- 本件条件(4)を満たす患者に対する副作用発現率と血清カルシウムに関する安全性が腎機能が正常である患者と同等であるという効果・・・効果②
- BMD増加率が低くてもより低い骨折相対リスクが得られるとの効果・・・効果③
しかし、裁判所は、これらの効果について検討しても、本件発明が、当業者が予測をすることができなかった顕著な効果を奏するものであると認めることはできないと判断した。
以下に、効果①②③についての裁判所の判断を抜粋する。
ア 効果①について
効果①を確認するためには,高リスク患者に対する骨折抑制効果と低リスク患者に対する骨折抑制効果とを対比する必要があるが,・・・実施例 1 をみても,高リスク患者に対するPTHの骨折抑制効果が,低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することはできず,さらに,本件明細書のその他の部分をみても,高リスク患者に対するPTHの骨折抑制効果が,低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することはできず,ましてや,200単位週1回投与群に関し,高リスク患者における骨折発生抑制が,低リスク患者における骨折発生抑制よりも優れていると結論付けることはできない。以上によれば,効果①は,本件明細書の記載に基づかないものというべきである。
原告は,効果①を明らかにするものとして,甲56証明書及び甲57証明書を提出する。
しかしながら,本件明細書の記載から,高リスク患者に対するPTHの骨折抑制効果が,低リスク患者に対するPTHの骨折抑制効果よりも高いということを理解することができず,また,これを推認することもできない以上,効果①は対外的に開示されていないものであるから,上記各実験成績証明書を採用して,効果①を認めることは相当ではない。
仮に,上記各実験成績証明書を参酌するにしても,本件3条件の全てを満たす患者(高リスク患者)のグループと,本件3条件の全部又は一部を満たさない患者(低リスク患者)のグループのうちごく一部のグループとを比較しているものにすぎないから,本件3条件の効果が明らかになっているとはいえない。
・・・
以上によれば,いずれにしても効果①を認めることはできないから,その他の点について判断するまでもなく,効果①を予測することのできない顕著な効果という余地はない。
イ 効果②について
甲10文献の記載によると,PTH製剤であるテリパラチドの20μg又は40μgの連日投与について,PTHによる腎臓に関連する有害事象の発生率は,腎機能が正常,軽度障害,中等度障害のサブグループのいずれでも一貫しており,また,軽度から中等度の腎機能障害者と健常被験者の間には,あらゆる薬物動態パラメータに有意な差がないことが知られており,薬物動態パラメータは,薬物の薬理効果や有害反応の発現強度の指標であるといえるから,PTHに関して軽度又は中等度の腎機能障害を有する者と腎機能が正常である者との間には,薬物の有害反応の発現強度も異ならないものと理解できる。
また,原告は,甲7文献では,腎機能正常者と腎機能障害者との間での比較は行われておらず,腎機能障害者においてPTH200単位週1回投与の際の安全性は不明であった旨主張するが,・・・当業者であれば,・・・PTH200単位の投与についても,軽度又は中等度の腎機能障害者における安全性と,腎機能正常者における安全性とは同程度であると予想するものと解され,甲7文献において腎機能正常者と腎機能障害者での比較が行われていないことは,この予想を何ら左右しない。そうすると,効果②は,甲7発明と用量・用法・有効成分等が同じである本件発明の構成から当業者が予測し得る範囲内のものというべきである。
ウ 効果③について
本件明細書には,PTHの連日投与から想定されるBMD増加率と骨折相対リスクとの関係を記載した部分は見当たらず,上記主張は,明細書に記載されていない効果を主張するものであって失当というほかない。
4.コメント
(1)旭化成ファーマの敗因
本件での原告(旭化成ファーマ)の敗因は、簡単に言ってしまえば、本件特許発明の効果①が予測できない顕著なものであることを理解できるように明細書に示すことができなかったことである。
効果①の程度が予測できない顕著なものであることを主張するためには、「テリパラチド」が「プラセボ」と比べて効果が顕著であることを示すことではなく、「(本件3条件を全て満たす)高リスク患者へのテリパラチド」の効果が「(本件3条件以外の)低リスク患者へのテリボン」の効果に比べて顕著であることを示すこと、そしてそれは明細書に理解できるように記載しておくことが必要であった。
明細書には比較対象とすべき「(本件3条件以外の)低リスク患者へのテリボン」の効果が明確に示されていない以上、本願発明である「(本件3条件を全て満たす)高リスク患者へのテリパラチド」の効果の程度が顕著であることを理解することはできないし、明細書に理解できるように記載されていない効果をいわゆる「後出しデータ」によって主張することは許されない。仮に後出しデータを採用したとしてもなお比較対象である低リスク患者への効果が適切に評価できていないことから、結局、本件発明が予測できない顕著な効果を有するとは認められない、と判断された。
(2)効果の程度についての判断に参酌できる観点
当該発明の効果の程度が予測できない顕著なものであるかについて、「当該発明の構成が奏するものとして当業者が予測することのできなかったものか否か,当該構成から当業者が予測することのできた範囲の効果を超える顕著なものであるか否かという観点から十分に検討」する必要がある(2019.08.27 「アルコン・協和キリン v. X」 最高裁平成30年(行ヒ)69)。
しかし、医薬分野の発明は、実際には、実施してみなければどの程度の効果を奏するか分からない世界であり、出願当時の当業者が当該発明の構成を容易に想到できたとしても実際の効果の「程度」を予測することができない場合がある。すなわち、「当該発明の構成のみから予測できない顕著な効果が認められるか否かを判断することは困難」(本判示)な場合があるからこそ、「当該発明の構成に近い構成を有するものとして選択された引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌」(本判示)して吟味しなければ、当該発明に本当に主張するような予測できない顕著な効果があるといえるのか否か判断できない。
本件では、当該発明の効果自体はデータを伴って明細書に記載されている。しかし、引用発明(甲7発明)では骨折を抑制する効果を奏していることは当業者において容易に理解できるところ、本件特許明細書の記載から当該発明の効果がどの程度予測できない顕著なものであるのか理解することができないものであった。引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌して吟味しようにも、明細書には理解できるように記載されておらず推認もできないことから、当該発明には予測できない顕著な効果を有するということはできないと判断された。原告は、顕著な効果を有するとの主張を立証できなかったわけである。
発明の効果の顕著性判断において重要となるポイントは主に以下の4点だろう。
- 「何」と比較したら予測できない顕著な効果といえるのか
- 特許発明が予測できない顕著な効果を有することを当業者が理解できるように、出願人が明細書に記載しているか
- 効果の顕著性の主張を否定する場合には、その特許発明として予測できる効果の範囲がどの程度なのかを推認できる事情等を認定する等の丁寧な検討が必要(最高裁判示)
- 当該発明の構成のみから予測できない顕著な効果が認められるか否かを判断することが困難な場合は、当該発明の構成に近い構成を有するものとして選択された引用発明の奏する効果や技術水準において達成されていた同種の効果を参酌することは許される(本件知財高裁判示)
(3)進歩性のための明細書記載要件
特許法上、進歩性を満たすための要件として、明細書に何らかの記載は求められていない。しかし、効果の顕著性が認められるために明細書にどの程度まで比較データが記載されていなければならないか、また、後出しデータによる主張が認められるためには明細書にどの程度まで効果に関する記載が必要なのか、が問われた事件が存在する。本件もそのような明細書の効果の記載の程度が問われた一例となるが、このように進歩性の判断において明細書に一定の記載を求めていることを以下「進歩性のための明細書記載要件」と呼ぶこととする。
2010.07.15 「P&G v. 特許庁長官」 知財高裁平成21年(行ケ)10238では、裁判所は、「発明の効果は、特許法上、明細書の記載要件とはされていない」と言及しながらも、進歩性を有するか否かを判断するためには、発明の効果がどのようなものであるかが明細書に明らかにされていることを要する旨を判示している。

特許法29条2項の要件充足性を判断するに当たり,当初明細書に,「発明の効果」について,何らの記載がないにもかかわらず,出願人において,出願後に実験結果等を提出して,主張又は立証することは,先願主義を採用し,発明の開示の代償として特許権(独占権)を付与するという特許制度の趣旨に反することになるので,特段の事情のない限りは,許されないというべきである。
また,出願に係る発明の効果は,現行特許法上,明細書の記載要件とはされていないものの,出願に係る発明が従来技術と比較して,進歩性を有するか否かを判断する上で,重要な考慮要素とされるのが通例である。出願に係る発明が進歩性を有するか否かは,解決課題及び解決手段が提示されているかという観点から,出願に係る発明が,公知技術を基礎として,容易に到達することができない技術内容を含んだ発明であるか否かによって判断されるところ,上記の解決課題及び解決手段が提示されているか否かは,「発明の効果」がどのようなものであるかと不即不離の関係があるといえる。そのような点を考慮すると,本願当初明細書において明らかにしていなかった「発明の効果」について,進歩性の判断において,出願の後に補充した実験結果等を参酌することは,出願人と第三者との公平を害する結果を招来するので,特段の事情のない限り許されないというべきである。
他方,進歩性の判断において,「発明の効果」を出願の後に補充した実験結果等を考慮することが許されないのは,上記の特許制度の趣旨,出願人と第三者との公平等の要請に基づくものであるから,当初明細書に,「発明の効果」に関し,何らの記載がない場合はさておき,当業者において「発明の効果」を認識できる程度の記載がある場合やこれを推論できる記載がある場合には,記載の範囲を超えない限り,出願の後に補充した実験結果等を参酌することは許されるというべきであり,許されるか否かは,前記公平の観点に立って判断すべきである。
また、同事件(2010.07.15 「P&G v. 特許庁長官」 知財高裁平成21年(行ケ)10238)において、裁判所は、「出願人が出願当時には将来にどのような引用発明と比較検討されるのかを知り得ないこと等に照らすならば,出願人に過度な負担を強いることになり,実験結果に基づく客観的な検証の機会を失わせ,公平の理念にもとる」とも言及しており、あらゆる事案において、効果の顕著性判断に厳格な比較試験を明細書に記載しておく要件を出願人に強いることはやはりバランスに欠けると思われる。
では、本件において、もし仮に、原告(出願人)が出願当時には将来に引用文献(甲7文献)から把握される引用発明(甲7発明)と比較検討されるなど知り得なかったことを主張立証できたらなら、原告にあらかじめ甲7発明等と比較した実験結果を明細書に記載しておくことを要求することは過度な負担を強いることになり、公平の理念にもとるとして、後出しデータでの検証の機会が原告に与えられたのだろうか。
しかし、本件において、実際には、原告自ら引用文献(甲7文献)を非特許文献34として本件明細書中に引用しており、原告は出願当時に将来に同文献から把握される引用発明(甲7発明)と比較検討されるかもしれないことを知り得たはずである。裁判所は、公平の理念のもと、「進歩性のための明細書記載要件」のバランスを厳格な方向(後出しデータの提出を許容しない)に振って判断したと考えられる。原告は、後出しデータを提出したが、結果的には、仮にそれを参酌したとしても当業者が顕著な効果があると理解できるように示すことはできなかった。
欧州特許庁でも、「進歩性のための明細書記載要件」ともいえる”plausibility”要件が実務として定着しつつあるようだ。日本でも、裁判例の蓄積等により、「進歩性のための明細書記載要件」として求められるハードルが、公平の理念のもと、どのような場合にどう上下するのかについて、具体的且つ客観的なガイダンスが導かれ、予見可能性のあるものとなっていくことを願う。
参考: 進歩性のための明細書記載要件

5.おわりに
「1.はじめに」でも言及したが、テリパラチド酢酸塩を有効成分とする週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」のジェネリック参入の障壁となっていると考えられる7つの特許に対する無効審判請求事件の知財高裁判決が次々と出てくると見込まれている。
本記事では、それら事件のうちのひとつである特許第6274634号の無効審判請求事件を判断した知財高裁判決について紹介したが、同日に以下の判決も出されている(審決取消判決で旭化成ファーマ(被告)の敗訴)。
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056・・・特許第6043008号
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10132・・・特許第6275900号
7つの特許権の存続期間満了日は2030年9月8日であるが、その他の判決の結果次第では(旭化成ファーマの全敗訴となると)、来年にはジェネリックの承認・・・ということもあり得るかもしれない。
テリボン®は旭化成ファーマの主力品であるため、他の特許についての裁判に先駆けて出された今回の判決のインパクトは極めて大きいと考えられる。
ところで、テリボンⓇ皮下注用56.5µgの投与には週1回の通院が必要であることから、旭化成ファーマは、患者の通院負担を軽減するとともに通院が困難な一部の患者に対して新たな治療の選択肢を提供することを目的に、在宅自己投与が可能なオートインジェクター製剤を開発し、「骨折の危険性の高い骨粗鬆症」を効能・効果とし、テリパラチドとして28.2µgを週2回皮下注射を用法・用量とする、「テリボンⓇ皮下注28.2µgオートインジェクター」の製造販売承認を2019年9月20日に取得した(再審査期間なし)。
- 2019.11.27 旭化成ファーマ press release: 「テリボン皮下注28.2μgオートインジェクター」の薬価収載および新発売のお知らせ
このオートインジェクター製剤がテリボン®製品の競争力の維持にどれだけ貢献するのかについては、今後のジェネリックメーカーの動き(7つの特許により保護されていないオートインジェクター製剤にむしろジェネリックの参入があるだろうか・・・)やテリボン®のこれからの売上推移を注視していく必要があるだろう。
次回記事「骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」



コメント