2021年6月25日より、Purple Book(パープルブック)から、先発バイオ医薬品に関連する特許リストが閲覧できるようになりました。
Purple Book Homepageはこちらになります。
Patent List
The Biological Product Patent Transparency (BPPT) section of the Consolidated Appropriations Act of 2021 requires FDA to publish patent lists provided by reference product sponsors (i.e., biologics license application (BLA) holders) to FDA for certain licensed biological products. Specifically, a reference product sponsor is required to provide to FDA, as described in section 351(k)(9)(A)(iii) of the PHS Act, the list of patents and corresponding expiry dates (also referred to as the “initial list”), not later than 30 days after the reference product sponsor has provided the initial list to a 351(k) applicant under section 351(l)(3)(A) or (l)(7) of the PHS Act. The reference product sponsor is also required to provide to FDA any subsequent or supplemental lists, and their corresponding expiry dates, within 30 days of the provision of such lists to a 351(k) applicant under section 351(l)(3)(A) or (l)(7) of the PHS Act. Pursuant to section 351(k)(9)(A)(iii) of the PHS Act, FDA shall include this information in the published list and revise it on a monthly basis to include any additional initial lists and any updates from subsequent or supplemental lists.
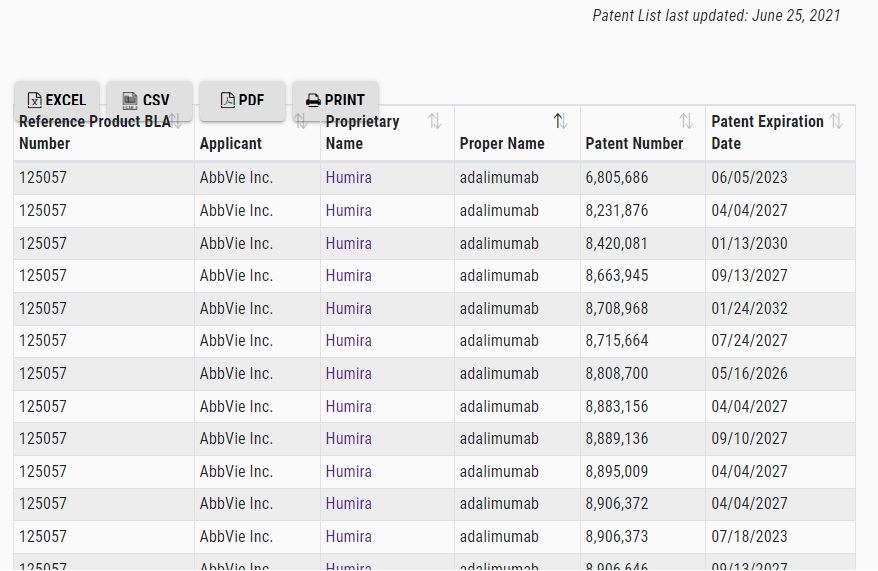
以下はHumira®(adalimumab)を検索した例となります。
検索結果の上段にBiosimilar(s)、下段にReference Product(s)が表記されます。
Reference Product(s)のHumiraをクリックすると、Humiraの詳細画面が表示され、その表示下の方に、”Patent List Provided”の項目があります。
“Yes”なら、そこから以下のようなPatent Listを閲覧することができます。
Oversight Committee Held Hearing with AbbVie CEO and Experts on Pricing Practices for Humira and Imbruvica (May 18, 2021)でも、議論されていましたが、Humira®を保護する特許群の多さには驚かされます。米国では、Humira®のバイオシミラーの市場参入が2023年に始まると想定されています(Abbvie 2020 Form 10-K)。
過去参考記事:




コメント