そう痒症改善剤レミッチ®の特許権の存続期間の延長登録出願・・・「ナルフラフィン塩酸塩」のみを本件医薬品の有効成分と解し、「ナルフラフィン」は本件医薬品の有効成分ではないと認定して、本件発明の実施に本件処分を受けることが必要であったとはいえないと判断した本件審決の認定判断は誤り
1.はじめに
本件(知財高裁令和2年(行ケ)10063)は、経口そう痒症改善剤レミッチ®に関わる東レが保有する「止痒剤」に関する特許権(第3531170号)についての存続期間延長登録の出願(2017-700154)に対する拒絶審決(不服2018-7539号)の取消訴訟である。
争点は、本件延長登録出願が、平成28年法律第108号による改正前の特許法(以下「旧特許法」という。)67条の3第1項1号に該当する否かである。
裁判所は、本件審決の認定判断は誤りであり、原告が主張する取消事由1(本件医薬品の有効成分に関する事実認定の誤り)は理由があるとして、審決を取り消した。
2.経緯
(1)本件特許(第3531170号)
【発明の名称】止痒剤
【特許番号】特許第3531170号
【登録日】2004.03.12
【出願番号】特願平10-524506
【出願日】1997.11.21
【優先日】1996.11.25
【特許権者】東レ株式会社
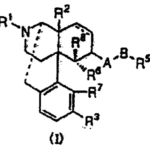
【請求項1】下記一般式(I)
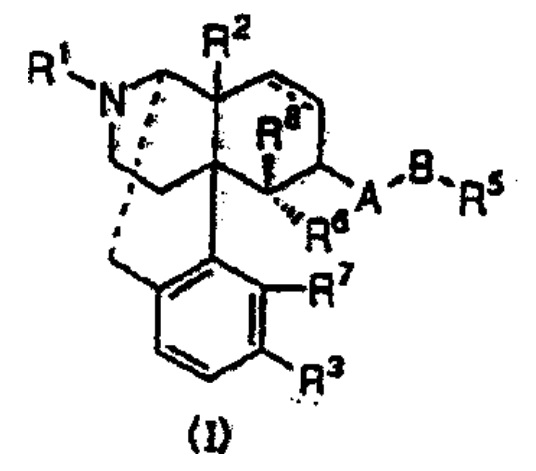
[式中、・・・(省略)・・・]で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤。
(2)本件処分
本件延長登録出願(2017-700154)は、以下の処分に基づくものであった。
イ 延長登録の理由となる処分
医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律(以下「薬機法」という。)14条1項に規定する医薬品に係る同項の承認
ウ 処分を特定する番号 22900AMX00538000
エ 処分を受けた日 平成29年3月30日
オ 処分の対象となった医薬品
販売名 レミッチOD錠2.5μg
有効成分 ナルフラフィン塩酸塩(一般名称INN nalfurafine)(有効成分に関し,レミッチOD錠2.5μgの添付文書[組成・性状]には,ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)と記載されている。)
カ 処分の対象となった医薬品について特定された用途
次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
血液透析患者,慢性肝疾患患者
(3)本件審決
本件延長登録出願に対する拒絶査定に係る不服審判請求(不服2018-7539号)について、特許庁は請求不成立の審決をした。
本件発明はナルフラフィン塩酸塩を有効成分とする本件医薬品を含むものではないといえるから,本件発明の実施に旧特許法67条2項の政令で定める処分を受けることが必要であったとは認めることができず,本件延長登録出願は,旧特許法67条の3第1項1号に該当し,特許権の存続期間の延長登録を受けることができない。
3.取消事由1(本件医薬品の有効成分に関する事実認定の誤り)について
(1)原告の主張
ア 本件審決の事実認定の誤り
本件医薬品は,ナルフラフィン(フリー体)を有効成分とする医薬品であり,本件発明1の発明特定事項を備えているものである。本件審決は,本件医薬品の有効成分がナルフラフィン塩酸塩であると誤って認定している。
以下で詳述するとおり,医薬品の有効成分に関する技術常識,ナルフラフィン塩酸塩の有効成分に関する科学的・客観的な理解,本件医薬品の製造販売承認書(以下「本件承認書」という。)の記載等からすると,本件医薬品がナルフラフィンを有効成分とする止痒剤であることは明らかである。
・・・
イ 被告の主張に対する反論
ナルフラフィン塩酸塩を「有効成分」とする記載がある本件添付文書(甲5),治験計画届書(甲10)及び原告作成文書(甲83,88,90)は,いずれも医薬品製造販売承認申請に当たって作成された文書であるところ,医薬品製造販売承認実務においては,有効成分とその他の成分(添加剤)とを区別する観点から承認書等に有効成分欄が設けられており,当該有効成分欄にナルフラフィン塩酸塩が記載されていることは本件医薬品の有効成分がナルフラフィンであることを何ら否定するものではない。
(2)被告の主張
本件医薬品を構成する各物質のうちの有効成分とされる物質は・・・ナルフラフィン塩酸塩という化合物であり・・・本件医薬品は,本件発明1の発明特定事項である「一般式(I)で表されるオピオイドκ受容体作動性化合物を有効成分とする」を備えていないから,本件審決の判断に誤りはない。
4.裁判所の判断(抜粋)
主 文
1 特許庁が不服2018-7539号事件について令和2年3月30日にした審決を取り消す。
2 訴訟費用は被告の負担とする。
(1)本件発明の実施に本件処分を受けることが必要であったかどうかについて検討
ア 特許権の存続期間の延長登録の制度は,政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものであるから,本件発明の実施に本件処分を受けることが必要であったかどうかは,このような特許法の存続期間延長の制度が設けられている趣旨に照らして判断されるべきであり,その場合における本件処分の内容の認定についても,このような観点から実質的に判断されるべきであって,本件承認書の「有効成分」の記載内容のみから形式的に判断すべきではない。このように解することは,最高裁平成26年(行ヒ)第356号同27年11月17日第三小法廷判決・民集69巻7号1912頁の趣旨にも沿うものということができる。
イ 前記(1)エで認定した事実からすると,医薬品について,良好な物性と安定性の観点からフリー体に酸等が付加されて,フリー体とは異なる化合物(付加塩)が医薬品とされる場合があること,そのような医薬品が人体に取り込まれたときには,付加塩からフリー体が解離し,フリー体が薬効及び薬理作用を奏すること,ナルフラフィンとナルフラフィン塩酸塩についても同様の関係にあり,ナルフラフィンとナルフラフィン塩酸塩で薬効及び薬理作用に違いがないことは,本件医薬品の製造販売の承認申請がされた平成28年3月31日までに,当業者に広く知られていたものと認められる。
ウ 上記イで述べたところに,前記(1)オ,カ,キで認定した事実や前記(1)クの専門家の意見書の内容を総合すると,医薬品分野の当業者は,医薬品の目的たる効能,効果を生ぜしめる作用に着目して,医薬品に配合される付加塩だけでなく,そのフリー体も「有効成分」と捉えることがあるものと認められる。
エ 前記(1)ア~ウのとおり,本件承認書には,「有効成分」として「ナルフラフィン塩酸塩」と記載されており,本件添付文書にも「有効成分に関する理化学的知見」として,「ナルフラフィン塩酸塩」と記載され,その構造式や性状などが記載されているが,これは,賦形剤などの製剤補助剤と区別する観点から,実際に医薬品に配合されている原薬(付加塩)を有効成分として捉えていることに基づく記載であると解される。これに対し,本件添付文書の「有効成分・含量(1錠中)」の欄に,「ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)」と記載されており,本件インタビューフォームには,和名は「ナルフラフィン塩酸塩」と記載されているものの,洋名については「ナルフラフィン塩酸塩」と「ナルフラフィン」が併記されているし,「有効成分(活性成分)の含量」として カプセル:1カプセル中ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)含有 OD錠:1錠中ナルフラフィン塩酸塩2.5μg(ナルフラフィンとして2.32μg)含有」と記載されている。そして,前記(1)アのとおり,本件承認書における・・・同じく,前記(1)イ,ウのとおり,本件添付文書や本件インタビューフォームにおける,本件医薬品の「薬物動態」の血漿中濃度や薬物動態パラメータもナルフラフィン塩酸塩ではなく,ナルフラフィンを測定して得られたものとなっている。
オ 以上のことを考え併せると,本件処分の対象となった本件医薬品の有効成分は,本件承認書に記載された「ナルフラフィン塩酸塩」と形式的に決するのではなく,実質的には,本件医薬品の承認審査において,効能,効果を生ぜしめる成分として着目されていたフリー体の「ナルフラフィン」と,本件医薬品に配合されている,その原薬形態の「ナルフラフィン塩酸塩」の双方であると認めるのが相当である。
したがって,「ナルフラフィン塩酸塩」のみを本件医薬品の有効成分と解し,「ナルフラフィン」は,本件医薬品の有効成分ではないと認定して,本件発明の実施に本件処分を受けることが必要であったとはいえないと判断した本件審決の認定判断は誤りであり,取消事由1は理由がある。
(2)被告の主張について
被告は,原告が本件延長登録出願に当たって,本件医薬品の「有効成分」を「ナルフラフィン塩酸塩」と主張していたことや原告が作成した書類(甲83,88,90)で有効成分をナルフラフィン塩酸塩としていたと主張する。
しかし,本件延長登録出願の経緯は,前記(1)ケ認定のとおりであって,この経緯に照らして,原告が取消事由1の主張をすることや裁判所が同取消事由1に理由があると判断することを妨げられる理由はなく,前記(2)の上記判断を左右するものではない。また,被告が主張する文書(甲83,88,90)は,本件医薬品の製造販売の承認申請に向けて作成された文書であるところ、本件医薬品の有効成分は,本件医薬品の承認審査の経緯や内容等を踏まえると,実質的にはナルフラフィン塩酸塩とナルフラフィンの双方と解するのが妥当であるから、本件承認書(甲4,96,148)の記載が前記(2)の認定判断を左右しないことと同様に,上記の文書も、前記(2)の認定判断を左右するものではない。
(3)結論
以上の次第で,取消事由1は理由があり,その余の点について判断するまでもなく,本件審決にはその結論に影響を及ぼす違法があるから,原告の請求を認容することとして,主文のとおり判決する。
5.コメント
(1)本件発明の実施に本件処分を受けることが必要であったかどうかは実質的に判断すべき
本件特許の請求の範囲は「ナルフラフィン」のフリー体を保護するもので、本件医薬品に配合されている原薬形態の「ナルフラフィン塩酸塩」を範囲に含まないようである。この点、特許庁は、本件医薬品の有効成分は「ナルフラフィン塩酸塩」であるとして本件延長登録出願を拒絶した。
しかし、知財高裁は、特許権の存続期間延長制度の趣旨に照らして、実質的に登録可否を判断すべきであるとの一般原則を示したうえで、本件においては、実質的には、効能・効果を生ぜしめる成分はフリー体の「ナルフラフィン」であるから、「ナルフラフィン」も本件医薬品の有効成分であると認め、従って、本件発明(「ナルフラフィン」のフリー体)の実施に本件処分を受けることが必要であった、ということを判断したといえる。
本件発明の実施に本件処分を受けることが必要であったかどうかは,このような特許法の存続期間延長の制度が設けられている趣旨に照らして判断されるべきであり,その場合における本件処分の内容の認定についても,このような観点から実質的に判断されるべきであって,本件承認書の「有効成分」の記載内容のみから形式的に判断すべきではない。このように解することは,最高裁平成26年(行ヒ)第356号同27年11月17日第三小法廷判決・民集69巻7号1912頁の趣旨にも沿うものということができる。
この「実質的に判断されるべきで、形式的に判断すべきではない」という観点は、場面は異なるが、先行処分との関係で「効能・効果」の異同が争点となった以下に示す過去判決でも同様の言及が見られる(本件裁判所が引用した最高裁平成26年(行ヒ)第356号含む)。本件は「有効成分」の解釈が問題となった事例ではあるが、承認書等の記載から「実質的に判断されるべきで、形式的に判断すべきではない」という点は、延長登録の可否を判断するうえで共通する大原則といえよう。
2015.11.17 「特許庁長官 v. ジェネンテック」 最高裁 平成26年(行ヒ)356
先行処分と出願理由処分の上記審査事項の全てを形式的に比較することによってではなく,延長登録出願に係る特許発明の種類や対象に照らして,医薬品としての実質的同一性に直接関わることとなる審査事項について,両処分を比較して判断すべきである。
2014.05.30 「ジェネンテック v. 特許庁長官」 知財高裁(大合議) 平成25年(行ケ)10195, 10196, 10197, 10198
「政令で定める処分を受けたことによっては,禁止が解除されたとはいえないこと」との第1要件の有無を判断するに当たっては,医薬品の審査事項である「名称,成分,分量,用法,用量,効能,効果,副作用その他の品質,有効性及び安全性に関する事項」の各要素を形式的に適用して判断するのではなく,存続期間の延長登録制度を設けた特許法の趣旨に照らして実質的に判断することが必要である。
2011.02.22 「沢井製薬等の後発品メーカー8社 v. エーザイ」 知財高裁平成21年(行ケ)10423/10424/10425/10426/10427/10428/10429
「用途」の同一性は,医薬品製造販売承認事項一部変更承認書等の記載から形式的に決するのではなく,先の承認処分と本件承認処分に係る医薬品の適用対象となる疾患の病態(病態生理),薬理作用,症状等を考慮して実質的に決すべきであると解される
2007.09.27 「スリーエム(3M) v. 特許庁長官」 知財高裁平成19年(行ケ)10017
先の承認及び本件承認に係る医薬品の適用対象となる疾患の病態,薬理作用等を考慮して実質的な見地から判断すると,両者の用途(効能・効果)は,同一であるというべきである。
(2)「フリー体の特許発明を実施する」ことの意味
「ナルフラフィン」は本件医薬品の有効成分ではないと認定して本件発明の実施に本件処分を受けることが必要であったとはいえないとした本件審決の認定は誤りであると判断した知財高裁。
すなわち、本件発明であるフリー体の実施に本件処分を受けることが必要であったことを認めた判断といえる。
物の発明について、「実施」とは・・・。
様々な論点・議論を生み出しそうだ。
(3)別件特許延長登録の無効審決取消訴訟
 本件特許に係る特許権は、東レが製造販売する経口そう痒症改善剤レミッチ®(一般名: ナルフラフィン塩酸塩)を保護し、その20年の存続期間満了日は2017年11月21日だが、期間延長出願(特願2015-700061、特願2017-700154(本件延長登録出願)、特願2017-700309、特願2017-700310)により現在も存続している。
本件特許に係る特許権は、東レが製造販売する経口そう痒症改善剤レミッチ®(一般名: ナルフラフィン塩酸塩)を保護し、その20年の存続期間満了日は2017年11月21日だが、期間延長出願(特願2015-700061、特願2017-700154(本件延長登録出願)、特願2017-700309、特願2017-700310)により現在も存続している。
本件特許については、本件とは別に、無効審判請求不成立審決取消訴訟(記事参照:2021.03.25 「沢井製薬 v. 東レ」 知財高裁令和2年(行ケ)10041)及び別処分に基づく期間延長登録の無効審決取消訴訟(以下の3件)の各判決が同日に言い渡されている(無効審決の取消し。これら3件については後日ブログで取り上げる予定)。
- 令和2年(行ケ)10096:特許3531170号の下記処分(承認)に基づく延長登録(2015-700061)の無効審決(無効2020-800002号事件)取消訴訟。
(1)処分の対象となった医薬品
販売名 ノピコールカプセル2.5μg
有効成分 ナルフラフィン塩酸塩
(2)処分の対象となった医薬品について特定された用途
慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
- 令和2年(行ケ)10097:特許3531170号の下記処分(承認)に基づく延長登録(2017-700309)の無効審決(無効2020-800003号事件)取消訴訟。
(1)処分の対象となった医薬品
販売名 レミッチカプセル2.5μg
有効成分 ナルフラフィン塩酸塩
(2)処分の対象となった医薬品について特定された用途
次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
透析患者(血液透析患者を除く)、慢性肝疾患患者
- 令和2年(行ケ)10098:特許3531170号の下記処分(承認)に基づく延長登録(2017-700310)の無効審決(無効2020-800004号事件)取消訴訟。
(1)処分の対象となった医薬品
販売名 レミッチOD錠2.5μg
有効成分 ナルフラフィン塩酸塩
(2)処分の対象となった医薬品について特定された用途
次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
透析患者(血液透析患者を除く)、慢性肝疾患患者
上記の期間延長登録の無効審決取消訴訟についての関連過去記事:
6.おわりに
2018年6月よりレミッチ®の後発医薬品である「ナルフラフィン塩酸塩OD錠2.5μg「サワイ」」の製造販売を開始した沢井製薬に対して東レは特許権侵害訴訟を提起している(下記過去記事参照)。すなわち延長された特許権(医薬用途発明)の行使を争う事件であり、まだ判決例の少ない延長された特許権の効力についての裁判所による判断がどうなるのか注目される。本件で知財高裁が本件延長登録出願の拒絶審決を取り消したことで、侵害訴訟の行方も大きな影響を受けると思われる。
- 2019.10.20 レミッチ®用途特許に対するジェネリックメーカーの動き
- 2018.12.12 東レがレミッチ®OD錠後発品を販売する沢井・扶桑を特許侵害で提訴



コメント