 2020年9月25日、ノバルティスファーマAGおよび旭化成ファーマ(株)より「ゾレドロン酸に関する特許権について」の謹告文が掲載された(参考: 2020.09.25 日刊薬業 【謹告】ゾレドロン酸に関する特許権について)。
2020年9月25日、ノバルティスファーマAGおよび旭化成ファーマ(株)より「ゾレドロン酸に関する特許権について」の謹告文が掲載された(参考: 2020.09.25 日刊薬業 【謹告】ゾレドロン酸に関する特許権について)。
ノバルティスファーマAGは、年1回点滴静脈内投与の骨粗鬆症治療剤(ビスホスホネート製剤)「リクラスト®点滴静注液 5mg」を保護する日本特許権を保有しており、旭化成ファーマ(株)はその専用実施権者として、本剤を国内で製造販売している。
ノバルティスファーマAGおよび旭化成ファーマ(株)は、両社の特許権および専用実施権を侵害する行為、または侵害するおそれのある行為に対しては、厳正なる法的処置を講じるとのことである。
1.ゾレドロン酸の開発の経緯
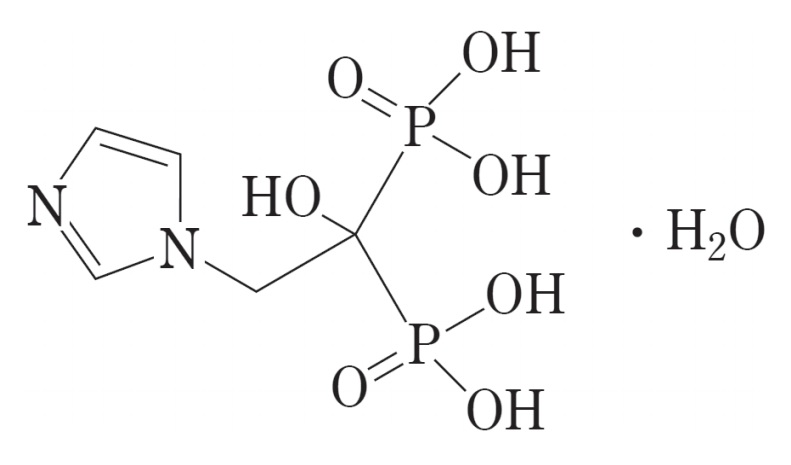
ゾレドロン酸水和物(Zoledronic Acid Hydrate)(以下、ゾレドロン酸)は、ノバルティスファーマ AG が創製した側鎖にイミダゾール環を有する第三世代の窒素含有ビスホスホネートである。

Bisphosphonates—much more than only drugs for bone diseases: European Journal of Pharmacology Volume 866, 5 January 2020, 172773 より引用
ゾレドロン酸の開発は、まず、「4 mg 点滴静注用製剤」として「悪性腫瘍による高カルシウム血症」を対象に海外で始まり、国内では、2004年に「悪性腫瘍による高カルシウム血症」を効能又は効果として承認された(ゾメタ®注射液 4 mg)。

過去には、こんな事件もあったね・・・
「ゾレドロン酸の投与時間を5分から15分にする動機付けは認められない」2014.12.24 「ノバルティス v. 特許庁長官」 知財高裁平成26年(行ケ)10045
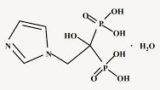
次いで、「ゾレドロン酸 5mg 点滴静注用製剤」の開発が「骨ページェット病」を対象に海外で行われ、2005年4月に欧州で、2007年4月に米国で承認された(Reclast®(米国)/Aclasta®(米国以外の海外))。さらに、「閉経後骨粗鬆症」の効能又は効果が2007年8 月には米国で、同年10月には欧州で追加承認された。国内では、旭化成ファーマ(株)が開発に着手し、2016年9月28日に「骨粗鬆症」を効能又は効果として「リクラスト®点滴静注液 5mg」の製造販売承認を取得した。本剤は、年1回の点滴静注製剤のため、コンプライアンスの向上が期待された。
参考:
- リクラスト®点滴静注液 5mg 医薬品インタビューフォーム(2020 年 3 月改訂(第 6 版))
- 2010.06.14 旭化成ファーマ(株)press release: ビスホスホネート剤「ゾレドロン酸」のライセンス契約締結について
- 2016.11.18 旭化成ファーマ(株)press release: 骨粗鬆症治療剤「リクラスト点滴静注液5mg」の薬価基準収載および発売のお知らせ
- Bisphosphonates—much more than only drugs for bone diseases: European Journal of Pharmacology Volume 866, 5 January 2020, 172773
2.「リクラスト®点滴静注液 5mg」に関する特許権について
ノバルティスファーマAGは、「リクラスト®点滴静注液 5mg」を保護する、ビスホスホネートの投与法に関する特許権(日本特許第4722375号、日本特許第5005188号)、およびビスホスホネートを含む医薬製品に関する特許権(日本特許第4802096号)を保有している。旭化成ファーマ(株)はこれら特許権の専用実施権者である。
| リクラスト®点滴静注液 5mg | ・効能又は効果・・・骨粗鬆症。 ・用法及び用量・・・通常、成人には1年に1回ゾレドロン酸として5mgを15分以上かけて点滴静脈内投与する。 ・製剤の組成及び物性・・・1 ボトル100mL中ゾレドロン酸水和物5.33mg(ゾレドロン酸として5.0mg)、添加剤として、D-マンニトール、クエン酸ナトリウム水和物、注射用水。pH: 6.0 ~ 7.0。 ・容器の材質・・・プラスチックボトル(無色):シクロオレフィンポリマー。 | 再審査期間4年 (2016.09.28~2020.09.27) |
| 特許第4722375号 | 【請求項1】 間歇的に投与され、かつ、投与の間隔が少なくとも1年であり、さらに静脈内投与される、骨粗鬆症の処置用医薬であって、有効成分として1-ヒドロキシ-2-(イミダゾール-1-イル)エタン-1,1-ジホスホン酸またはその薬学的に許容される塩もしくは水和物を単位投与量として1~10mg含有する医薬。 | 特許権存続期間満了日 2026.06.18 |
| 特許第5005188号 | 【請求項1】 ゾレドロン酸またはその薬学的に許容される塩、またはその水和物を単位投与量として1~10mg含有する骨粗鬆症の処置用医薬であって、間歇的に静脈内投与され、かつ、投与の間隔が少なくとも6ヶ月である医薬。 | 特許権存続期間満了日 2025.10.14 |
| 特許第4802096号 | 【請求項1】 すぐに使用できる溶液の形態の医薬製品であって、 ゾレドロン酸または薬理学的に許容されるその塩の溶液を含有する容器を含み、 該容器の少なくとも内側表面はシクロオレフィンポリマーであるプラスチック材を含み、 該充填された容器は加熱滅菌可能であり、 該溶液は、さらに有機塩基性緩衝剤を含み、そして、生理学的に許容されるpH値であるpH5.5~8.0に該有機塩基を用いて調整されたものであり、 該製品は100mlの量を有する単位用量形態であり、 該単位用量形態は4~5mgの無水ゾレドロン酸と等価の量のゾレドロン酸または薬理学的に許容されるその塩を含む、 医薬製品。 | 特許権存続期間満了日 2029.09.17 |
リクラスト®点滴静注液 5mgの再審査期間は4年(2016年9月28日~2020年9月27日)であり、その終了以降、リクラスト®のジェネリックの承認申請が可能になる。上記3つの特許に対する無効審判請求はされていないため、リクラスト®のジェネリックを参入しようと目論むジェネリックメーカーがいるのかは現時点で不明(*1)だが、ノバルティスファーマAG及び旭化成ファーマ(株)は、この再審査期間終了のタイミングでジェネリックの承認申請を計画しているジェネリックメーカーに対して謹告文を掲載することにより牽制したいと考えたようだ。
特許第4802096号の特許請求の範囲は、容器の内側表面をシクロオレフィンポリマーに限定するものである。ジェネリックメーカーが、シクロオレフィンポリマー以外の材質を容器に採用できれば、この特許権による権利行使から免れることができる。
一方、特許第4722375号及び特許第5005188号の特許請求の範囲は、用法及び用量を保護するものである。リクラスト®のジェネリックはこれら用法及び用量を別の構成にして承認を得ることは困難であるから、リクラスト®のジェネリックの承認申請を計画しているジェネリックメーカーは、これら特許の無効審判を請求して特許無効審決を勝ち取らない限り、特許権が満了(2026年6月18日)する前にジェネリックを販売又はそのための準備行為をした場合には、特許権を侵害しているとしてノバルティスファーマAG及び旭化成ファーマ(株)から訴えられるリスクを伴うだろう。
ーーー
(*1) 旭化成(株)決算説明会資料によると、旭化成ファーマ(株)によるリクラスト®の国内売上は、発売2016年度4億円→2017年度11億円→2018年度14億円→2019年度14億円と推移している。多くの骨粗鬆症治療薬がある中でのビスホスホネート製剤、さらにその中でも月1回投与製剤がある中での年1回の点滴静注という特徴が製品価値としてどれだけ高く市場で評価されているのか、その売上の伸びを見ると・・・?である。ジェネリックメーカーにとってリクラスト®のジェネリック参入の魅力度は高いのだろうか。


コメント