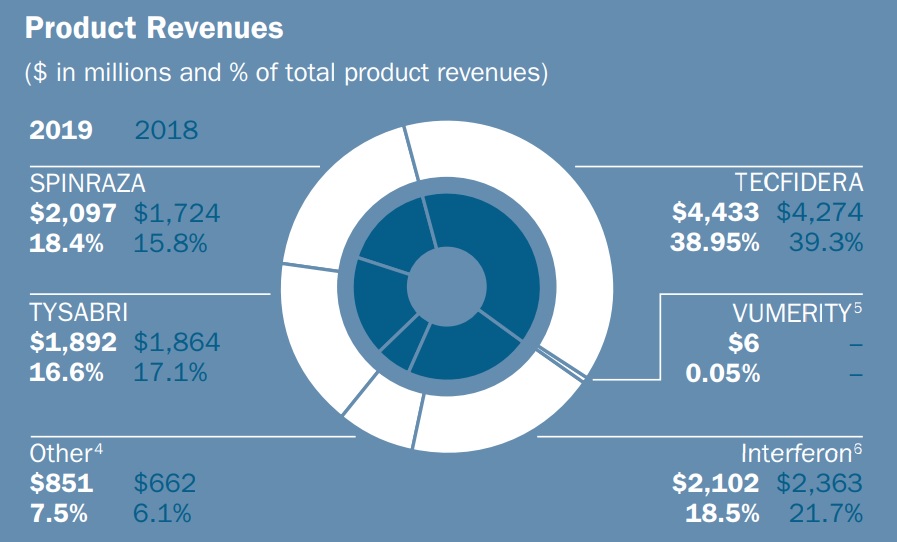
テクフィデラ®(TECFIDERA®)は、有効成分としてフマル酸ジメチル(Dimethyl Fumarate)を含有する多発性硬化症治療剤。再発性多発性硬化症(relapsing MS)治療を適応として 2013 年3月27日に米国で初めて承認されて以来、Biogen社によるテクフィデラ®の2019年度全世界での売上は約44億ドル(そのうち米国が約33億ドル)に達しており、Biogen社全製品売上の約4割を占める(Biogen 2019 Annual reportより)。
1.米国の状況・・・
しかし、米国で争われているMylan社とのANDA訴訟において、テクフィデラ®を保護する米国特許8,399,514(満了日2028.02.07)は無効であるとのウェスト・ヴァージニア州北部地区連邦地方裁判所での判決が出されたことで、テクフィデラ®のジェネリックが早期に市場参入する可能性が高まっている(2020.06.18 Mylan press release: Mylan Wins District Court Decision Against Biogen’s Tecfidera® Patent)。さらに、2020年9月16日に、他の複数のジェネリックメーカーによるテクフィデラ®のANDAに対して侵害訴訟が提起されていたデラウエア州連邦地方裁判所も、上記ウェスト・ヴァージニア州北部地区連邦地裁が下した特許無効判断に拘束される(Collateral estoppel applies)として、Biogen社の主張を退けた(Biogen International GmbH et al v. Amneal Pharmaceuticals LLC et al. MEMORANDUM OPINION Case: 17-823)。

米国で約33億ドルもの売上を生み出しているテクフィデラ®に迫りつつあるパテントクリフ。この崖はBiogen社の屋台骨を揺るがしかねないね。
米国特許8,399,514:
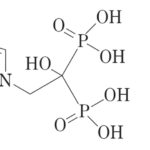
1. A method of treating a subject in need of treatment for multiple sclerosis comprising orally administering to the subject in need thereof a pharmaceutical composition consisting essentially of (a) a therapeutically effective amount of dimethyl fumarate, monomethyl fumarate, or a combination thereof, and (b) one or more pharmaceutically acceptable excipients, wherein the therapeutically effective amount of dimethyl fumarate, monomethyl fumarate, or a combination thereof is about 480 mg per day.
2.日本の状況・・・
日本では、テクフィデラ®へのジェネリックの脅威に対して、Biogen社は、保有する特許権よりも、テクフィデラ®に与えられている再審査期間により、しばらくの間は助けられる見込みである。
特許第5828614号の特許請求の範囲(請求項1):
ジメチルフマレートを唯一の活性成分として含有する多発性硬化症を治療のための薬剤調合物。
特許5828614は、Fumapharm社(*1)により1999年10月29日にPCT出願(PCT/EP1999/008215)され、日本の審査では拒絶審判と分割出願が繰り返され、出願から約16年を経て2015年10月30日に登録された。テクフィデラ®の「多発性硬化症の再発予防及び身体的障害の進行抑制」を効能・効果とする製造販売承認(2016年12月19日)に基づき存続期間が延長され(特願2017-700053、特願2017-700054)、満了日は2020年12月17日となっている(*2)。
本剤は希少疾病用医薬品であり、再審査期間が10年(再審査期間満了年月:2026年12月)であるため、上記特許権が満了しても、2028年半ばまではテクフィデラ®のジェネリックが日本市場に参入することはないと推測される(*3)。
ーーー
(*1)Fumapharm社は2006年にBiogen社により買収され、上記特許権もBiogen社のものとなった。2006.05.31 Press release: Biogen Idec to Acquire Fumapharm AG; Consolidates Ownership of Oral Compound BG-12 Being Studied for Multiple Sclerosis
(*2)テクフィデラ®のOrange Bookにリストされている米国特許権2つ(7,619,001及び8,399,514)の日本ファミリーとして存続している特許権は特許第5828614号のみ。
(*3)再審査期間終了直後(2026年12月)にジェネリックの承認申請が行われたとしても、承認審査に約1年(~2027年12月)、後発医薬品の承認時期は2月又は8月であるため直近は2028年2月となり、後発医薬品の薬価収載時期も6月又は12月であるため直近は2028年6月となる。従って販売開始は早くとも2028年6月以降と想定。

コメント
2021.04.22 Q1 2021 Biogen Earnings Presentation
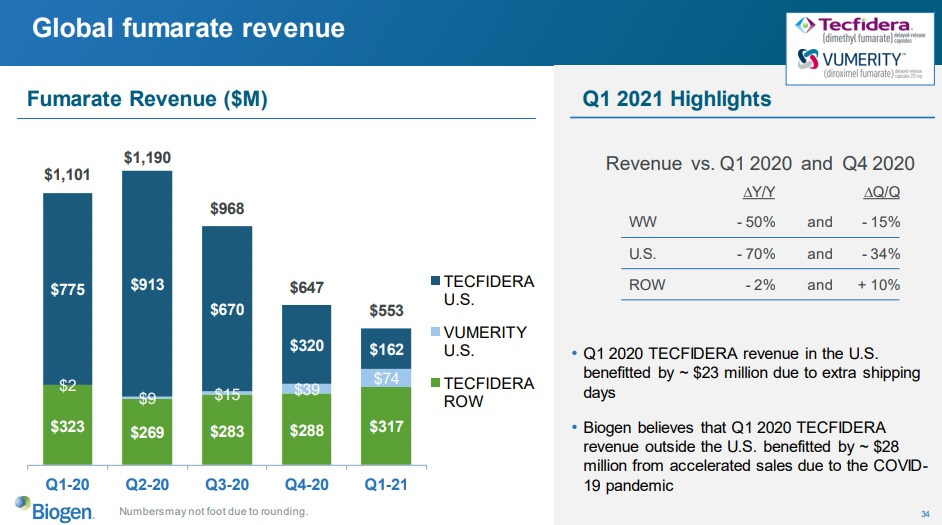
https://investors.biogen.com/static-files/a957e5ba-325f-4a37-bfc8-43cecfc64620
“TECFIDERA decreased 56% vs. prior year impacted by the entrance of multiple generics in the U.S.”