抗悪性腫瘍剤ハーセプチン®のバイオ後続品(バイオシミラー)であるトラスツズマブBS点滴静注用60mg/150mg「第一三共」の承認を得て2018年11月に販売を開始した第一三共ですが、ジェネンテック社が保有するハーセプチン®の乳癌治療における3週間1回投与「B法」に関する特許5818545が存在するため、乳癌については同B法の承認を得ておらず、同特許に対する無効審判を請求(無効2019-800043)していました(下記記事「ハーセプチン®の乳癌治療に関連する特許を巡るジェネリックメーカーの動き」参照)。

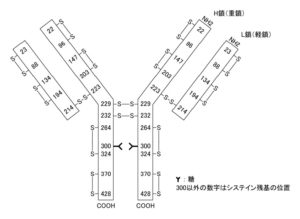
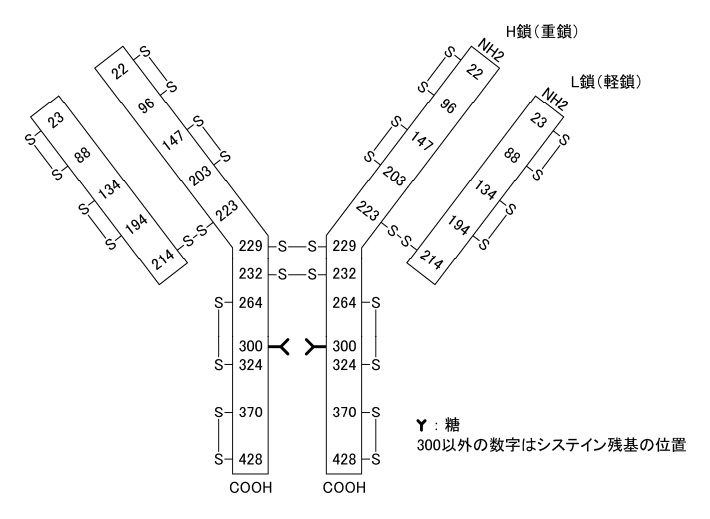
トラスツズマブBS点滴静注用60mg/150mg「第一三共」インタビューフォームより
しかし、2020年7月9日、第一三共はその審判請求を取下げたようです。同特許の存続期間は2020年8月25日に満了することから、このまま審理を続ける意義はないと判断したと想像されます。第一三共は、同特許が満了する8月25日以降に、トラスツズマブBS点滴静注用60mg/150mg「第一三共」について乳癌「B法」の追加承認を得ると見込まれます。
ところで、第一三共は、2020年5月から販売を開始した抗HER2抗体薬物複合体(トラスツズマブ デルクステカン)を有効成分とする抗悪性腫瘍剤「エンハーツ®」を有しています。
エンハーツ®は、現在、その効能・効果が「化学療法歴のある HER2陽性の手術不能又は再発乳癌(標準的な治療が困難な場合に限る)」であって、本剤はサードライン以降の位置づけに使用が限られています。一方、HER2陽性の手術不能又は再発乳癌の標準的な治療の選択肢として位置付けにあるトラスツズマブBS「第一三共」は、他の競合品(先発品ハーセプチン®やそのバイオシミラー)に対して乳癌「B法」の承認取得で後れをとっています。これらの課題なども含め、エンハーツ®とトラスツズマブBSとでどのように癌領域戦略を進めていくのか今後注目されます。



コメント