参天製薬は、眼科分野に経営資源を集中しています。日本での売上に大きな貢献をしている主要製品として、アイリーア®、アレジオン®、ジクアス®が挙げられます。特に、アイリーア®(一般名:アフリベルセプト(Aflibercept))は、製造販売元であるバイエル薬品とのコ・プロモーション製品として、参天製薬が日本で601億円(2019年度)を売り上げている眼科用VEGF阻害剤であり、参天製薬の日本における売上収益の36%を占めています。
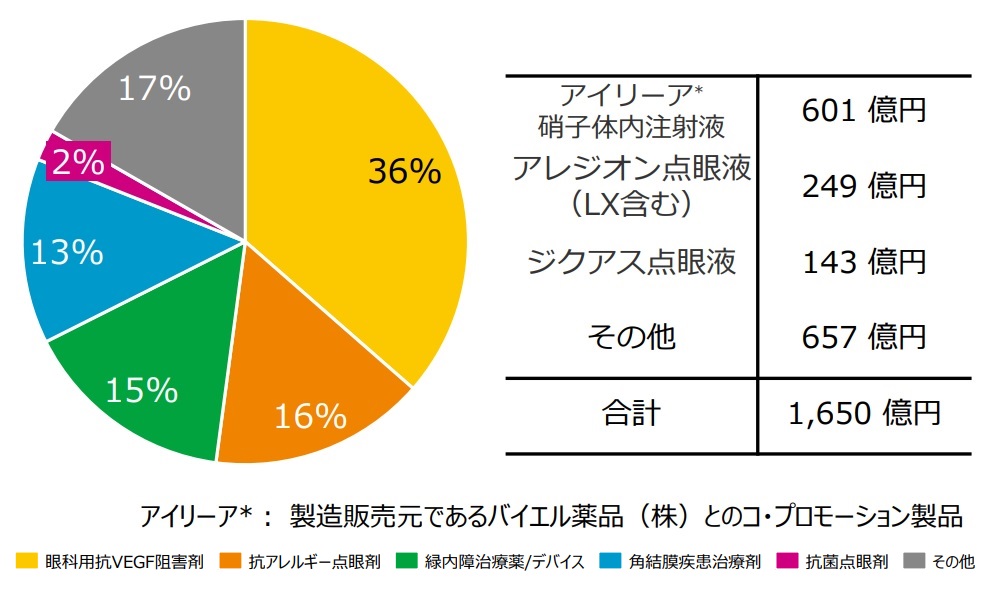
本記事では、参天製薬の日本での売上に大きく貢献しているアイリーア®を中心に、参天製薬が販売する眼科製品(アレジオン®、ジクアス®)の日本での市場独占に関連する知的財産状況を眺めます。
1.アイリーア®について
アイリーア®(一般名:アフリベルセプト(遺伝子組換え)(Aflibercept))は、血管内皮増殖因子(vascular endothelial growth factor: VEGF)との優れた結合親和性を有する薬剤の創出を目的に、ヒト免疫グロブリン(Ig)G1のFcドメインにヒトVEGF受容体(VEGFR)の細胞外ドメインを結合した遺伝子組換え融合糖タンパク質で、Regeneron社で創製されました。アイリーア®硝子体内注射液40mg/mLは、硝子体内投与用に特別に精製したアフリベルセプトの等張性注射剤であり、Regeneron社及びBayer社によって共同開発された新規の眼科用VEGF阻害剤です。
日本では、バイエル薬品が、2012年9月28日に、「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」を効能又は効果として製造販売承認を取得しました。その後、2013年11月22日に「網膜中心静脈閉塞症に伴う黄斑浮腫」、2014年9月19日に「病的近視における脈絡膜新生血管」、2014年11月18日に「糖尿病黄斑浮腫」、2015年6月26日に「網膜静脈閉塞症に伴う黄斑浮腫」、2020年3月25日に「血管新生緑内障」(希少疾病用医薬品)を効能又は効果として承認を取得しました。
2.アイリーア®に関するバイエル薬品と参天製薬との販売提携契約
2020年2月7日付のRegeneron社のSEC Filing Form 10-K(EX-10.10.2 SECOND AMENDMENT AGREEMENT TO BAYER LCA)によると、バイエル薬品と参天製薬との間で締結された2012年5月7日付販売提携契約(2016年7月14日修正)に基づき、参天製薬が日本でアフリベルセプト硝子体内注射液(ライセンス製品)を販売することに合意していました(2012.5.8 参天製薬/バイエル薬品 press release: VEGF Trap-Eye(アフリベルセプト硝子体内注射液)に関する販売提携契約締結のお知らせ)が、この販売提携契約が 2021年12月31日に満了するため、将来の抗VEGF市場の予期される変化やライセンス製品の発売可能性を考慮して、2019年12月19日に、2022年1月1日に開始する当事者の義務を伴う販売提携延長契約が締結されました(2019.12.20 参天製薬/バイエル薬品 press release: VEGF Trap-Eye(アフリベルセプト硝子体内注射液)に関する販売提携契約締結のお知らせ)。
3.アイリーア®の独占期間(日本)
(1)再審査期間
アイリーア®の再審査期間は、血管新生緑内障以外の効能・効果について、2020年9月27日までとなっていることから、その後、ジェネリックメーカーは血管新生緑内障以外の効能・効果についてバイオシミラーの承認申請(いわゆる虫食い申請)をすることができると考えられます(表1)。
(2)特許権存続期間
J-PlatPatによると、バイオシミラー参入障壁となり得るアイリーア®硝子体内注射液または注射用キット40mg/mLを保護する日本特許として、少なくとも3件の特許と存続期間延長登録出願の存在がわかります(表1)。
3つの特許のうち、アイリーア®の基本特許といえる物質特許4723140について、「アイリーア硝子体内注射液または注射用キット40mg/mLアフリベルセプト(遺伝子組換え)」を処分対象物とし、「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」を特定用途として延長登録された特許権の存続期間満了日が、2021年11月4日となります。
従って、バイオシミラーメーカーは、2021年11月4日以降、製剤特許5216002や他の有効に存続する特許権を侵害しない限り、硝子体内注射液または注射用キット40mg/mLアフリベルセプトについて、「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」を効能・効果としたバイオシミラーの承認(いわゆる虫食い承認)を取得するチャンスが到来すると考えられます。
| 中心窩下脈絡膜新生血管を伴う加齢黄斑変性 | 網膜中心静脈閉塞症に伴う黄斑浮腫 | 病的近視における脈絡膜新生血管 | 糖尿病黄斑浮腫 | 網膜静脈閉塞症に伴う黄斑浮腫(但し、網膜中心静脈閉塞症に伴う黄斑浮腫を除く) | 血管新生緑内障 | |
| 再審査期間 | ~2020.9.27 | ~2020.9.27 | ~2020.9.27 | ~2020.9.27 | ~2020.9.27 | ~2030.3.24 |
| 4723140 物質特許 | +1y5m12d 2021.11.4 | +2y7m6d 2022.12.29 | +3y5m3d 2023.10.26 | +3y7m2d 2023.12.25 | +3y4m22d 2023.9.15 | +5y? 2025.5.23 |
| 5273746 用途特許 | +0y0m0d 2020.5.23 | +5m28d 2020.10.20 | +1y3m25d 2021.9.17 | +1y5m24d 2021.10.16 | +2y1m1d 2022.6.24 | +5y? 2025.5.23 |
| 5216002 製剤特許 | +0y0m0d 2027.6.14 | +8m13d 2028.2.27 | +1y6m10d 2028.12.24 | +1y8m9d 2029.2.23 | +2y3m17d 2029.10.1 | +5y? 2032.6.14 |
4.アイリーア®を取り巻く脅威(日本)
眼科用VEGF阻害薬「アイリーア®」に迫る現在又は近い将来の脅威として、
(1)ヒト化抗VEGFモノクローナル抗体Fab断片「ルセンティス®(ラニビズマブ)」のバイオシミラー(千寿製薬)の参入(開発コードSJP-0133、2020年3月時点でPIII)
(2)「アイリーア®(アフリベルセプト)」のバイオシミラーの参入
- 2019.12.02 社ジーンテクノサイエンス press release: 癸巳化成株式会社とのアフリベルセプトバイオシミラーにかかる共同開発契約の締結に関するお知らせ
- 2020.02.06 バイオジェン press release: バイオジェン、2019年度通年で144億ドルの売上を達成・・・「2019年12月、バイオジェンはサムスンバイオエピス社との取引を完了し、米国、カナダ、ヨーロッパ、日本、オーストラリアを含む全世界の主要市場で、眼疾患領域の2つの新規バイオシミラー候補、SB11(先発品ルセンティス)およびSB15(先発品アイリーア)を独占的に販売する権利を確保」
(3)ヒト化抗VEGFモノクローナル抗体一本鎖Fv断片「ベオビュ®(ブロルシズマブ)」(ノバルティス)の登場
- 2020.05.25 ノバルティス press release: ノバルティス ファーマ、中心窩下脈絡膜新生血管を伴う加齢黄斑変性に対する新たな眼科用VEGF阻害剤「ベオビュ®硝子体内注射用キット120mg/mL」を発売)
(4)抗VEGF/Ang2バイスペシフィック抗体ファリシマブ(中外製薬)の登場(開発コードRG7716 、2020年4月時点でPIII、2021年申請予定)
が挙げられます。
参天製薬としては、アイリーア®の販売提携延長契約を締結しましたが、アイリーア®に大きく依存した状況から早く脱却することが望まれます。
5.アレジオン®
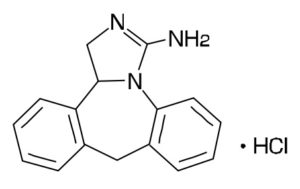 抗アレルギー点眼剤アレジオン®には、1日4回点眼のアレジオン®点眼液0.05%と1日2回点眼のアレジオンLX点眼液0.1%があります。有効成分であるエピナスチン塩酸塩(Epinastine hydrochloride)は1975年にドイツベーリンガーインゲルハイム社により合成されたアレルギー性疾患治療剤で、参天製薬は、アレルギー性結膜炎治療の新たな選択肢として本剤を導入し、「アレルギー性結膜炎」を効能・効果として、2013年9月20日にアレジオン®点眼液0.05%、2019年9月20日にアレジオンLX点眼液0.1%の製造販売承認を取得しました。
抗アレルギー点眼剤アレジオン®には、1日4回点眼のアレジオン®点眼液0.05%と1日2回点眼のアレジオンLX点眼液0.1%があります。有効成分であるエピナスチン塩酸塩(Epinastine hydrochloride)は1975年にドイツベーリンガーインゲルハイム社により合成されたアレルギー性疾患治療剤で、参天製薬は、アレルギー性結膜炎治療の新たな選択肢として本剤を導入し、「アレルギー性結膜炎」を効能・効果として、2013年9月20日にアレジオン®点眼液0.05%、2019年9月20日にアレジオンLX点眼液0.1%の製造販売承認を取得しました。
J-PlatPatによると、ジェネリック参入障壁となり得るアレジオン®を保護する日本特許として、少なくとも2件の日本特許とそれらの存続期間延長登録出願の存在がわかります(表2)が、いずれもアレジオンLX点眼液0.1%を保護する製剤特許であって、アレジオン®点眼液0.05%を保護しません。アレジオン®点眼液0.05%を保護する特許は存在しない(既に満了している)と推測され、再審査期間が2019年9月19日に終了していることから、既にアレジオン®点眼液0.05%のジェネリックの承認申請がされている可能性があります。2021年にはアレジオン®点眼液0.05%のジェネリックが上市されているかもしれません。
| 特許番号 | 発明の名称 | 出願日 | 延長登録出願番号 | 存続期間満了日 |
| 6487609 | 点眼剤 | 2017.12.27 | 2019-700732 | 2037.12.27 +延長を求める期間: 6月18日 |
| 6134853 | エピナスチン含有点眼液 | 2016.10.28 | 2019-700731 | 2036.10.28 +延長を求める期間: 2年4月22日 |
6.ジクアス®
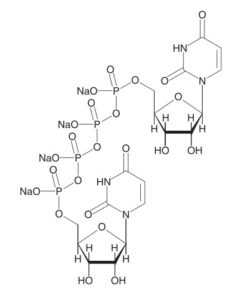 ジクアス®は、米国のインスパイア社で開発された P2Y2受容体作動薬であるジクアホソルナトリウム(Diquafosol Sodium)を有効成分とする製剤です。参天製薬は、インスパイア社からジクアホソルナトリウムを導入し、日本においてドライアイ患者を対象とした臨床試験を実施し、2010年4月にドライアイ治療用点眼剤として製造販売承認を取得しました。再審査期間は終了しています(8年: 2010年4月16日~2018年4月15日)。
ジクアス®は、米国のインスパイア社で開発された P2Y2受容体作動薬であるジクアホソルナトリウム(Diquafosol Sodium)を有効成分とする製剤です。参天製薬は、インスパイア社からジクアホソルナトリウムを導入し、日本においてドライアイ患者を対象とした臨床試験を実施し、2010年4月にドライアイ治療用点眼剤として製造販売承認を取得しました。再審査期間は終了しています(8年: 2010年4月16日~2018年4月15日)。
J-PlatPatによると、ジェネリック参入障壁となり得るジクアス®を保護する日本特許として、少なくとも3件の特許と存続期間延長登録出願の存在がわかります(表3)。3つの特許のうち、ジクアス®の基本特許といえる物質特許3723227について、延長された特許権が、2023年2月まで存続します。
| 特許番号 | 発明の名称 | 出願日 | 延長登録出願番号 | 存続期間満了日 |
| 4003008 用途特許 | 角膜上皮伸展促進剤 | 2001.5.30 | 2010-700122 (拒絶査定) | 2021.5.30 |
| 3723227 物質特許 | ジ(ウリジン5’)-テトラホスフェート 及びその塩の大規模生産のための方法 | 1998.7.24 | 2010-700120 | 2023.2.17 |
| 3652707 製剤特許 | プリン受容体アゴニストによる ドライアイ疾患の治療法 | 1998.2.6 | 2010-700121 | 2023.2.6 |

コメント
点眼薬は後発医薬品が入りにくい印象があるのですが、どうなんでしょうか(水を使うので別の製造ラインを設ける必要がある)。
参天は特許切れしてる製品も一定割合ある印象です。
コメントありがとうございます。例えば、クラビット点眼液は後発医薬品が多数ありますが、ご指摘のように製剤の特徴等によっては入りにくい状況もあるのでしょうね。
【追記】2021年2月15日、アレジオン®点眼液0.05%の後発医薬品であるエピナスチン塩酸塩点眼液0.05%が初承認(10社以上)。そのうち、参天アイケアがAG承認取得(エピナスチン塩酸塩点眼液0.05%「SEC」)。
【追記】2021年6月17日、厚労省は後発医薬品など23成分178品目の薬価基準追補収載を官報告示、18日に収載。アレジオン点眼液0.05%(エピナスチン塩酸塩)に初の後発医薬品が収載(収載会社数12社)。参天アイケアのAGは収載されず。
【追記】ドライアイ治療剤ジクアス®の基本特許といえる物質特許3723227について延長された特許権が2023年2月に満了し、ジクアス®の初の後発医薬品となる東亜薬品のジクアホソルNa点眼液3%「ニットー」が2023年12月8日に薬価収載となる。