帝人は、2020年2月5日に中期経営計画 2020-2022、5月8日に2019年度決算及び2020年度業績見通しを発表しました。現時点での帝人グループ・ヘルスケア事業にとっての最大の経営課題は、主力薬である高尿酸血症・痛風治療剤フェブリク®(一般名: フェブキソスタット)の後発品参入の影響を最小化すること、すなわち、フェブリク・パテントクリフによる売上収益の落ち込みを、新事業の拡大、医薬・在宅医療事業の生産性向上とコスト構造改革でカバーすることです(2020.02.05 帝人中期経営計画 2020-2022―ALWAYS EVOLVING―説明資料)。本記事では、帝人グループのヘルスケア事業のうち、医薬品事業における知的財産活動の景色を眺めます。
1.フェブリク・パテントクリフ
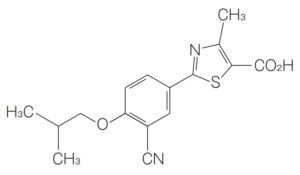 帝人グループ・ヘルスケア事業の2019年度売上高1,539億円のうち、フェブリク®国内売上高は386億円(2020.05.08 帝人2019年度決算及び2020年度業績見通し説明資料)と大きな比率を占めていることから、2022年に想定されるフェブリク・パテントクリフによる売上収益の落ち込みがヘルスケア事業に大きなインパクトを与えると想像できます。国内におけるフェブリク®の物質特許は2016年に満了、結晶特許も一部請求項の無効が確定したため、フェブリク®のジェネリックが、再審査期間終了(2021年1月20日)後には申請、2022年には承認・販売されると想定されます。現在、フェブリク®の効能・効果のうち、「がん化学療法に伴う高尿酸血症」を保護すると思われる用途特許5907396に対して沢井製薬が無効審判を請求しています(無効2020-800008)。また、2020年4月28日に、同特許に対して別の無効審判が請求されました(無効2020-800044)。帝人としては、この効能・効果についてはジェネリックに承認を与えないために無効審判を戦うことになると思われます。
帝人グループ・ヘルスケア事業の2019年度売上高1,539億円のうち、フェブリク®国内売上高は386億円(2020.05.08 帝人2019年度決算及び2020年度業績見通し説明資料)と大きな比率を占めていることから、2022年に想定されるフェブリク・パテントクリフによる売上収益の落ち込みがヘルスケア事業に大きなインパクトを与えると想像できます。国内におけるフェブリク®の物質特許は2016年に満了、結晶特許も一部請求項の無効が確定したため、フェブリク®のジェネリックが、再審査期間終了(2021年1月20日)後には申請、2022年には承認・販売されると想定されます。現在、フェブリク®の効能・効果のうち、「がん化学療法に伴う高尿酸血症」を保護すると思われる用途特許5907396に対して沢井製薬が無効審判を請求しています(無効2020-800008)。また、2020年4月28日に、同特許に対して別の無効審判が請求されました(無効2020-800044)。帝人としては、この効能・効果についてはジェネリックに承認を与えないために無効審判を戦うことになると思われます。
国内におけるフェブリク®の知的財産権による保護についての詳細はこちら・・・
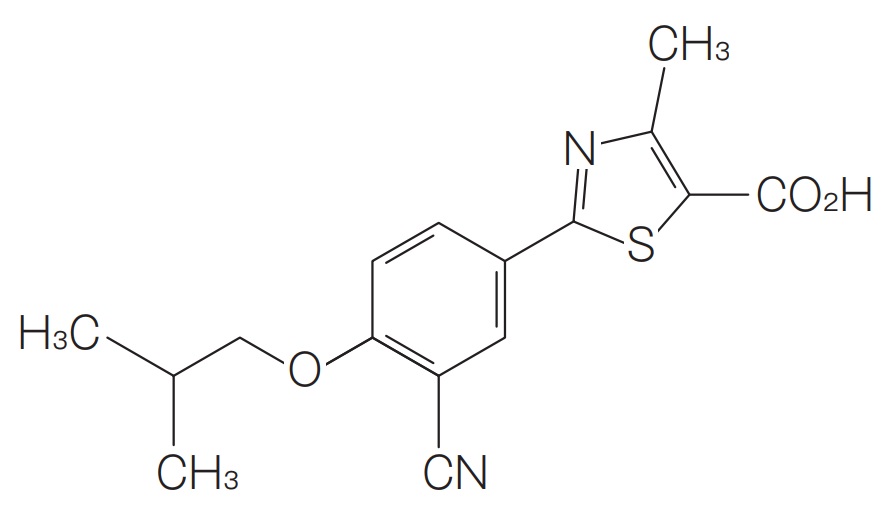
欧米においては、既にフェブキソスタットのジェネリックの参入が始まり、導出先のひとつである武田薬品(商品名はUROLIC ®(ユーロリック))での海外売上(2018年度511億円から2019年度169億円。2020年度は30億円の見込み)は減少しています(2020.05.13 武田薬品2019年度本決算データブック)。中国においては、2010年よりアステラス製薬と取り組みを続け、2019年に販売を開始しました(2019.03.04 帝人ファーマ press release: 中国でフェブキソスタットの販売を開始)。
2.中期経営計画期間中に上市を見込む新薬と知的財産
帝人は、ヘルスケア事業について、フェブリク・クリフによる落ち込みを新事業の拡大と医薬・在宅医療事業の生産性向上とコスト構造改革でカバーする、具体的には、既存事業で培った強みを活かし、リハビリ/介護や予防/健康増進領域を含む地域密着型総合ヘルスケアサービス事業を展開するとしています(中期経営計画 2020-2022―ALWAYS EVOLVING―説明資料)。上記の通り、事業展開の方向性は医薬品中心ではありませんが、中期経営計画期間中に上市を見込む新薬として、
- A型ボツリヌス毒素製剤NT-201
- 骨粗鬆症治療剤ITM-058(アバロパラチド酢酸塩)
が挙げられています。
例えば、自立支援のための医療技術・サービスの提供への事業展開においては、歩行神経筋電気刺激装置や上肢麻痺のリハビリロボットをNT-201等と合わせ、脳卒中発症から予後までの総合ソリューションを提供することが次世代成長領域として描かれています。
以下に上記2つの医薬開発品の知的財産について眺めていきます。
(1)A型ボツリヌス毒素製剤NT-201
NT-201は、メルツ(Merz)社が創製したA型ボツリヌス毒素製剤であり、2005年に医療用医薬品として欧州で最初に承認されて以降、既に米国を含む世界50カ国以上で販売されており、欧米においては上肢痙縮(けいしゅく)、痙性斜頸、眼瞼痙攣を適応症として処方されています(商品名Xeomin®)。2017年に、帝人は、メルツ社から日本における共同開発・独占販売権を取得しました(2017.10.12 帝人 press release: 新規ボツリヌス毒素製剤の国内共同開発・独占販売契約を締結)。帝人は、2019年8月に「上肢痙縮」に対する製造販売承認申請を実施したと発表しています(2020.05.08 帝人 2019年度決算及び2020年度業績見通し説明資料)。
メルツ社(北米)website(https://www.merzusa.com/patents/)にはXeomin® (incobotulinumtoxinA)を保護する米国特許7,927,836、8,398,998、9,937,245、9,217,172が掲載されています。
そして、それら米国特許の日本ファミリーとして存続しているものは以下の3件となります。
| 特許番号 | 特許権者 | 発明の名称 | 存続期間満了日 |
| 4879978 | メルツ | 生物活性化合物を発酵生産するための装置及び方法 | 2026.06.02 |
| 6517800 | メルツ | ボツリヌス毒素の高純度神経毒成分の製造方法とその使用 | 2034.07.30 |
| 5877617 | セルスナップ | 毒素産生性試験のための組成物および方法 | 2032.09.28 |
(2)骨粗鬆症治療剤ITM-058(アバロパラチド酢酸塩)
2003年、帝人は、イプセン(Ipsen)社からBIM44058 (現コード名: ITM-058)の日本における独占開発・販売権を取得しました(2003.07.07 帝人 press release: 帝人株式会社と仏イプセン社とのライセンス契約について)。イプセン社は、BIM44058(別コード名: BA058、abaloparatide-SC)の日本を除く独占開発・販売権を2005年にRadius社に許諾します。Radius社は、日本以外の国でその開発を進め、2017年4月28日に米国で承認を取得しました(商品名: TYMLOS)。帝人はイプセン社との契約の下、日本で開発を進めてきましたが、2017年7月13日、日本でITM-058を開発・製造・販売するためにRadius社のabaloparatide-SCに関する承認申請資料等の利用する権利及び知的財産について日本での一定範囲の独占実施権等をRadius社から取得することとなりました(2017.07.13 Radius press release: Radius Health Announces License and Development Agreement for Abaloparatide-SC with Teijin Limited in Japan)。この契約により、帝人は、Radius社に対して一定のマイルストン達成に伴う支払い及び一定期間売上に対するロイヤルティの支払いの義務等を負います(2017.07.13 Radius SEC Filing Form 8-K)。また、イプセン社とRadius社の間で契約を巡る争いがあり、仲裁による決定がなされています(2018.06.12 Radius SEC Filing Form 8-K)。
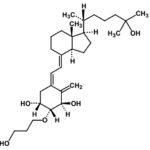
Radius社が承認を取得したTYMLOS(アバロパラチド(Abaloparatide))についてOrange Bookに収載されている米国特許は、8,148,333、7,803,770、8,748,382の3つです(2020.05.23調べ)。そして、それら米国特許の日本ファミリーとして存続しているものは、特許5375611号のみとなります。この特許権は、イプセン社とRadius社が共同権利者であり、存続期間満了日は2027年10月3日となっています。この特許権がITM-058を保護するものであるならば、存続期間延長登録出願により存続期間はさらに最大5年間延長されると想定されます(注: Orange Bookの米国特許情報に基づいてファミリー検索しているだけであるため、日本において、ITM-058を保護する特許は上記だけとは限りません)。
特許5375611号の請求項1:
a) 配列[Glu22,25、Leu23,28,31、Aib29、Lys26,30]hPTHrP(1~34)NH2(配列番号:2)を有するPTHrPアナログ;および
b) pHを4.5~5.6の範囲に維持するのに有効な量のpHバッファー
を含む、被験体への投与に適した保存安定組成物。

特許5375611号の請求項1に記されている「PTHrPアナログ」そのものの発明は過去に進歩性を否定されましたね・・・


コメント
【追記】
2020.05.27 帝人ファーマ press release: 骨粗鬆症薬「アバロパラチド酢酸塩」の製造販売承認を申請
https://www.teijin.co.jp/news/2020/05/27/20200527_02.pdf
【追記】
2020.06.29 帝人ファーマ press release: A型ボツリヌス毒素製剤の製造販売承認を取得
https://www.teijin-pharma.co.jp/pressrelease/2020/20200629.html
2021.03.23 帝人ファーマ press release: 「オスタバロ皮下注カートリッジ 3mg」の製造販売承認を取得
https://www.teijin-pharma.co.jp/pressrelease/2021/20210323.html
「オスタバロ皮下注カートリッジ 3㎎」(一般名:アバロパラチド酢酸塩)について、骨折の危険性の高い骨粗鬆症を効能・効果として承認取得。