2020年4月27日、第一三共は2019年度(2020年3月期)本決算を発表しました(第一三共2020年3月期決算短信)。本記事では、現時点での第一三共の知的財産活動の景色を2019年度決算資料や他の公表情報・過去記事から振り返ります。
1.オルメサルタン・パテントクリフのその後
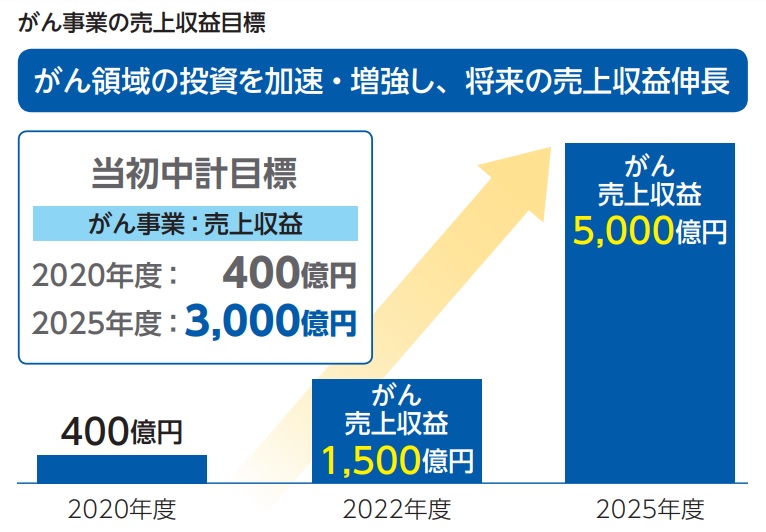
第一三共は、2016年度から2020年度までの第4期中期経営計画を2025年ビジョンに向けた転換を実現するための5カ年計画と位置付け、高血圧症治療剤オルメサルタンのパテントクリフの克服とその後の持続的成長基盤の確立という2つの経営課題に取り組んでいます。ひとつ前の第3期中期経営計画の経営課題(2013~2017年度)も、「オルメサルタンのパテントクリフを越え、持続的成長を実現するために、抗血小板剤プラスグレル・抗凝固剤エドキサバンにいかにスムーズにつないでいくか」ということでした。このように、長期にわたり第一三共が取り組んできた最大の経営課題は「オルメサルタンのパテントクリフ」を乗り越えることでした。
- 2014.01.09記事: オルメサルタン(Olmesartan)のパテントクリフ

その後、オルメサルタン・パテントクリフを乗り越えることができたのでしょうか・・・
第一三共により発表された2019年度(2020年3月期)及び2015年度(2016年3月期)の決算補足資料中の数値から2020年度の予想も含めたグローバル主要製品の売上収益をまとめました(図1)。
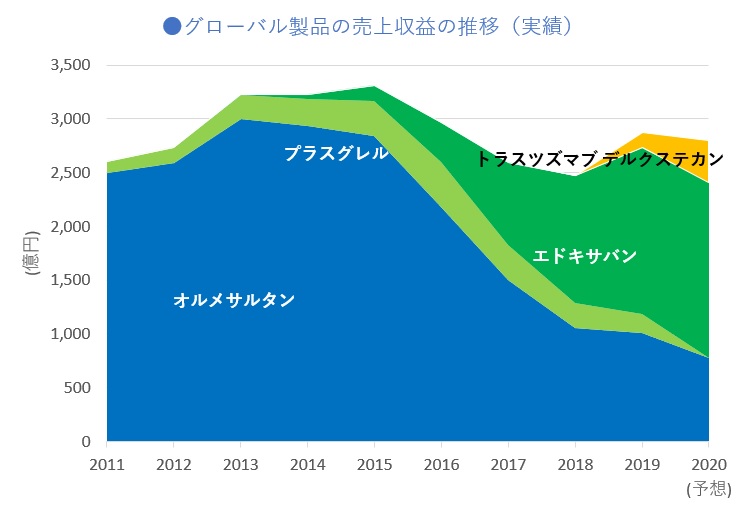
*プラスグレルの2020年度予想は非開示
オルメサルタン・パテントクリフは、2016年度から売上に大きな影響を与え始めたものの、エドキサバンの成長で概ね持ちこたえ、トラスツズマブ デルクステカンの成長への期待が見えてきているように思えます。
2.主力製品エドキサバンと知的財産権による保護
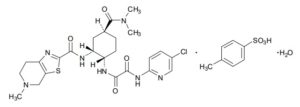 第一三共は、エドキサバンを、特許期間が満了したオルメサルタンに代わる主力品と位置づけ、大型化へ向けた取り組みをグローバルで進めています。エドキサバン(Edoxaban)は、第一三共が創製した低分子の経口抗凝固剤で、FXaを選択的、可逆的かつ直接的に阻害することにより、血栓形成抑制作用を発現します。日本では、2011年4月22日にリクシアナ®錠として、米国では2015年1月8日にSAVAYSA®として承認を取得しました。
第一三共は、エドキサバンを、特許期間が満了したオルメサルタンに代わる主力品と位置づけ、大型化へ向けた取り組みをグローバルで進めています。エドキサバン(Edoxaban)は、第一三共が創製した低分子の経口抗凝固剤で、FXaを選択的、可逆的かつ直接的に阻害することにより、血栓形成抑制作用を発現します。日本では、2011年4月22日にリクシアナ®錠として、米国では2015年1月8日にSAVAYSA®として承認を取得しました。
(1)リクシアナ®の再審査期間(日本)
リクシアナ錠・OD錠、いずれの効能・効果においても2019年4月21日に終了しています(表1)。
| リクシアナ錠 15mg・錠30mg | 下記の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制 膝関節全置換術、股関節全置換術、股関節骨折手術 8 年(2011年4月22日~2019年4月21日) 非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制 静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制 上記再審査期間の残余期間(2014年9月26日~2019年4月21日) |
| リクシアナ錠60mg | リクシアナ錠15mg・錠30mgの再審査期間の残余期間(2014年9月26日~2019年4月21日) |
| リクシアナOD錠15mg・OD錠30mg・OD錠60mg | リクシアナ錠15mg・錠30mg の再審査期間の残余期間(2017年8月16日~2019年4月21日) |
(2)リクシアナ®の製品保護特許(日本)
J-PlatPatにより、リクシアナ®を保護する日本特許として7件の特許とそれら特許権の存続期間延長登録出願の存在がわかります(表2)。
各特許権において、それぞれ特許請求の範囲は異なることや、延長登録された場合の存続期間満了日は延長登録毎に算出されることから、リクシアナ®の製品保護期間を一概に言うことはできませんが、7つの特許のうち、リクシアナ®の基本特許といえる特許4128138及び特許4109288について、「リクシアナ錠15mgまたは30mg」を処分対象物とし、「膝関節全置換術,股関節全置換術,股関節骨折手術の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制」を特定用途として延長登録された存続期間満了日は、それぞれ2025年5月19日または2027年1月4日となります。
従って、ジェネリックメーカーは、2027年1月4日には、他の有効に存続する特許権を侵害しない限り、エドキサバン錠15mgまたは30mgについて、「膝関節全置換術,股関節全置換術,股関節骨折手術の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制」を効能・効果としたジェネリックの承認(いわゆる虫食い承認)を取得するチャンスが到来すると考えられます。
| 特許番号 | 発明の名称 | (原)出願日 | 延長登録出願番号 | 存続期間満了日 |
| 6061438 | ジアミン誘導体含有医薬組成物 | 2012.08.09 | 2017-700288 2017-700287 2017-700286 2017-700285 2017-700284 2017-700283 2017-700282 2017-700281 | 2033.04.02* |
| 5390014 | 抗凝固剤の溶出改善方法 | 2011.03.14 | 2017-700280 2017-700279 2017-700278 2017-700277 2017-700276 2017-700275 2017-700274 2017-700273 2014-700267 2014-700266 2014-700265 2014-700264 2014-700263 2014-700262 | 2035.01.11* |
| 5305421 | ジアミン誘導体の製造方法 | 2009.12.15 | 2017-700272 2017-700271 2017-700270 2017-700269 2017-700268 2017-700267 2017-700266 2017-700265 2014-700261 2014-700260 2014-700259 2014-700258 2014-700257 2014-700256 | 2034.01.25* |
| 4463875 | 医薬組成物 | 2008.03.28 | 2014-700255 2014-700254 2014-700253 2014-700252 2014-700251 2014-700250 2011-700169 2011-700168 | 2032.10.28* |
| 4510088 | 光学活性なジアミン誘導体およびその製造方法 | 2006.09.15 | 2017-700264 2017-700263 2017-700262 2017-700261 2017-700260 2017-700259 2017-700258 2017-700257 2014-700249 2014-700248 2014-700247 2014-700246 2014-700245 2014-700244 2011-700167 2011-700166 | 2031.09.15* |
| 4109288 | ジアミン誘導体 | 2003.12.25 | 2017-700256 2017-700255 2017-700254 2017-700253 2017-700252 2017-700251 2017-700250 2017-700249 2014-700243 2014-700242 2014-700241 2014-700240 2014-700239 2014-700238 2011-700165 2011-700164 | 2028.12.25* 但し、 ・2011-700165 ・2011-700164 の延長期間は3年10日のため満了日は2027.01.04となる。 「リクシアナ錠15mgまたは30mg」を処分対象物、下記用途の延長登録に関する。 「下記の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制 膝関節全置換術,股関節全置換術,股関節骨折手術」 |
| 4128138 | ジアミン誘導体 | 2002.6.20 | 2017-700248 2017-700247 2017-700246 2017-700245 2017-700244 2017-700243 2017-700242 2017-700241 2014-700237 2014-700236 2014-700235 2014-700234 2014-700233 2014-700232 2011-700163 2011-700162 | 2027.06.20* 但し、 ・2011-700163 ・2011-700162 の延長期間は2年10月29日のため満了日は2025.05.19となる。 「リクシアナ錠15mgまたは30mg」を処分対象物、下記用途の延長登録に関する。 「下記の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制 膝関節全置換術,股関節全置換術,股関節骨折手術」 |
*存続期間満了日の表記はJ-PlatPatより(個々の延長登録により異なるので注意)
(3)SAVAYSA®の製品保護特許(米国)
米国では制限付きの承認となったことから市場浸透に苦戦を強いられているようです。Orange Bookに収載されている米国特許は表3のとおりです。物質特許である米国特許7,365,205は特許期間延長が認められ、満了日は2027年4月18日となります。2015年1月8日に承認されたSAVAYSA®のNCEとしてのデータ保護期間は既に終了しているため、ジェネリックメーカーは、2027年4月18日には、製剤特許9,149,532の特許権を侵害しない限り、ジェネリックの承認を取得・販売を開始する可能性が考えられます。その前に、ジェネリックメーカーはANDA(Para IV)を仕掛けてくることもあり得ます。
| Patent No | Patent Expiration | メモ |
| 7,365,205 | 2023.06.12 | 物質特許 PAIRによると、1,406 daysの延長登録 (特許満了日2027年4月18日) |
| 9,149,532 | 2028.03.28 | 製剤特許 |
(4)エドキサバン・パテントクリフ
オルメサルタンのパテントクリフを乗り越える原動力となり、2019年度には全世界で1500億円を上回る売上に到達したエドキサバンですが、日本などで、2027年以降、次のクリフに直面するかもしれません。先発医薬品ビジネス特有のリスクとしてパテントクリフは必ずやってきます。たとえそれを乗り越えたとしても、また次のパテントクリフが待ち構えています。必ずやって来るパテントクリフを乗り越えるために次世代成長ドライバーとなる新薬を創出し続けていかなければならないことは先発医薬品メーカーとってビジネス上の宿命といえます。

そのような経営リスクに対して第一三共が大きく舵を切った取り組みのひとつが、「がん事業の立上げ」といえるでしょう。
3.国内主力製品と知的財産権による保護
(1)メマリー® アルツハイマー型認知症治療剤メマリー®(一般名:メマンチン)は、ドイツの Merz Pharmaceuticals GmbH で開発された、N-methyl-D-aspartate(NMDA)受容体拮抗を作用機序とするアルツハイマー型認知症の治療剤です。欧州では2002年、米国では2003年に、アルツハイマー型認知症を適応として承認されており、日本では2011年に承認され、2019年度(2020年3月期)の国内売上は505億円となりました。
アルツハイマー型認知症治療剤メマリー®(一般名:メマンチン)は、ドイツの Merz Pharmaceuticals GmbH で開発された、N-methyl-D-aspartate(NMDA)受容体拮抗を作用機序とするアルツハイマー型認知症の治療剤です。欧州では2002年、米国では2003年に、アルツハイマー型認知症を適応として承認されており、日本では2011年に承認され、2019年度(2020年3月期)の国内売上は505億円となりました。
J-PlatPatでメマリー®の特許権の存続期間延長登録出願の存在はヒットしないことから、メマリー®を保護する日本特許は存在しない(満了している)と思われ、再審査期間が2019年1月20日に終了したことにより、2020年2月17日、メマリー®のジェネリックが初承認となりました(22社100品目)。6月の薬価収載を経て発売されることになります。第一三共はAG投入(AGも同日承認)に踏み切りましたが、今後の売上への影響は免れないでしょう(2020.02.17 第一三共エスファ株式会社 press release: 中枢神経系領域におけるオーソライズド・ジェネリック(AG)製品の製造販売承認取得のお知らせ)。
(2)ネキシウム®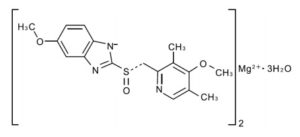 抗潰瘍剤ネキシウム®(一般名:エソメプラゾール)は、アストラゼネカ社が開発した、ラセミ体であるオメプラゾールの一方の光学異性体(S体)を含有するプロトンポンプインヒビターです。日本では2011年に承認され、2019年度(2020年3月期)の国内売上は798億円となりました。
抗潰瘍剤ネキシウム®(一般名:エソメプラゾール)は、アストラゼネカ社が開発した、ラセミ体であるオメプラゾールの一方の光学異性体(S体)を含有するプロトンポンプインヒビターです。日本では2011年に承認され、2019年度(2020年3月期)の国内売上は798億円となりました。
再審査期間は、成人10年(2011年7月1日~2021年6月30日)及び小児4年(2018年1月19日~2022年1月18日)となっています。
J-PlatPatによると、ネキシウム®について存続期間延長登録出願された特許は9件存在することがわかりますが、現在も存続しているのは製剤特許5171259のみとなります(ネキシウム懸濁用顆粒分包10mg、20mgについては5年の期間延長登録により満了日は2030年12月20日)。
従って、ジェネリックメーカーは、製剤特許5171259を回避した製剤を開発できれば、再審査期間の終了後、ネキシウム®のジェネリックの申請、承認が可能になると考えられます。

メマリー®もネキシウム®も古くに創製された薬剤・・・特許権よりも、再審査期間による独占販売期間に助けられたね・・・
4.がん事業の礎トラスツズマブ デルクステカンと知的財産権による保護
第一三共は、「がんに強みを持つ先進的グローバル創薬企業」となることを2025年ビジョンとして掲げています(2016年3月発表)。中でも、トラスツズマブ デルクステカン(Trastuzumab Deruxtecan、DS-8201、日米製品名:エンハーツ®(ENHERTU®))は、第一三共とってがん領域における初のグローバル製品で、これからのがん事業の礎として成長が大いに期待されています。
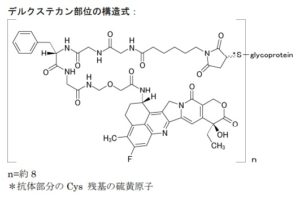 トラスツズマブ デルクステカンは、第一三共が創製した、ヒト上皮細胞増殖因子受容体 2(human epidermal growth factor receptor 2: HER2)に対するヒト化モノクローナル抗体(MAAL-9001)とトポイソメラーゼ I 阻害作用を有するカンプトテシン誘導体(MAAA-1181a)を、リンカーを介して結合させた抗体薬物複合体(antibody-drug conjugate: ADC)です。米国では2019年12月20日に承認を取得、販売を開始し、日本では2020年3月25日に承認を取得し、市場への浸透と適応症の拡大が最重点課題となっています。第一三共は、2019年3月に全世界(第一三共が独占的権利を有する日本は除く)においてトラスツズマブ デルクステカンを共同で開発及び商業化する契約をアストラゼネカ社と締結しました。
トラスツズマブ デルクステカンは、第一三共が創製した、ヒト上皮細胞増殖因子受容体 2(human epidermal growth factor receptor 2: HER2)に対するヒト化モノクローナル抗体(MAAL-9001)とトポイソメラーゼ I 阻害作用を有するカンプトテシン誘導体(MAAA-1181a)を、リンカーを介して結合させた抗体薬物複合体(antibody-drug conjugate: ADC)です。米国では2019年12月20日に承認を取得、販売を開始し、日本では2020年3月25日に承認を取得し、市場への浸透と適応症の拡大が最重点課題となっています。第一三共は、2019年3月に全世界(第一三共が独占的権利を有する日本は除く)においてトラスツズマブ デルクステカンを共同で開発及び商業化する契約をアストラゼネカ社と締結しました。
アストラゼネカ社のAstraZeneca Annual Report & Form 20-F Information 2019 / Additional Information中の項目「Patent Expiries of Key Marketed Products」(p243)には、ENHERTU®のnew molecular entityに関連する特許満了時期が、米国では2033年、中国では2033-2035年、欧州では2033-2035年、日本では2033-2035年であると示されています。
後述しますが、ENHERTU®を保護する米国特許は存続期間延長手続きがされており、満了日は2033年12月20日となる見込みのようです。
5.抗体薬物複合体(ADC)技術と知的財産権による保護
第一三共には、トラスツズマブ デルクステカン以外にも、異なる標的抗原を狙った抗体に、同じリンカーと薬物を結合させたADCのプロジェクトが多数あります。ADC分野での競争は激化しており、競合メーカーのADC技術や基盤技術の特許といった参入障壁がある中、ADC分野の中で第一三共が勝ち残るためには、操業自由度(FTO)を切り開いていくことは重要です。

ADC技術の帰属をめぐってSeattle Genetics社と係争が起きていますね・・・第一三共がADC技術の帰属を巡り訴訟提起(2019.11.05記事)
ADC技術の帰属をめぐるSeattle Genetics社との争いは、2020年4月30日のSeattle Genetics社の発表によると、仲裁手続きに進むようです(2020.04.30 Seattle Genetics Reports First Quarter 2020 Financial Results)。
Legal Dispute with Daiichi Sankyo Co. Ltd.
・・・On November 4, 2019, Daiichi Sankyo attempted to have the case heard in federal court. On April 27, 2020, it was ruled that the dispute should be resolved in arbitration and that the arbitration process should move forward.

第一三共はADCに関連した特許をどの程度保有しているのでしょうか・・・
J-PlatPatを用いて、登録になった第一三共の日本特許のうち、発明の名称に「抗体」及び「薬物」を含むものを検索すると、17件の特許が存在することがわかります(表4)。いずれも発明の名称に「コンジュゲート」というワードが入っていることから、これらはADC技術に関連した特許と考えられます(注: 検索条件を絞っているため、第一三共が保有・利用しているADC技術関連特許はこれだけとは限りません)。
17件の第一三共の特許の内容を眺めてみると、主要な特許請求の範囲は、
「特定のリンカー及び特定の薬物(カンプトテシン誘導体である抗腫瘍性化合物エキサテカン)と、抗○○抗体(または単に「抗体」)と、が結合した抗体-薬物コンジュゲート。」
という構成(または製造方法等)になっていることがわかります。

特定のリンカーとエキサテカンを様々な抗体と結合させるADC技術に関して特許を獲得しているね・・・
| 特許番号 | (原)出願日 | 発明の名称 |
| 6665325 | 2015.01.28 | 抗HER2抗体-薬物コンジュゲート |
| 6679762 | 2018.01.16 | 抗GPR20抗体及び抗GPR20抗体-薬物コンジュゲート |
| 6371452 | 2013.10.10 | 抗体-薬物コンジュゲート |
| 6513128 | 2015.04.10 | 抗HER3抗体-薬物コンジュゲート |
| 6449366 | 2014.12.24 | 抗TROP2抗体-薬物コンジュゲート |
| 6148422 | 2015.04.10 | 抗HER3抗体-薬物コンジュゲート |
| 6466895 | 2015.01.28 | 抗HER2抗体-薬物コンジュゲート |
| 6105183 | 2015.01.28 | 抗HER2抗体-薬物コンジュゲート |
| 6046301 | 2015.01.28 | 抗HER2抗体-薬物コンジュゲート |
| 6186045 | 2013.10.10 | 抗体-薬物コンジュゲート |
| 6030267 | 2013.10.10 | 抗体-薬物コンジュゲート |
| 6612738 | 2015.04.06 | 抗HER2抗体-薬物コンジュゲート |
| 6105171 | 2015.04.10 | 抗HER3抗体-薬物コンジュゲート |
| 5998289 | 2015.01.28 | 抗HER2抗体-薬物コンジュゲート |
| 6130517 | 2014.12.24 | 抗TROP2抗体-薬物コンジュゲート |
| 6272230 | 2013.10.17 | 親水性構造を含むリンカーで結合させた抗体-薬物コンジュゲート |
| 5953378 | 2013.10.10 | 抗体-薬物コンジュゲート |
表4中の日本特許の米国特許ファミリーの審査経過書類を眺めると、ENHERTU®の特許期間延長出願が米国特許10,155,821、9,808,537及び10,195,288についてそれぞれ提出されていることがわかりました(いずれも満了日を2033年10月10日から2033年12月20日とする延長申請)。

米国での特許延長は1つだけ・・・どの特許を選択するのでしょうか・・・
6.まとめ
国内主力品であったメマリー®やネキシウム®は独占販売期間の終了により減収は避けられないでしょう。エドキサバンや他の製品でいかにつないでいくかが目先の課題ですが、特許による独占期間の観点から、ポスト・エドキサバンを視野に入れた事業の転換が第一三共にとって最大の重要課題といえそうです。
第一三共は、新規モダリティーであるADC技術を構築して、トラスツズマブ デルクステカンやそれに続くADCフランチャイズの研究開発を加速させることで、「がんに強みを持つ先進的グローバル創薬企業」への転換を着実に進めているように見えます。ADCフランチャイズという創薬技術及び製品についての特許の権利化や技術導入を推進することにより、他社にはないユニークな製品を創出することが第一三共の大きな強みのひとつになることを期待します。


コメント
【追記】
2020.06.18 第一三共エスファ press release : ジェネリック医薬品新発売のお知らせ・・・メマリーAG (メマンチン塩酸塩酸錠)発売へ。
https://www.daiichisankyo-ep.co.jp/news/n2020/0618.html
2021.03.12 アストラゼネカ株式会社・第一三共株式会社 press release: プロトンポンプ阻害剤 「ネキシウム®カプセル 10mg、20mg」「ネキシウム®懸濁用顆粒分包 10mg、20mg」の販売移管および共同販促終了のお知らせ
https://www.daiichisankyo.co.jp/files/news/pressrelease/pdf/202103/20210312_J2.pdf
2022.01.14 ニプロ press release: ネキシウム®カプセル10mg/20mgのオーソライズド・ジェネリック独占販売権取得のお知らせ
https://www.nipro.co.jp/news/document/220114.pdf
2022.12.09 ネキシウム®カプセルに初後発品収載8社16品目(ニプロがAG)
2022.12.09 ニプロ press release: オーソライズド・ジェネリック『エソメプラゾールカプセル 10mg/20mg「ニプロ」』等ジェネリック医薬品3成分5品目新発売のお知らせ
https://www.nipro.co.jp/assets/document/newsrelease/221208.pdf
2022.01.19 第一三共 press release: 米国における長期販売品の譲渡について
第一三共は、Cosette Pharmaceuticals, Inc.との間で、オルメサルタン製剤など7製品の米国向け製造および米国における商業化の権利の譲渡等に関する契約を締結した。