ブロード研究所によるCrispr/Cas9に関する発明(2): 知財高裁平成31年(行ケ)10011
【背景】
「遺伝子産物の発現を変更するためのCRISPR-Cas系および方法」に関する特許出願(特願2016-128599; 特開2016-171817)の特許法29条の2及び29条2項により拒絶とした審決(不服2017-13796号)の取消訴訟。
【要旨】
知財高裁は、
- 本件審決において本願発明と引用発明1(引用例1: PCT/US2013/073307号に記載の発明。出願人はシグマ-アルドリッチ。)との一応の相違点として挙げられた「tracr配列が,30以上のヌクレオチドの長さを有」することは、実質的な相違点であり、本願発明と引用発明1とが同一の発明であるとは認められないから、特許法29条の2により特許を受けることはできないとした本件審決の判断には誤りがある。
- 本願発明と引用発明2(引用例2: Science, Aug 2012, Vil.337, p.816-821及びSupplementary Materials)との相違点4(tracr配列について、引用発明2は「26のヌクレオチドの長さ」を有するのに対して、本願発明は「30以上のヌクレオチドの長さ」を有する点)は容易に想到することはできないので、特許法29条2項により特許を受けることができないとした本件審決の判断には誤りがある。
と判断し、本件審決を取り消した。
1.取消事由1(引用発明1に基づく特許法29条の2の判断の誤り)について
裁判所による本願発明と引用発明1との対比判断(29条の2)は下記表のとおり。
|
本願発明の構成要件
|
引用発明1
|
審決
|
判決
|
|
|
A
|
エンジニアリングされた,天然に存在しないクラスター化等間隔短鎖回分リピート(CRISPR)-CRISPR関連(Cas)(CRISPR-Cas)ベクター系であって,
|
天然に存在するII型CRISPR/Casシステム由来のCas9タンパク質に,核局在化シグナルを含むなどの改変を行い,エンジニアリングされた,天然に存在しないCas9タンパク質を用いるベクター系であって,
|
一致
|
一致
|
|
B-a
|
真核細胞中のポリヌクレオチド遺伝子座中の標的配列にハイブリダイズする1つ以上のCRISPR-Cas系ガイドRNAをコードする1つ以上のヌクレオチド配列に作動可能に結合している第1の調節エレメントであって,前記ガイドRNAが,ガイド配列,tracr配列及びtracrメイト配列を含む,第1の調節エレメント,
|
「(ii)真核細胞中の染色体配列中の標的部位に相補的である5’末端における第一の領域,ステムループ構造を形成する第二の内部領域及び本質的に一本鎖のままである第三の3’領域を含む少なくとも1つのガイドRNAをコードするDNAに操作可能に連結されたプロモーター調節配列」,
|
一致
|
一致
|
|
B-b
|
II型Cas9タンパク質をコードするヌクレオチド配列に作動可能に結合している第2の調節エレメントであって,前記タンパク質が,核局在化シグナル(NLS)を含む,第2の調節エレメント
|
「(i)少なくとも1つの核局在化シグナルを含む少なくとも1つのII型Cas9タンパク質をコードする核酸に操作可能に連結されたプロモーター調節配列」,
|
一致
|
一致
|
|
C
|
を含む1つ以上のベクターを含み,
|
「を含むベクター」を含み,
|
一致
|
一致
|
|
D
|
成分a)及びb)が,前記系の同じ又は異なるベクター上に位置し,
|
(i)及び(ii)のベクターを,異なるベクターとする態様のほかに,同じベクターとする
|
一致
|
一致
|
|
E
|
前記tracr配列が,30以上のヌクレオチドの長さを有し,
|
tracr配列」に相当する部分の長さについて明確な特定はなく,「第二及び第三領域」の合わせた長さが「約30から約120ヌクレオチド長の範囲」である
|
一応の相違点
|
実質的な相違点
|
|
F
|
それによって,前記1つ以上のガイドRNAが,真核細胞中の前記ポリヌクレオチド遺伝子座を標的とし,前記Cas9タンパク質が,前記ポリヌクレオチド遺伝子座を開裂し,それによって,前記ポリヌクレオチド遺伝子座の配列が,改変され;
|
「ガイドRNAが,II型Cas9タンパク質を真核細胞中の染色体配列中の標的部位へ誘導し,そこで該II型Cas9タンパク質が,該標的部位にて染色体DNA二本鎖の切断を誘導し,該二本鎖の切断が,染色体配列が修飾されるようにDNA修復過程により修復される」,
|
一致
|
一致
|
|
G
|
前記Cas9タンパク質及び前記1つ以上のガイドRNAが,いっしょに天然に存在しない,
|
少なくとも1つの核局在化シグナルを含むなど,天然に存在するII型CRISPR/Casシステム由来のCas9タンパク質を改変することで得られたベクターを構成成分とするベクター系であり,また,ガイドRNAは,第一の領域,第二の内部領域及び第三の3’領域を含むように人工的に設計されたキメラRNAである
|
一致
|
一致
|
|
H
|
CRISPR-Casベクター系。
|
CRISPR-Casベクター系。
|
一致
|
一致
|
裁判所は、本件審決で一応の相違点として挙げられた「tracr配列が,30以上のヌクレオチドの長さを有」する点について、特許法29条の2の実質的な相違点かどうかを以下の通り判断した。
「特許法29条の2・・・にいう先願明細書等に記載された「発明」とは,先願明細書等に記載されている事項及び記載されているに等しい事項から把握される発明をいい,記載されているに等しい事項とは,出願時における技術常識を参酌することにより,記載されている事項から導き出せるものをいうものと解される。」
「本願発明は,「tracr配列の長さ」に着目し,「tracr配列が,30以上のヌクレオチドの長さを有」するものという構成を採用したことによって,ゲノム改変効率が増加することを特徴とするものである。他方,引用例1には,ガイドRNAが第一領域から第三領域までの3つの領域を含むこと(【0067】),ステムの長さは約6から約20塩基対長であってよいこと(【0069】),一般的に,第三の領域は,約4ヌクレオチド長以上であり,例えば,第三の領域の長さは,約5から約60ヌクレオチド長の範囲であるとすること(【0070】),ガイドRNAの第二及び第三領域の合わせた長さは,約30から約120ヌクレオチド長の範囲であり得ること(【0071】)が記載されているにすぎない。
また,本願明細書【0063】の「ループの3’側の配列の部分は,tracr配列に対応する」の記載によれば,本願発明のtracr配列は,引用発明1の第二領域の片方のステムと第三領域を合わせたものに相当すると認められる。しかし,引用例1には,tracr配列(第二領域の片方のステムと第三領域を合わせたもの)の長さそれ自体を規定するという技術思想が表れてはいない。
さらに,本願優先日当時,tracr配列の長さを30以上のヌクレオチドの長さとするとの当業者の技術常識が存在したことを認めるに足りる証拠はない。
よって,引用例1に「tracr配列が,30以上のヌクレオチドの長さを有」するものという構成を採用したことが記載されているといえないし,技術常識を参酌することにより記載されているに等しいともいえない。」
2.取消事由2(引用発明2に基づく進歩性の判断の誤り)について
裁判所は、相違点4(tracr配列について、引用発明2は「26のヌクレオチドの長さ」を有するのに対して、本願発明は「30以上のヌクレオチドの長さ」を有する点)の判断について以下の通り判断した。
「tracr配列の長さについては,26ヌクレオチドより短い場合との比較では,長い26ヌクレオチドの方が好ましいことは理解できるものの,引用例2には,26ヌクレオチドより長い場合で比較した場合に,より長さの大きいtracr配列の方が好ましいことを示す記載は,見当たらない。加えて,本件全証拠によっても,本願優先日当時,tracr配列の長さが大きければ大きいほど好ましいことを示す技術常識が存在したことを認めるに足りない。・・・そうすると,引用例2の記載や本願優先日の技術常識を勘案しても,ゲノムの改変効率を向上させる観点で,引用発明2のtracrRNAの長さについて,引用例2に具体的に開示されている26から30以上に変更することを,当業者が動機付けられていたということはできない。
また,本願優先日当時,引用例2の要約に記載された細菌や古細菌の獲得免疫に由来するCRISPR/Cas系を,緩衝液中での混合(試験管レベル)でなく,真核細胞に適用することができた旨を報告する技術論文や特許文献は存在しておらず,tracr配列の長さを30以上に設定するという技術手段を採用することで,真核細胞におけるゲノム改変効率が向上するという効果は,当業者の期待や予測を超える効果と評価することができる。
したがって,相違点4として挙げた本願発明の発明特定事項,すなわち「tracr配列」について,「30以上のヌクレオチドの長さ」とすることは,引用例2の記載や本願優先日の技術常識を参酌しても,当業者が容易に想到し得たとはいえないものである。」
【コメント】
1.特許法29条の2の要件
本件審決において本願発明と引用発明1との一応の相違点として挙げられた点が、特許法29条の2においていうところの「先願明細書等に記載された発明又は記載されているに等しい事項」に該当するかどうか争われた。特許庁(被告)は、引用発明1は本願発明の「tracr配列」に相当する部分の長さに関して重複関係にあるから、本願発明が特許を受けるためには引用発明1とは異なる新たな効果を有することが必要である、と主張したが、裁判所は、記載されているに等しいとはいえないとしたうえで、本願発明は「プロトスペーサー1やプロトスペーサー3以外においても真核細胞のゲノム改変効率が向上する可能性がないということはできない」として、被告の主張を退けている。
特許法29条の2の実質的要件の判断に求められるのは、本願発明の認定、先願明細書に記載されている(に等しい)事項(引用発明)の認定、そしてそれらの対比である。そのうちの本願発明の認定手法は、審査基準によれば、新規性・進歩性における本願発明の認定手法と同じであり、請求項の記載が明確である場合は請求項の記載どおりに請求項に係る発明を認定し、明細書及び図面の記載並びに出願時の技術常識を考慮して請求項に記載されている用語の意義を解釈する。そして、請求項に数値限定を用いて発明を特定しようとする記載がある場合であっても、通常の場合と同様に請求項に係る発明を認定する(特許・実用新案審査基準 第III部第2章第3節・第4節、第3章)。従って、本願発明の認定には、本願発明に新たな効果を有することが求められている訳ではなく、ましてや特許庁が主張したような、「本願明細書に先願明細書と異なる新たな効果を有することが必要である」と解されているわけでもない。裁判所は、そのような特許庁の主張ロジックを真正面から受けずに、「可能性がないということはできない」として受け流し、認めなかった。
ところで、発明の名称を「配列操作のための系,方法および最適化ガイド組成物のエンジニアリング」とする別の特許出願(特願2016-117740; 特開2016-165307)の拒絶審決取消訴訟も同日付で判決が言渡されたており、こちらは特許法29条の2により特許を受けることはできないと判断し、原告の請求を棄却した(2020.02.25 「ブロード研究所・MIT・ハーバード大学 v. 特許庁長官」 知財高裁平成31年(行ケ)10010)。
2.周辺情報について
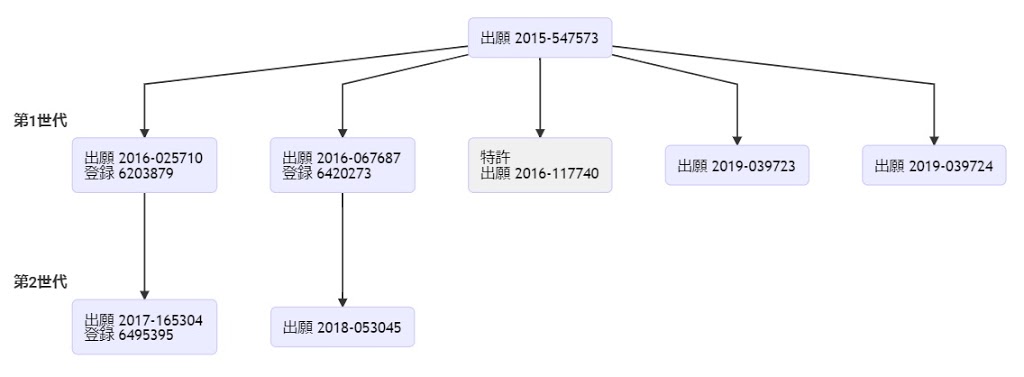
(1) 本願(特願2016-128599)の原出願(特願2015-547555; PCT/US2013/074743)から派生した日本における出願・特許ファミリーのうち、登録されている日本特許ファミリーは、現時点で下記1件。下記特許は、「tracr配列が、40以上のヌクレオチドの長さ」である構成を必須とするものであり、本願及び下記特許ともに特許請求の範囲は「tracr配列の長さ」の点で限定的なものとなっている。
- 特許6545621号・・・2019年6月28日に登録され、同年7月17日に公報発行、2020年1月17日に異議申立が提出されたようである(異議2020-700032)。
(2) Broad Institute websiteよりpatent/licensingの情報:
- INFORMATION ABOUT LICENSING CRISPR SYSTEMS, INCLUDING FOR CLINICAL USE
- FOR JOURNALISTS: STATEMENT AND BACKGROUND ON THE CRISPR PATENT PROCESS
(3) 引用例1(PCT/US2013/073307(WO2014/089290))に対応する、発明の名称を「CRISPRに基づくゲノム修飾および制御」とする特許出願(特願2015-545838; 特表2016-502840)は、特許として登録されている(特許6620018号)。特許権者はシグマ-アルドリッチ。


コメント