セレコックス(セレコキシブ) 数値範囲を発明特定事項に含む発明のサポート要件: 知財高裁平成30年(行ケ)10110; 10112; 10155
【背景】
「セレコキシブ組成物」に関する特許(第3563036号)に対する無効審判(無効2016-800112号)の請求不成立審決とされた部分(訂正後の請求項1~5、7~19についての明確性要件違反、実施可能要件違反、サポート要件違反、新規性欠如、進歩性欠如の無効理由はいずれも理由がない)の取消しを求めた訴訟。
請求項1:
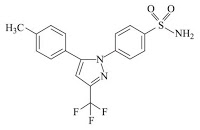
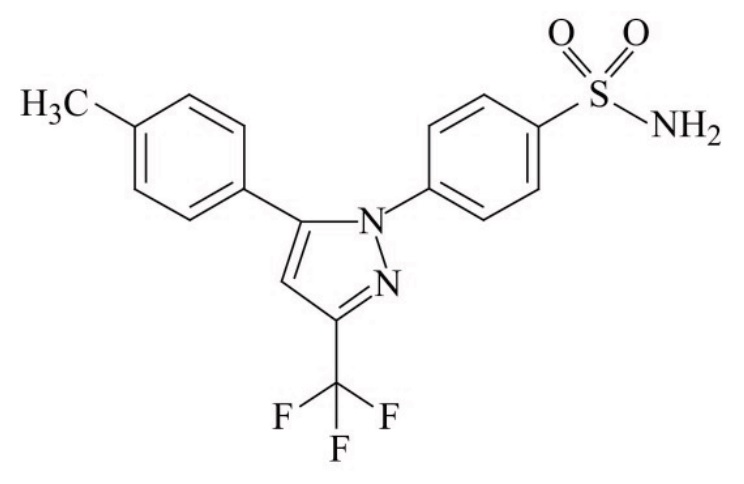
一つ以上の薬剤的に許容な賦形剤と密に混合させた10mg乃至1000mgの量の微粒子セレコキシブを含み,一つ以上の個別な固体の経口運搬可能な投与量単位を含む製薬組成物であって,粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する製薬組成物。
【要旨】
裁判所は、本件発明1~5、7~19はいずれもサポート要件に適合せず、原告ら主張の取消事由4(サポート要件の判断の誤り)は理由があるから、その余の取消事由について判断するまでもなく本件審決は取り消されるべきである、と判断した。以下、裁判所の判断を引用する。
1.所定の数値範囲を発明特定事項に含む発明についてのサポート要件の適合判断について
「特許法36条6項1号は,特許請求の範囲の記載に際し,発明の詳細な説明に記載した発明の範囲を超えて記載してはならない旨を規定したものであり,その趣旨は,発明の詳細な説明に記載していない発明について特許請求の範囲に記載することになれば,公開されていない発明について独占的,排他的な権利を請求することになって妥当でないため,これを防止することにあるものと解される。
そうすると,所定の数値範囲を発明特定事項に含む発明について,特許請求の範囲の記載が同号所定の要件(サポート要件)に適合するか否かは,当業者が,発明の詳細な説明の記載及び出願時の技術常識から,当該発明に含まれる数値範囲の全体にわたり当該発明の課題を解決することができると認識できるか否かを検討して判断すべきものと解するのが相当である。」
2.本件発明1について
「本件発明1は,「一つ以上の薬剤的に許容な賦形剤と密に混合させた10mg乃至1000mgの量の微粒子セレコキシブ」を含む「固体の経口運搬可能な投与量単位を含む製薬組成物」に関する発明であって,「粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する」ことを特徴とするものであるから,所定の数値範囲を発明特定事項に含む発明であるといえる。
そして,・・・本件明細書の開示事項によれば,本件発明1は,未調合のセレコキシブに対して生物学的利用能が改善された固体の経口運搬可能なセレコキシブ粒子を含む製薬組成物を提供することを課題とするものであると認められる。」
3.本件明細書等の記載について
「本件明細書・・・の記載は,未調合のセレコキシブを粉砕し,「セレコキシブのD90粒子サイズが約200μm以下」とした場合には,セレコキシブの生物学的利用能が改善されること,セレコキシブのピンミリングのような衝撃粉砕により,他のタイプの粉砕と比較して,最終組成物に改善されたブレンド均一性がもたらせることを示したものといえる。
一方で,①本件発明1・・・には,「粒子の最大長において,セレコキシブ粒子のD90が200μm未満である粒子サイズの分布を有する」構成とする具体的な方法を規定した記載はなく,・・・セレコキシブの微細化に関し,「さまざなま粉砕器若しくは破砕器が利用することが可能である」との記載があること,②・・・「セレコキシブは,水溶性媒体には異常なほど溶解しない。・・・加えて,長く凝集した針を形成する傾向を有する結晶形態を有する未調合のセレコシブは,通常,錠剤成形ダイでの圧縮の際に,融合して一枚岩の塊になる。他の物質とブレンドさせたときでも,セレコキシブの結晶は,他の物質から分離する傾向があり,組成物の混合中にセレコキシブ同士で凝集し,セレコキシブの不必要な大きな塊を含有する,非均一なブレンド組成物になる。」との記載があること,③本件優先日当時,粉砕によって薬物の粒子径を小さくし,比表面積(有効表面積)を増大させることにより,薬物の溶出が改善されるが,他方で,難溶性薬物については,溶媒による濡れ性が劣る場合には,粒子径を小さくすると凝集が起こりやすくなり,有効表面積が小さくなる結果,溶解速度が遅くなることがあり,また,粒子を微小化することにより粉体の流動性が悪くなり凝集が起こりやすくなることがあることは周知又は技術常識であったことに照らすと,難溶性薬物であるセレコキシブについて,「セレコキシブのD90粒子サイズが約200μm以下」の構成とすることにより,セレコキシブの生物学的利用能が改善されることを直ちに理解することはできない。
また,本件明細書の記載を全体としてみても,粒子の最大長におけるセレコキシブ粒子の「D90」の値を用いて粒子サイズの分布を規定することの技術的意義や「D90」の値と生物学的利用能との関係について具体的に説明した記載はない。
しかるところ,・・・難溶性薬物の原薬の粒子径分布は,化合物によって様々な形態を採ること(甲イ72)に照らすと,200μm以上の粒子の割合を制限しさえすれば,90%の粒子の粒度分布がどのようなものであっても,生物学的利用能が改善されるとものと理解することはできない。
以上によれば,本件明細書の・・・上記記載から,「セレコキシブのD90粒子サイズが約200μm以下」とした場合には,その数値範囲全体にわたり,セレコキシブの生物学的利用能が改善されると認識することはできない。
・・・このほか,本件明細書には,セレコキシブ粒子のD90の粒子サイズと生物学的利用能に関する実験結果の開示はない。
・・・以上によれば,本件明細書の発明の詳細な説明の記載及び本件優先日当時の技術常識から,当業者が,本件発明1に含まれる「粒子の最大長において,セレコキシブ粒子のD90が200μm未満」の数値範囲の全体にわたり本件発明1の課題を解決できると認識できるものと認められないから,本件発明1は,サポート要件に適合するものと認めることはできない。これと異なる本件審決の判断は誤りである。」
【コメント】
所定の数値範囲を発明特定事項に含む発明についてのサポート要件の適合判断について争われ、特許庁がサポート要件ありとした審決は知財高裁によって取り消された。本件特許はセレコキシブを有効成分とするセレコックス(Celecox)®錠を保護する組成物特許である。
セレコキシブ(Celecoxib)は、1992年に米国サール社(現 米国ファイザー社)で合成された、非ステロイド性消炎・鎮痛剤(COX-2選択的阻害剤)であるセレコックス(Celecox)®錠の有効成分。日本においては、1995年10月より第Ⅰ相試験が開始され、1996年4月から山之内製薬(現 アステラス製薬)と日本モンサント(現 ファイザー)が共同開発を実施し、関節リウマチ、変形性関節症に対する臨床的有用性が認められたことから、2007年1月26日に承認された。また、2009年6月17日には腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎、さらに2011年12月22日には、手術後、外傷後並びに抜歯後の消炎・鎮痛の効能・効果が追加承認された。
再審査期間は、「関節リウマチ、変形性関節症」については、2007年1月26日~2015年1月25日(8年間)であり、「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘」及び「手術後、外傷後並びに抜歯後」についても、「関節リウマチ、変形性関節症」の残余期間(2015年1月25日)までであった。
本件特許以外に、セレコックス®を保護する物質特許3025017があり、2019年11月14日(偶然にも本判決日)に5年間の特許延長期間が満了した。このような状況から、来年2月にはセレコックス®のジェネリックが初承認となる可能性がある。
表1 セレコックス®(セレコキシブ)のヒストリー(日本)
|
先発メーカーの動き
|
ジェネリックメーカーの動き
|
||||
|
製品
|
物質特許3025017
|
組成物特許3563036
|
|||
|
1992
|
米国サール社(現 米国ファイザー社)で合成
|
||||
|
1993
|
11/30 優先日
|
||||
|
1994
|
4/6 優先日
11/14 出願日
|
||||
|
1995
|
第I相臨床試験開始
|
||||
|
1996
|
山之内製薬(現 アステラス製薬)と日本モンサント(現 ファイザー)が共同開発を実施
|
||||
|
1998
|
11/30 優先日
|
||||
|
1999
|
11/30 出願日
|
||||
|
2000
|
1/21 登録日
|
||||
|
2004
|
6/11 登録日
|
||||
|
2007
|
1/26 セレコックス錠(100/200mg)が「関節リウマチ、変形性関節症」の効能効果で製造販売承認
|
延長出願2007-700035(医薬品の製造原料); 2007-700035(関節リウマチ、変形性関節症) (いずれも延長期間5年~2019年11月14日満了)
|
延長出願2007-700038 (延長期間2年7月26日~2022年6月26日満了)
|
||
|
2009
|
6/17 「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」の効能効果追加承認
|
延長出願2009-700062 (200mg); 2009-700063 (100mg) (いずれも延長期間5年~2019年11月14日満了)
|
延長出願2009-700064 (200mg); 2009-700065 (100mg) (いずれも延長期間5年~2024年11月30日満了)
|
||
|
2011
|
12/22 「慢手術後、外傷後並びに抜歯後」の効能効果追加承認
|
||||
|
2012
|
延長出願2012-700011 (100mg); 2012-700012 (200mg) (いずれも延長期間5年~2019年11月14日満了)
|
延長出願2012-700013 (100mg); 2012-700014 (200mg) (いずれも延長期間5年~2024年11月30日満了)
|
|||
|
2014
|
11/14 満了日(20年)
|
||||
|
2015
|
1/25再審査期間終了(8年)
|
||||
|
2016
|
9/30 東和薬品が無効審判請求 (無効2016-800112)
12/20 ニプロが無効審判請求
|
||||
|
2017
|
4/13 日新製薬が無効審判請求
8/3 日本ケミファが請求人参加申請
9/25 ヘキサルが請求人参加申請
12/11 大原薬品4/13 日新製薬が無効審判請求
|
||||
|
2018
|
6/26 特許庁が請求不成立審決
8/2 東和薬品が審決取消訴訟提起(第1事件訴訟)
8/3 日本ケミファが審決取消訴訟提起(第2事件訴訟)
11/1 ヘキサルが審決取消訴訟提起(第3事件訴訟)
|
6/4 日本ケミファ及びダイトが無効審判請求 (無効2018-800071)
|
|||
|
2019
|
11/14 「関節リウマチ、変形性関節症」承認(2007)、「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」承認(2009)及び「慢手術後、外傷後並びに抜歯後」承認(2011)に基づく期間延長満了
|
11/30 満了日(20年)
|
11/14 本件判決
|
4/16 テバが請求人参加申請
9/3 特許庁が請求不成立審決
10/17 審決取消訴訟提起(令和1年(行ケ)10137)
|
|
|
2020
|
※2月にもジェネリック初承認か
|
||||
|
2022
|
6/26 「関節リウマチ、変形性関節症」承認(2007)に基づく期間延長満了
|
||||
|
2024
|
11/30 「腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎」承認(2009)及び「慢手術後、外傷後並びに抜歯後」承認(2011)に基づく期間延長満了
|
||||


コメント