2018年1月9日付プレスリリースによると、中外製薬は、抗CD20モノクローナル抗体「リツキサン®注10mg/mL」について、同製品のバイオ後続品の製造販売者であるサンドおよび販売者である協和発酵キリンに対し、バイオジェン社が保有する3件の用途特許の侵害を理由としてジェネンテック社(本特許権の専用実施権者)が2017年12月28日付で東京地裁に提起したバイオ後続品の販売等の差し止めを求める訴訟に、全薬工業とともに補助参加の申出を行ったとのことです(全薬工業は本剤の独占的販売権者、中外製薬は本剤の全薬工業との共同販売権者)。また、中外製薬は、本訴訟に併せてなされた仮処分命令の申立てについても、補助参加の申出を行ったとのことです。
リツキサン(Rituxan)®は、マウス/ヒトキメラ型抗CD20モノクローナル抗体リツキシマブ(Rituximab)(遺伝子組換え)を有効成分とするバイオ医薬品。アイデック社(現 バイオジェン・アイデック社)にて、Bリンパ球表面の分化抗原CD20に対するマウス型モノクローナル抗体の可変部領域と、ヒト免疫グロブリン(IgG1κ)の定常部領域を有するマウス-ヒトキメラ型抗CD20モノクローナル抗体の開発が進められ、1991年、リツキシマブ(遺伝子組換え)が創薬されました。1995年3月、アイデック社はジェネンテック社と共同開発契約を締結、1997年11月には米国FDAより承認を受け、日本では、1995年11月に全薬工業が開発及び輸入販売契約を締結、2001年6月にCD20陽性の低悪性度又はろ胞性B細胞性非ホジキンリンパ腫、マントル細胞リンパ腫の治療薬として承認を受けました。
現在、効能又は効果は下記の通り。
- CD20陽性のB細胞性非ホジキンリンパ腫
- 免疫抑制状態下のCD20陽性のB細胞性リンパ増殖性疾患
- ヴェゲナ肉芽腫症、顕微鏡的多発血管炎
- 難治性のネフローゼ症候群(頻回再発型あるいはステロイド依存性を示す場合)
- 慢性特発性血小板減少性紫斑病
- 下記のABO血液型不適合移植における抗体関連型拒絶反応の抑制
腎移植、肝移植 - インジウム(111In)イブリツモマブ チウキセタン(遺伝子組換え)注射液及びイットリウム(90Y)イブリ ツモマブ チウキセタン(遺伝子組換え)注射液投与の前投与
被疑侵害品であるリツキシマブBS点滴静注100mg/500mg「KHK」は2017年9月27日に製造販売承認され、同年11月29日に薬価基準収載されています。
効能又は効果は下記の通り。
- CD20陽性のB細胞性非ホジキンリンパ腫
- 免疫抑制状態下のCD20陽性のB細胞性リンパ増殖性疾患
- ヴェゲナ肉芽腫症、顕微鏡的多発血管炎
参考:
- 中外製薬 press release: 2018.01.09 「リツキサン®注に関する特許権侵害訴訟の提起および仮処分命令の申立てについて」
- 全薬工業 press release: 2018.01.09 「ジェネンテック社によるリツキサン®注に関する特許権侵害訴訟の提起 および仮処分命令の申立てに対する補助参加について」



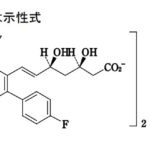
コメント