タダラフィルの特定用量製剤(シアリス錠)特許: 知財高裁平成27年(行ケ)10113
【背景】
被告(イコス)が保有する「単位製剤」に関する特許(第4975214号; WO2000/066099; 存続期間満了日2020.4.26)の無効審判請求を不成立とした審決(無効2013-800243)の取消訴訟。争点は進歩性の有無。
請求項1(本件発明1):
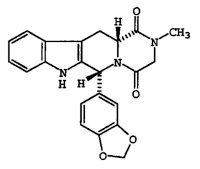
1日あたり20mgの総用量を上限として,以下の構造式:
を有する化合物を単位製剤あたり1乃至20mg含み,ヒトにおける勃起不全の処置に使用される内服用単位製剤。
甲10発明(WO97/03675):
1日あたり0.5~800mgのタダラフィルを単位製剤あたり0. 2~400mg含み,ヒトにおける勃起不全の処置に使用される内服用単 位製剤
【要旨】
主 文
特許庁が無効2013-800243号事件について平成27年4月27日にした審決を取り消す。(他略)
裁判所の判断
1.相違点1(本件発明1は「1日あたり20mgの総用量を上限」とするのに対し、甲10発明は「1日あたり0.5~800mg」である点)の容易想到性について
当業者であれば,甲10発明に係るタダラフィルにつき,平均的な成人患者(70kg)に対して1日当たり,概ね0.5~800mgの範囲において,ヒトの勃起機能不全の処置に有用であり,具体的には50mgのタダラフィルを含む錠剤ないしはカプセルが一例として考えられること,もっとも,実際の患者に投与する場合には,好適と考えられる投与計画を決定する必要があることを理解すると認められるところ,タダラフィルと同様にPDE5阻害作用を有するシルデナフィルにおいて,ヒトに投与した際,PDE5を阻害することによる副作用が生じることが本件優先日当時の技術常識であったことから,甲10のタダラフィルを実際に患者に投与するに当たっても,同様の副作用が生じるおそれがあることは容易に認識できたものといえる。そして,薬効を維持しつつ副作用を低減させることは医薬品における当然の課題であるから,これらの課題を踏まえて上記の用量の範囲内において投与計画を決定する必要があることを認識するものと認められる。そうすると,そのような当業者において,前記の技術常識を踏まえ,甲10に記載された用量の下限値である0.5mgから段階的に量を増やしながら臨床試験を行って,最小の副作用の下で最大の薬効・薬理効果が得られるような投与計画の検討を行うことは,当業者が格別の創意工夫を要することなく,通常行う事項であると認められる。
加えて,前記のとおり,甲10のタダラフィルに関するインビトロ試験の結果によれば,タダラフィルのPDE5阻害作用はシルデナフィルに比べ強いことが示されているのであるから,タダラフィルが,インビトロ試験と同様にインビボ試験である臨床試験においても,強いPDE5阻害作用を発揮する可能性を考慮に入れて,タダラフィルの用量としてシルデナフィルの用量である10mg~50mg及びそれよりも若干低い用量を検討することも,当業者において容易に行い得ることである。
以上によれば,甲10発明について,適切な臨床における有用性を評価するために臨床試験を行い,最小の副作用の下で最大の薬効・薬理効果が得られるような範囲として,相違点1に係る範囲を設定することは,当業者が容易に想到することができたものと認められる。
2.顕著な効果の判断について
ア 薬効について
本件特許明細書及び甲36に示された上記の内容は,・・・(略)・・・概ね用量が50mgまでの範囲内においては,用量が増加するにつれて薬効が強くなるが,それより用量が増加すると薬効の増加の程度は小さくなるという一般的な知見に沿う内容を示すものにとどまるし,本件発明1の構成(上限20mgとする構成)を採用したことにより,当該範囲において,薬効の点で格別に顕著な効果を奏することを示すものでもない。
イ 副作用について
(ア) 視覚異常について
本件特許明細書の表7には,タダラフィルを単位用量2mg,5mg,10mg,25mg,50mg,100mgで投与したいずれの場合であっても,視覚異常の症状の発生率は0%であることの記載がある。そうすると,本件発明1において視覚異常の症状が発生しないことは,本件発明1の構成を採用したことによる効果であるとは認められない。(イ) 顔面紅潮について
単位用量10mg,20mg及び50mgのいずれにおいても顔面紅潮の発生率が同じである以上,本件発明1の構成を採用したことにより,顔面紅潮の副作用の低減の点において,格別に顕著な効果を奏するものとは認められない。(ウ) 硝酸塩等との併用について
本件発明1に係るタダラフィルが常に硝酸塩等と併用し得ることが示されているものとはいえない。また,上記段落【0076】の試験は,飽くまで10mgの用量でなされたものにすぎず,これが本件発明1の用量である上限20mgの範囲についても同様な効果を奏することが示されているものでもない。(エ) その余の副作用について
本件特許明細書に記載された,頭痛,消化不良,背部痛,筋肉痛,鼻炎,結膜炎及び眼瞼浮腫の副作用の発生率に関しても,本件発明1の構成を採用したことにより,これらの低減につき格別に顕著な効果があるとは認められない。
【コメント】
有効成分の特定の用量を導き出したという発明の進歩性が争われた事案である。
最小の副作用の下で最大の薬効・薬理効果が得られるような投与計画の検討を行い、臨床試験を進めながら最終的な用量を設定していく過程は、通常行われることである。その用量設定試験では、当然に副作用の点においてその発生率を抑えつつ薬効が発現できる用量を求めていくことになる。この試験自体は特段目新しいものではなく、当業者であればこのような試験を行い最適な用量を導き出すこと自体は容易に想到する事項であるだろう。問題は、顕著な効果の判断である。予期しなかった副作用が初めて課題として浮かび上がり、それを解決した結果、顕著な効果を主張できた場合には理論的には進歩性を肯定できる余地があるように思われる。
欧米では一定の範囲で特許が成立しており、本判決では無効判断とされたものの日本でも一度は特許として成立したことを考えると、一見単純な用量限定製剤発明であったとしても、思いもしなかった副作用の課題が生じ、それを解決するために用量を設定した結果、出願当時において当業者が予期することのできなかった顕著な効果(例えば、薬効の発揮を維持しつつ課題となった副作用を低減)を有するに至ったというようなシナリオを描けることができれば、出願してみる価値はありそうである。
また、裁判所は判断しなかったが、原告が主張する取消事由1として、パリ条約4条Hの優先権主張が有効かどうかについても争われた。優先権を享受するためには、先の出願明細書において発明が実施可能な程度に記載されていなければならないと解するのが過去の判決で判示されてきた事項と思われるが、審判部はそれとは異なる主張をしているようである。
被告(特許庁)の主張:
「パリ条約4条Hにおいて優先権が認められるための要件は,特許発明の構成部分が最初の出願の記載全体により明らかにされていることであって,優先権を主張する特許発明について,優先権証明書の記載が,日本の特許法の実施可能要件やサポート要件を充足することを要求するものではないし,ましてや実施可能要件やサポート要件の充足性のために優先権証明書に薬理データを記載すべきことを要求するものでもない。」
優先権が認められるための要件(必要条件と十分条件)についての基本的な考え方について今一度整理されるべきなのかもしれない。
優先権が認められるための記載について判示した過去判決記事:
- 2008.10.06 「ユーロスクリーン v. 小野薬品」 大阪地裁平成18年(ワ)7760
- 2006.11.30 「シンジェンタ v. 特許庁長官」 知財高裁平成17年(行ケ)10737
- 2000.09.05 「杏林製薬 v. 特許庁長官」 東京高裁平成11年(行ケ)207
参考:
- 特許・実用新案審査ハンドブック 第V部 第1章 パリ条約による優先権 5107 日本出願の請求項に係る発明が実施可能であるか否かの判断
シアリス(Cialis)®錠(有効成分: タダラフィル(tadalafil)):
タダラフィルは選択的なホスホジエステラーゼ タイプ5(PDE5)阻害作用を有する化合物として創薬され、本剤は日本では2007年7月に勃起不全治療剤として承認された(通常1日1回タダラフィルとして10mg。一定の場合には20mgまで増量可)。2007年9月より日本イーライリリー(株)にて発売されていたが、2009年7月1日から日本新薬(株)が販売を受託し、発売している。
タダラフィルを有効成分とする薬剤として、ザルティア(Zalutia)®錠は前立腺肥大症に伴う排尿障害改善剤(1日1回タダラフィルとして5mg)、アドシルカ(Adcirca)®錠は肺動脈性肺高血圧症治療薬(1日1回タダラフィルとして40mg)として販売されている。
欧米の状況:
- EP1173181(B3): 2003年に特許登録許可後、2013年に特許権者はクレーム中の用量を「5mg」に減縮補正し、2015年に登録公開。但し、疾患限定はないため、5mg1日1回投与である「前立腺肥大症に伴う排尿障害」を保護するものと考えられる。
- US6943166(B1): Cialisのorangebookに収載されている。
シアリス(Cialis)®錠に関連する過去記事:


コメント