イバンドロネート多形Aの同一性: 知財高裁平成25年(行ケ)10285
【背景】
「イバンドロネート多形A」に関する特許出願(特願2007-553502)の拒絶審決(不服2012-2605)取消訴訟。
審決理由は、本願発明は先願発明(特願2006-536948(出願人: テバ ファーマシューティカル))と同一であるので特許法29条の2により特許を受けることができないというものだった。
本願発明(請求項1):
角度2θで示す特性ピークを
角度2θ±0.2°
10.2°
11.5°
15.7°
19.4°
26.3°
に有する,CuKα放射線を用いて得られたX線粉末回折パターンを特徴とする,3-(N-メチル-N-ペンチル)アミノ-1-ヒドロキシプロパン-1,1-ジホスホン酸一ナトリウム塩一水和物(イバンドロネート)の結晶多形。
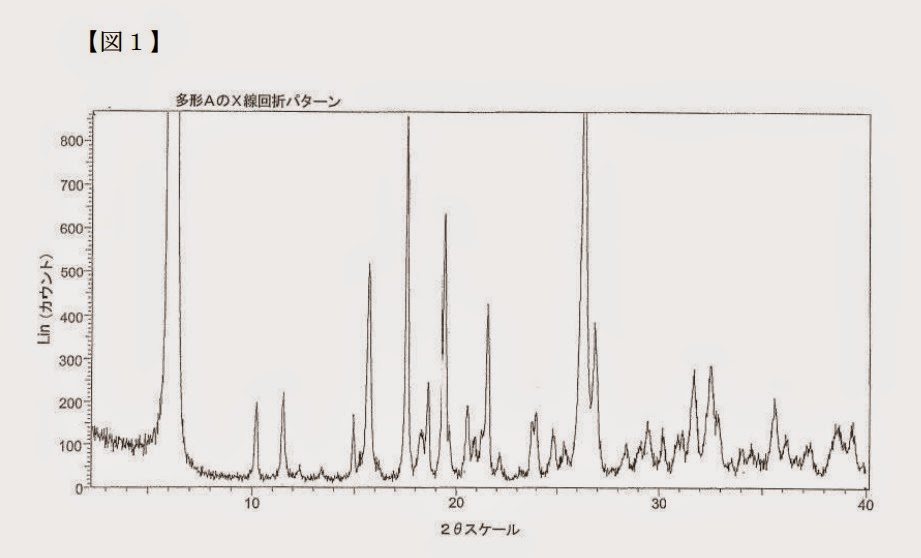
本願発明のX線粉末回折パターン:
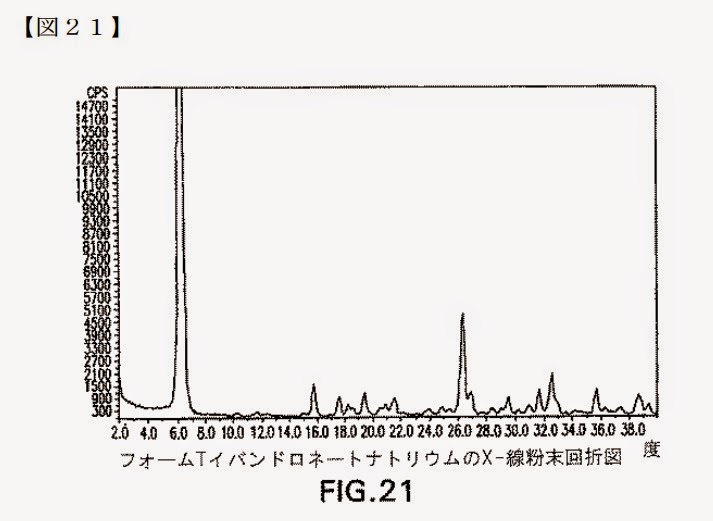
先願発明フォームTのX線粉末回折パターン:
【要旨】
主 文
1 特許庁が不服2012-2605号事件について平成25年6月10日にした審決を取り消す。(他略)
裁判所の判断
1 取消事由1(先願発明の認定の誤り,一致点の認定の誤り及び相違点の看過)について
先願明細書には,イバンドロネートナトリウムの21種類の固体結晶形フォームの全てについて熱重量分析(TGA)による重量損失が示されているものの,溶媒和物の形態に関しては,~フォームTについては,これが溶媒和物なのか,また溶媒和物であるとするとその形態は何かについての記載が全くない。
~したがって,先願明細書に接した当業者は,フォームTが溶媒和物であるか否かは判然としないと理解するものというべきである。
また,~先願明細書には,フォームTについて,熱重量分析(TGA)による重量損失が約5~約7%(表3の具体的データは,6.0%)であること,~結晶化を水とアセトンの混合溶媒で行っていることからすれば,結晶フォームTには何らかの形で水分子が含まれており,熱重量分析(TGA)による重量損失は水の蒸発によるものである可能性が高いと考えられる。
~そうすると,先願発明において,フォームTのTGAによる重量損失に関わった水が,付着水か結晶水のいずれであるかは,非等温的 TG 曲線の解析やDSC測定の解析をするなどして,重量減少と温度の関係を観察しなくては推定することができない。
したがって,上記のようなフォームTの調製方法や熱重量分析の結果を検討しただけでは,フォームTが一水和物であると認めることはできない。
以上によれば,本件審決が,先願発明であるフォームTを一水和物と認定したことには誤りがあるというほかない。
~そして,本件審決は,先願発明を一水和物であると誤って認定した結果,次の相違点(以下「相違点B’」という。)を看過した誤りがある。
相違点B’:本願発明は3-(N-メチル-N-ペンチル)アミノ-1-ヒドロキシプロパン-1,1-ジホスホン酸一ナトリウム塩の一水和物であるのに対して,先願発明においては水分子の存在形態が不明である点。
そして,この相違点B’により,本願発明は先願発明と同一であるとはいえないことから,本件審決による先願発明の認定の誤り,一致点の認定の誤り及び相違点の看過は,審決の結論に影響を及ぼすものである。したがって,原告主張の取消事由1は理由がある。
2 取消事由2(相違点についての判断の誤り)について
本願明細書には「特性ピーク」という用語について特段の説明や定義はないが,「特性」の通常の用語例からすれば,「その結晶を特徴づける特有のピーク」と解するのが相当であり,先願明細書において「特徴づけられる」として挙げられ,図21からも看取できる上記10個のピークも,これと同様の意味で用いられているものと解される。
そうすると,先願明細書には,フォームTの特性ピークとして,2θが10.2±0.2°及び11.5±0.2°のものが記載されているということはできない。
また,先願明細書中でフォームTが「特徴づけられる」ピークであるとして挙げられている10個のピークは,いずれも,図21において相応の強度を有し,明確に把握できるものである。
これに対して,図21において,本件審決が特性ピークとして挙げた2θが10.2±0.2°及び11.5±0.2°の位置には,たとえピークが把握できるとしても極めて強度の低い不明瞭なものしかなく,ことさらこれらを「特性ピーク」として取り上げるべきものではない。
したがって,本件審決が,先願発明は,特性ピークを示す角度2θ±0.2°として「10.2°」及び「11.5°」も含むものであり,本願発明と先願発明との前記~相違点は実質的な相違点ではないと判断したことには誤りがあるというべきである。
~以上のとおり,先願発明のX線粉末回折パターンには10.2±0.2°及び11.5±0.2°の2θに特定ピークが含まれるとは認められず,本願発明と先願発明と 実質的な相違点というべきである。そうすると,本件審決は相違点についての判断を誤るものであり,この誤りは審決の結論に影響を及ぼすものである。
したがって,原告主張の取消事由2は理由がある。
3 結論
以上によれば,原告主張の取消事由1及び2はいずれも理由があるから,取消事由3について検討するまでもなく,本件審決は取消しを免れない。
【コメント】
裁判所は、本件審決には、先願発明であるフォームTにおいて以下の点で本願発明との相違点を看過した誤りがあるとされた。
(1)水分子の存在形態が不明である点。
(2)X線粉末回折特定ピーク2θ±0.2°として10.2°及び11.5°が含まれるとは認められない点。
審査基準によれば、請求項に係る発明の発明特定事項と引用発明特定事項とに相違がある場合であっても、それが課題解決のための具体化手段における微差(周知技術、慣用技術の付加、削除、転換等であって、新たな効果を奏するものではないもの)である場合(実質同一)は同一とする、とされているが、本判決では、「特性ピーク」という解釈から、上記相違点(2)は実質的な相違点とされた。
先願発明フォームTのX線粉末回折パターン(図21)を拡大すれば10.2°及び11.5°に「ピーク」はあるとの主張は、これらは「特性ピーク」ではないと判断され退けられたわけであるが、相対的な強度や感度が条件によって異なる可能性を考えると、実際のところ、本願発明と同じ結晶なのではないかという疑念は残る。欧州では特許成立したが異議申立てがされたのでその行方が気になるところである。
イバンドロン酸(ibandronic acid(INN); Ibandronate Sodium Hydrate(JAN)):
骨粗鬆症治療剤ボンビバ(Bonviva)®の有効成分であるイバンドロン酸ナトリウム水和物は、ドイツのBoehringer Mannheim社(現 F. Hoffmann-La Roche社)が開発した窒素含有ビスホスホネート系薬剤。海外では経口剤と注射剤の 2 つの剤形で開発が進められ、最初に経口剤の2.5mg製剤(連日投与)が閉経後骨粗鬆症の治療及び予防薬として2003年5月に米国、2004年2月に欧州で承認された。
次いで150mg製剤(1カ月に1回投与)が2005年3月に米国、2005年9月に欧州で同治療薬として承認され、米国では2008年11月に同予防薬としても適応追加が認められた。
注射剤は、3mg製剤(3カ月に1回の静脈内投与)が閉経後骨粗鬆症治療薬として2006年1月に米国、2006 年 3 月に欧州で承認された。
日本では注射剤の開発が先行して進められた。骨粗鬆症患者を対象とする国内臨床試験において、イバンドロン酸として1mgを1カ月に1回、静脈内投与したときの有効性及び安全性が確認され、2013年6月に骨粗鬆症を効能・効果として製造販売承認を取得した(インタビューフォームより)。
Boniva tabletのOrangebookに本件出願に相当する米国特許US7714158が収載されていない。従って、本件発明の結晶形は製品を直接保護するものではないと思われる。製品に含まれる結晶形については下記テバ社の欧州特許の異議申立ての主張の中で言及されているようである。
本願(特願2007-553502; 特表2008-529980; WO2006/081963)に相当する欧米での審査状況は下記のとおり:
- EP1848728: 成立。2015年3月11日に異議申立てされた。
- US7714158: 製法として成立。
一方、本件で問題となった先願(出願人はテバ社)は特許として登録されている(特許第4559431号)。
請求項1:
a)6.2、25.9、26.7、31.1及び37.2±0.2°2θでのx-線反射により特徴づけられるイバンドロネートナトリウム結晶形;および
b)6.2、15.7、26.3、32.6及び35.6±0.2°2θでのx-線反射により特徴づけられるイバンドロネートナトリウム結晶形
から成る群から選択されたイバンドロネートナトリウム結晶形。
テバ社の出願に相当する欧米での審査状況は下記のとおり:
- EP1713489: 成立。ロシュ社等により異議申立てされた。現在審判係属中(No.T0205/14)。
Claim 1. A crystalline form of ibandronate sodium characterized by x-ray reflections at 6.2, 25.9, 26.7, 31.1, and 37.2±0.2 degrees 2θ. - EP1930011: 成立。異議申立てされた。現在審判係属中。
Claim 1. A crystalline form of ibandronate sodium characterized by x-ray reflections at 6.2, 15.7, 26.3, 32.6, and 35.6± 0.2°2θ - US7563918: 成立。
1. A crystalline form of ibandronate sodium selected from the group consisting of:
g) the crystalline form of ibandronate sodium characterized by x-ray reflections at about 4.6, 9.2, 18.3, 19.6, and 25.6± 0.2°2θ.;
r) the crystalline form of ibandronate sodium characterized by x-ray reflections at about 6.2, 25.9, 26.7, 31.1, and 37.2± 0.2°2θ.; and
u) the crystalline form of ibandronate sodium characterized by x-ray reflections at about 6.2, 15.7, 26.3, 32.6, and 35.6± 0.2°2θ.



コメント
【情報追加】
EP1848728
EPO 16.08.2016 Grounds for the decision (Annex) – oppositionより
“It appears to be undisputed that the present polymorphs A and B are the same as forms T and QQ disclosed in D1 and D20.”