イレッサ(IRESSA)の一変承認に基づく特許存続期間延長登録出願: 知財高裁平成25年(行ケ)10326; 知財高裁平成25年(行ケ)10327
【背景】
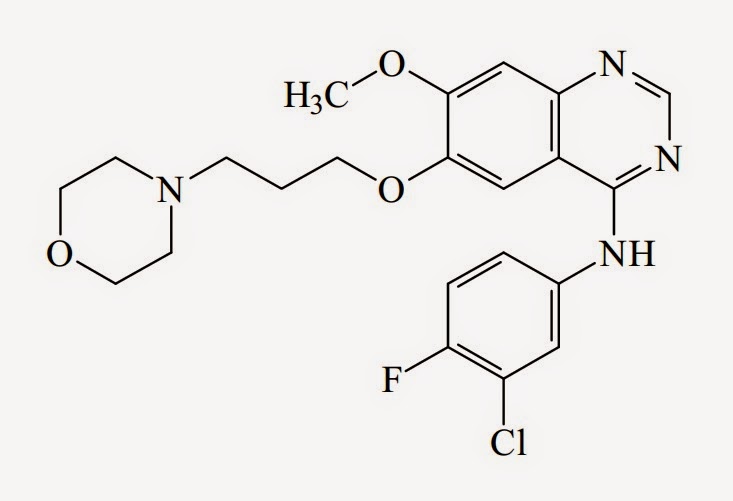
「キナゾリン誘導体」に関する特許権(特許第2994165号; 特許第3040486号)の存続期間延長登録出願(2012-700002号; 2012-700003号)の拒絶審決(不服2013-10794号; 不服2013-10795号)取消訴訟。イレッサ錠の「効能又は効果」について「EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌」とする一部変更承認(本件処分)に対して、先行処分での「効能又は効果」は「手術不能又は再発非小細胞肺癌」だった。本件特許発明1は有効成分であるゲフィチニブ(gefitinib)を包含する化合物クレームである。
【要旨】
主 文
原告の請求を棄却する。(他略)
裁判所の判断(抜粋)
「認定事実によれば,本件先行処分において承認された本件医薬品の効能又は効果は,「手術不能又は再発非小細胞肺癌」であり,その承認書には,化学療法未治療例か既治療例かなどの文言は付されていないことが認められる。一方,本件処分において承認された効能又は効果(特定された用途)は「EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌」とされている。
そこで,本件先行処分と本件処分の各承認に係る内容を比較してみると,本件処分における本件医薬品の上記効能又は効果は,本件先行処分において承認された本件医薬品のそれ,すなわち,「手術不能又は再発非小細胞肺癌」の範囲を限定したものという関係に立つものと認められる。そうすると,本件処分において禁止が解除された範囲は,本件先行処分の禁止の解除の範囲に包含されるものということになる。
すなわち,本件先行処分は,EGFR遺伝子変異陽性か陰性か,ないしは,化学療法未治療例か化学療法既治療例かを問うものではないから,本件処分の「EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌」との効能又は効果によって特定される使用方法による本件医薬品の使用行為,及び上記使用方法で使用されることを前提とした本件医薬品の製造販売等の行為の禁止は,本件先行処分によって既に解除されていたものというほかない。
そうすると,本件処分については,「本件先行処分を受けたことによって既に禁止が解除されている」と評価判断することができるものであるから,本件処分を受けたことは,特許法67条の3第1項1号の「その特許発明の実施に第67条2項の政令で定める処分を受けることが必要であつたとは認められないとき。」の拒絶要件に該当するものというべきである。」
原告反論の骨子
本件先行処分に当たり、薬事当局は、「本薬の化学療法未治療例における有効性及び安全性は確立していない。」(本件注意)との<効能・効果に関連する使用上の注意>を付した上で、本件医薬品を承認して差し支えないと判断した。使用上の注意は、承認書自体には記載されないものの、医薬品の添付文書の記載事項となっており(薬事法52条1号)、実質的に本件先行処分の一部となるものである。従って、本件先行処分での効能・効果は、「化学療法既治療の手術不能・再発非小細胞肺癌」であると理解すべきものである。これに対し、本件処分での効能・効果に含まれる「化学療法未治療のEGFR遺伝子変異陽性の手術不能・再発非小細胞肺癌」は、本件処分によって初めて実施が可能となり、化学療法未治療のファーストライン療法への使用が認められたのであるから、本件延長登録は認められるべきである。
原告反論に対する裁判所の検討骨子
添付文書、同文書における「使用上の注意」は、処分内容とは別に位置づけがされていることは明らか。本件注意の記載は、飽くまでも本件医薬品の効能・効果に関連した使用上の「注意」にすぎず、化学療法未治療例に対しては記載された効能・効果がない旨を表示し、あるいは使用を制限する趣旨の記載とは認められない。
本件先行処分にかかる審査経過に照らすと、原告は、本件注意のような記載を置くことにより、承認の範囲を化学療法既治療例に限定せずに、効能・効果を「非小細胞肺癌」とすることを維持し、化学療法未治療例に対しても本件医薬品を使用することを可能とすることを求めていたことがうかがわれる。また、審査センターも、本件医薬品の効能・効果を「非小細胞肺癌(手術不能又は再発例)」とし、添付文書に本件注意を記載して注意喚起することが適切であるとしているにとどまっており、同センターの判断が、本件医薬の化学療法未治療例における使用を一切認めないとする趣旨であったとは認められない。
したがって、本件注意が実質的には本件先行処分の一部であるとの原告の主張は採用することができない。
特許法67条の3第1項1号の要件の有無の判断についての知財高裁の見解
特許法67条の3第1項1号により審査官が延長登録の出願を拒絶すべき場合の要件について、医薬品の成分を対象とする特許については、薬事法に基づく承認を受けることによって禁止が解除される「特許発明の実施」の範囲は、薬事法14条2項3号が定める審査事項のうち,成分,分量,用法,用量,効能,効果によって特定される医薬品の製造販売等の行為であると解するのが相当である。そして、禁止の解除がされた範囲は、原則として、薬事法14条1項又は9項に基づく医薬品の輸入ないしは製造販売についての承認書に記載された上記事項の記載に基づいて決せられるべきものと解するのが相当である。
審決の解釈は当裁判所とは異なるものであるが、本件において、この点は結論を左右するものではない。
【コメント】
添付文書の記載に使用上の注意を付さなければならなかったとしても、使用上の注意は、承認内容としての使用を制限する趣旨のものではないと裁判所は判断した。禁止の解除がされた範囲は、原則として、承認書に記載された事項の記載に基づいて決せられる。
特許第2994165号及び特許第3040486号は、本件先行処分時に存続期間延長登録を受け、存続期間満了日はそれぞれ2015年10月28日及び2018年8月24日となっている。
イレッサ(IRESSA)®(一般名:ゲフィチニブ(gefitinib)): アストラゼネカ社が合成、開発した上皮成長因子受容体(EGFR)チロシンキナーゼ阻害剤。2002年7月、「手術不能又は再発非小細胞肺癌」を適応症として、世界に先駆けてはじめて承認された。


コメント