光学異性体の非自明性: CAFC Docket No.2007-1059
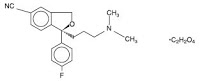
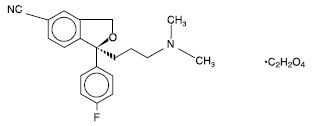
“substantially pure (+)-enantiomer of citalopram”つまり”escitalopram”をカバーするUS reissue Patent 34,712の特許権者であるForest社が販売する抗うつ薬であるescitalopram oxalate(商標名: Lexapro; 選択的セロトニン再取込阻害剤(SSRI))について、ジェネリックメーカーであるIvax社がFDAにANDA申請したことに対し、同特許を侵害しているとしてForest社が訴訟を提起した。
ラセミ体であるcitalopramは公知であり、Ivax社及びCipla社は、”いずれか一方のcitalopram enantiomerがセロトニン再取込阻害剤として他方の異性体よりもより強力だろう”と予言した”Smith reference”によって、該特許は、新規性を失っているし、また自明でもあり、特許は無効である等を主張した。地裁は特許有効であると判断、Ivax社及びCipla社は控訴した。
【要旨】
新規性について、CAFCは下記のように述べ、新規性ありとした地裁判決を支持した。
Because a racemate does encompass its two enantiomers, it in effect does state that there is a (+)-enantiomer of citalopram, but it does not tell how to obtain it. A reference that is not enabling is not anticipating. Elan Pharm., Inc. v. Mayo Found. For Med. Educ. & Research, 346 F.3d 1051, 1054 (Fed. Cir. 2003). The Smith reference, as a pharmacology paper, thus does not enable the preparation of the (+)-enantiomer of citalopram. ~ we see no error in the finding that the Smith reference does not enable one of ordinary skill to make (+)-citalopram and hence that the Smith reference does not anticipate claims to (+)-citalopram.
自明性について、
In response, Forest argues that any prima facie obviousness based on racemic citalopram was rebutted by the evidence demonstrating the difficulty of separating the enantiomers and the unexpected properties of (+)-citalopram. Forest argues that it was unexpected that all of the therapeutic benefit of citalopram would reside in the (+)-enantiomer, resulting in escitalopram having twice the potency of racemic citalopram. Forest also argues that the district court was entitled to credit evidence that a person of ordinary skill in the art would not easily have turned to the diol intermediate to attempt resolution of racemic citalopram both because of the uncertainty involved and because Wilen and Jacobus describe compounds less complex than those necessary here to resolve the diol intermediate and then convert the (-)-diol enantiomer to escitalopram.
CAFCは下記のとおり、上記Forest社の主張を認め、Graham factorを適用して自明でないとした地裁判決を支持した。
We agree with Forest that the district court’s key factual findings underlying its conclusions on obviousness are not clearly erroneous, and, based upon those findings, we find no error in the court’s conclusion that the asserted claims of the ’712 patent are not invalid for obviousness. As with their arguments on anticipation, Ivax and Cipla mainly emphasize the evidence that is favorable to their desired outcome without addressing the evidence favorable to Forest. The latter includes the failure of the inventors and others to resolve citalopram without undue experimentation and the testimony of Forest’s experts. The district court applied the Graham factors to conduct a thorough analysis of the evidence, and we find no clear error on facts and no error of law. See Graham v. John Deere Co., 383 U.S. 1 (1966). These findings fully support the conclusion that the claimed subject matter would not have been obvious to one of ordinary skill in the art.
‘712特許は有効。侵害と判断した地裁を支持。
【コメント】
光学異性体の新規性及び非自明性が争われたケース。
本件において、下記点を主張することによって、prima facie obviousnessを反証し、公知ラセミ体から光学異性体発明の非自明性が認められた。
1) エナンチオマーを分離することの困難さを証拠として示せたこと、及び
2) (+)-enantiomer of citalopramに全ての治療benefitがあるとの点は予期できなかったことであるとこと。
特に1)の点の主張が大きく影響したようである。
この判決の6日後に出された異なる事件のCAFC判決2007.09.11 「Aventis and King v. Lupin」 CAFC Docket No. 2006-1530, -1555では、ラセミ体から光学異性体のprima facie obviousnessを反証することができず自明とされた。
KSR事件(自明性判断に関する最高裁判決)後における米国での光学異性体の自明性判断のボーダーラインを検討するために参考になると考えられる。


コメント