投与期間に特徴のある医薬の進歩性は?: 知財高裁平成17年(行ケ)10303
【背景】
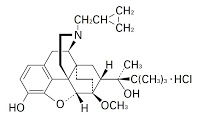
「ブプレノルフィンによる持続的痛覚消失」の発明(特願平10-536980号)について、進歩性なしとの拒絶審決に対して取消訴訟を提起。引例とは「ブプレノルフィンの経皮送達システムの皮膚への適用により疼痛を治療する」という点で一致、本件発明は、3日間にさらに少なくとも2~6日の追加の投与期間を維持するとの構成要件であったが、引例は投与期間については言及されていなかったという点で相違していた。
請求項35:
ブプレノルフィンを含む経皮送達システムをヒト患者の皮膚上に適用し,3日間の投与期間にわたって該経皮送達システムの皮膚への接触を維持することによる中程度から重篤な疼痛を有するヒト患者を治療する方法のための薬剤の製造におけるブプレノルフィンの使用であって,前記経皮送達システムが適当な相対放出速度を維持して約3日間だけヒト患者に有効な痛覚消失を与えるのに十分なブプレノルフィンの量を含み,前記経皮送達システムは前記3日間の投与期間の後の少なくとも2~約6日の追加の投与期間,前記ヒト患者の皮膚への接触が維持され,これによりヒト患者が有効な痛覚消失を受け続けるものである,前記使用。
【要旨】
薬物動態を確認することは当業者が当然に思考する作業であり、本件投与期間を適用することも周知技術に照らして容易に相当することができる。皮膚への適用を継続すれば所定の効果が一定期間持続することは当業者であれば当然に予測したといえる。
請求棄却。
【コメント】
投与期間を持続すれば効果も持続することは、当業者が当然に予測できるといえる。本件投与期間の維持によって、何か予想できない効果があれば良かったのでは。
投与方法等で限定されたクレームが一定の条件のもと用途発明として認める旨を明確化した「医薬発明」の審査基準が「第VII部 特定技術分野の審査基準」の第3章として2005年4月に公表されたが、米国に比べ日本においては、まだまだこの点で争われた判決の蓄積が少ないので、本事案は今後の用法・用量に関する進歩性主張を検討する題材として参考になる。
ちなみに、現在、日本では、塩酸ブプレノルフィン(buprenorphine hydrochloride)は、鎮痛剤「レペタン注」、「レペタン坐剤」として大塚製薬から市販されており、既にジェネリック医薬品が参入している。本件出願人であるEuro-Celtique SAは、徐放性製剤技術に強いNapp/Purdue/Mundipharma independent associated companiesのpatent holding agentであり、ブプレノルフィン経皮吸収剤の臨床試験が現在実施中のようである。
参考:
- Euro-Celtique SA website: http://www.euro-celtique.com/
- Mundipharma website: History and Timeline
- 久光製薬ニュースリリース: 2007.8.6 「Norspan®」の独占的な販売権に関するプレスリリース
- 審査基準: 「第VII部 特定技術分野の審査基準、第3章 医薬発明、2.3 進歩性」
(4) 投与間隔・投与量等の治療の態様により特定しようとする医薬 特定の対象患者群、又は特定の適用範囲に対して、薬効増大、副作用低減といった当業者によく知られた課題を解決するために、医薬の使用の態様(投与間隔・投与量等)を好適化させることは、当業者の通常の創作能力の発揮である。したがって、請求項に係る医薬発明において、引用発明との比較で新規性が認められるとしても、引用発明と比較した有利な効果が当業者の予測し得る範囲内である場合は、その進歩性は否定される。しかし、引用発明と比較した有利な効果が、技術水準から予測される範囲を超えた顕著なものであること等、他に進歩性の存在を推認できる場合は、その発明の進歩性は肯定される(事例8)。

コメント