特定患者に対する限定が新たな医薬発明として認められるか?: 東京高裁平成16年(行ケ)233
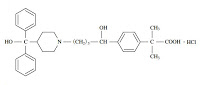
「ターフェナジンカルボキシレートを含有する、ターフェナジンのすすめられる投与量でQT延長及び/又は心室頻拍の心臓の異常を起こすヒトの患者用の抗ヒスタミン剤」に関する発明(特表平7-506828)についての、拒絶審決取消訴訟。
審決の内容は、引用例に記載された発明であるから、特29条1項3号により特許を受けることができないとするものであった。
引用例記載の発明とは、ターフェナジンカルボキシレートを含有する抗ヒスタミン剤である点において一致していたが、「ターフェナジンのすすめられる投与量でQT延長及び/又は心室頻拍の心臓の異常を起こすヒトの患者用」という点が引用例には記載されていなかった。
この特定患者に対する限定事項が加わったことにより、新たな用途発明(選択発明)が提供されたといえるのか、それとも実質的相違は無いのかが争われた。
【要旨】
裁判所は、
「引用例においては、ターフェナジンについての適用対象患者を特に除外していないのであるから、審決が、「引用例記載の発明は「ターフェナジンのすすめられる投与量でQT延長及び/又は心室頻拍の心臓の異常を起こすヒトの患者に使用すること」を特に除外するものではない」とした点に誤りは無い。~本件優先権主張日当時の技術水準からすると、ターフェナジンよりも、その代謝物であるターフェナジンカルボキシレートが、「ターフェナジンのすすめられる投与量でQT延長及び/又は心室頻拍の心臓の異常を起こすヒトの患者」用の抗ヒスタミン剤として有利であることは、当業者にとって自然に理解しえたというものであるべきである。そうすると、~引用例との関係で選択発明として認められるべきであるとすることはできず、引用例記載の発明との対比において新規性を欠くものではないとすることはできない。」
と判断した。
請求棄却。
【コメント】
患者を限定した医薬発明についての新規性の有無が判断された事件。
この事件の後、2005年4月15日に特許庁が「医薬発明の審査基準」を新設しており、その「医薬発明」の審査基準2.2.1.1 (3-2)には下記のような記載がされている。
(c) 引用発明の医薬用途が請求項に係る医薬発明の医薬用途の上位概念で表現されており、本願出願時における技術常識から、下位概念で表現された請求項に係る医薬発明の医薬用途が導き出せるときは、請求項に係る医薬発明の新規性は否定される
仮に、ターフェナジンの心毒性が知られていなかった場合には、本クレームの特許性はどのように判断されただろうか?
ターフェナジンカルボキシレートを含有する抗ヒスタミン剤が知られていたわけで、引用発明との違いは、「ターフェナジンのすすめられる投与量でQT延長及び/又は心室頻拍の心臓の異常を起こすヒトの患者用」との下位概念への限定のみであるから、患者を特定した選択発明として特許性を有するか否かが問題になるだろう。
選択発明の進歩性が認められるためには、その選択部分(ターフェナジンで心毒性を起こす患者)に限定したことにより本発明の(抗ヒスタミン剤としての)効果が、それ以外の部分(ターフェナジンで心毒性を起こさない患者)に対する効果よりも、顕著であるか、または異質なものであることを主張しなければならないから、本件の場合には無理があろう。
また、裁判所は、
「本願発明は,ターフェナジンカルボキシレートにはターフェナジンが有する副作用がないことを確認したものであるとしても,抗ヒスタミン剤に関する本件優先権主張日までの既知の用途を拡大したものでもないし,新たな用途を見いだしたものでもない。本願発明は,引用例に記載の抗ヒスタミン剤であるターフェナジンカルボキシレートに関して,ターフェナジンによる副作用が観察されない範囲を特定したものにすぎないものである。」
と判断していることから、患者の特定のみを特徴とする医薬発明の特許性のハードルは高そうである。
ちなみに、医薬発明の審査基準2.2.1.1 (3-3)及び3.3〔事例 8〕には、投与間隔・投与量等の治療の態様等による特定を伴う対象患者群を特定した医薬発明の特許性について記載されている。
司法の場で、本出願のように医薬用途の態様を様々な視点からクレームした「医薬発明」の出願についての判断が蓄積されていくことを期待するところである。
なお、本願のファミリー出願が欧米では特許となっており、この点、日本の実務と比較し、検討することは非常に興味深い。
日本で特許化が困難そうでも、欧米で取得できる可能性も出願戦略上考慮する必要があるだろう。
- EP0639976 B1
- US6037353 A
- US6187791 B1
- US6399632 B1
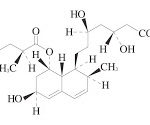
参考:ターフェナジンカルボキシレート
ターフェナジン(一般名:テルフェナジン、販売名:トリルダン、抗アレルギー薬として販売されていた。)の活性代謝物であり、製剤化が検討され、抗アレルギー薬(一般名:塩酸フェキソフェナジン(Fexofenadine)、販売名:アレグラ(Allegra))としてサノフィ・アベンティス(sanofi-aventis)が販売に至っている。活性代謝物の製剤化によって製品のライフサイクルマネージメントに成功した事例である。そのような背景から考えると、本件出願は、アレグラに関するライフサイクルパテントのひとつだったと考えられ、非常に参考になる事例である。

コメント