・・・特許6275900の進歩性を認めた審決を取り消す。
前回記事「骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」

1.はじめに
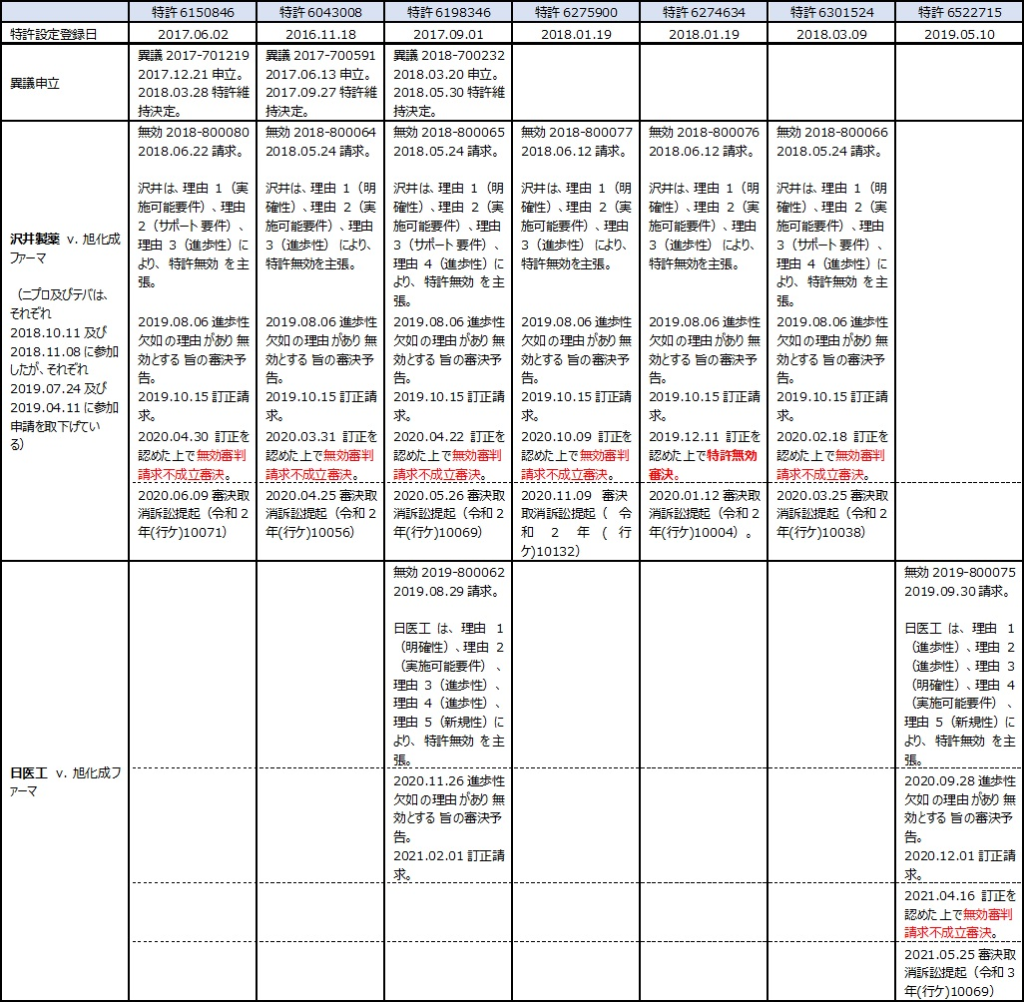
旭化成ファーマが製造販売する週1回皮下投与の骨粗鬆症治療剤「テリボン®皮下注用56.5μg」のジェネリック参入障壁となっていると考えられるのが、テリパラチドの週1回投与を特徴とする発明に係る7つの特許(存続期間満了は2030年9月8日)である(表1)。いずれの特許に対してもジェネリックメーカーが無効審判を請求し、それらいずれの事件も審決の取消しを求めて知財高裁での訴訟にまで発展した(表2)。最近になり、それら判決が次々と出てきている。
本記事では、これまでの2つの記事:
- 特許第6274634号についての記事「2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①」
- 特許第6043008号についての記事「2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②」
に続く3回目として、特許第6275900号の無効審判請求事件を判断した知財高裁判決(知財高裁令和2年(行ケ)10132)について紹介する。この事件は、旭化成ファーマの7つの特許の無効審判請求のうち、特許発明の進歩性を認めた審決の取消しを求めて沢井製薬が提訴したものである。

2.背景
本件(知財高裁令和2年(行ケ)10132)は、旭化成ファーマ(被告)が特許権の設定登録を受けた発明の名称を「骨粗鬆症治療剤ないし予防剤」とする特許第6275900号に対して沢井製薬(原告)がした無効審判請求(無効2018-800077号事件)を請求不成立とした審決の取消訴訟である。争点は、進歩性に関する判断の誤りの有無である。
本件発明(訂正後請求項1):
(1)年齢が65歳以上である
(2)既存の骨折がある
(3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である
(4)クレアチニンクリアランスが30以上50未満ml/minである腎機能障害を有する。
| 本件発明 | 甲7発明 | 一致点/相違点 | |
|---|---|---|---|
| 1 | 1回当たり200単位のPTH(1-34)酢酸塩が週1回投与されることを特徴とする,PTH(1-34)酢酸塩を有効成分として含有する,骨粗鬆症治療剤ないし予防剤であって, | 1回当たり200単位のPTH(1-34)酢酸塩が週1回投与されることを特徴とする,PTH(1-34)酢酸塩を有効成分として含有する,骨粗鬆症治療剤ないし予防剤であって, | 一致 |
| 2 | 下記(1)~(4)の全ての条件を満たす骨粗鬆症患者を対象とする, ・・・ (1)年齢が65歳以上である (2)既存の骨折がある (3)骨密度が若年成人平均値の80%未満である,および/または,骨萎縮度が萎縮度I度以上である (4)クレアチニンクリアランスが30以上50未満ml/minである腎機能障害を有する。 | 厚生省による委員会が提唱した診断基準で骨粗鬆症と定義された,年齢範囲が45歳から95歳の被検者のうち,複数の因子をスコア化することによって評価して骨粗鬆症を定義し,スコアの合計が4以上の場合の患者であって,2mg/dlより高い血清クレアチニン又は30mg/dlより高いBUNによって示される腎機能が低下している患者は除外された患者を対象とする, | 相違点1 |
| 3 | 骨折抑制のための | (そのような特定がない) | 相違点2 |
| 4 | 骨粗鬆症治療剤ないし予防剤 | 骨粗鬆症治療剤ないし予防剤 | 一致 |
本件審決は、
これらの文献の記載から、hPTH(1-34)の体内での分解・排泄が早く、軽度~中等度腎機能障害者に投与しても安全性の高い薬物であることまでは認められるが、他方、これらのいずれの文献にも、甲7発明の骨粗鬆症治療剤を、上記(1)~(3)の三条件を全て満たし、かつ、クレアチニンクリアランスが30以上50未満ml/minである中等度腎機能障害を有する者を選んで投与することなどは記載されておらず、また、そのような4つの条件を全て満たす患者において、上述(b)の顕著な骨折抑制効果が期待されることなどを当業者は予測し得なかったと認められる。
そして、請求人が、本件特許発明の特許要件判断の基準日当時の技術常識として示す他のいずれの甲号証をみても、甲7発明の骨粗鬆症治療剤を投与したときに、これらの4つの条件を全て満たす骨粗鬆症患者において、上述の顕著な骨折抑制効果が発揮されることを示唆する文献などはない。
よって、甲号証、及び、合議体が引用する引用文献のいずれを組み合わせてみても、上記(1)~(3)の三条件を全て満たし、かつ、クレアチニンクリアランスが30以上50未満ml/minである中等度腎機能障害を有する骨粗鬆症患者群に、200単位のhPTH(1-34)酢酸塩を週1回投与したときに、当該四条件の非充足患者よりも顕著に優れた骨折抑制効果が発揮されることを、当業者が予測し得たものであったとすることなどはできないから、相違点1に係る、当該4つの条件を満たす患者群に甲7発明の治療剤を投与することを、本件特許発明の特許要件判断の基準日において、当業者が容易に想到し得たとは認めることができない。
・・・述べたとおり、相違点1に係る患者群に甲7発明の治療剤を投与することを当業者が容易に想到し得たとはいえないのであるから、本件特許発明1は、相違点2について検討するまでもなく、進歩性を有するものである。
と判断した。
- 甲7文献:「ヒト副甲状腺ホルモン(1-34)の骨粗鬆症に対する間欠週1回投与の効果:3種類の投与量を用15 いた無作為化二重盲検前向き試験」 Osteoporosis International vol. 9, p296–306 (1999)
3.裁判所の判断
裁判所は、甲7発明に接した当業者が、投与対象患者を本件条件(1)、(2)及び(3)を全て満たす患者と特定すること、そして、本件条件(4)を満たす者とすることは、格別困難を要することとはいえず、本件発明の構成は容易想到であると判断した。
これに対し、被告は、本件発明は、当業者が予測できない顕著な効果を奏するものである旨主張した。
しかし、裁判所は、主張された骨折抑制効果については、低リスク患者において有意差がなかったとの結論が少ない症例数をもとに導かれたものである(症例数が不足していることによることを否定できない)ことから優れた効果であることを理解することができず、本件発明が、予測できない顕著な効果を奏するものであると認めることはできないと判断した。
裁判所は、相違点1が容易に想到できないと認定した本件審決の判断には誤りがあるから、相違点2について検討するまでもなく本件発明の進歩性を認めた本件審決の判断に誤りがあり、進歩性に関する判断の誤りについての取消事由には理由があるから、その他について判断するまでもなく、本件審決を取り消した。
4.コメント
(1)7訴訟中、旭化成ファーマの0勝3敗(残るは4判決)
本事件で争われた特許第6275900号は元をたどると特願2011-530844(出願日2010年9月8日; 再表2011/030774; WO2011/030774)を原出願とするものであり、テリパラチドの週1回投与を特徴とする発明に係る7つの特許により構成される特許ファミリーのうちのひとつである。
同日に以下のファミリー特許についての判決も出されており、本事件における判決内容とほぼ共通する(いずれも旭化成ファーマの敗訴)。
- 2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004・・・特許第6274634号(参照:2021.08.31 「旭化成ファーマ v. 沢井製薬」 知財高裁令和2年(行ケ)10004 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判①)
- 2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056・・・特許第6043008号(参照:2021.08.31 「沢井製薬 v. 旭化成ファーマ」 知財高裁令和2年(行ケ)10056 骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判②)
コメントについては上記記事を参照してほしい。コメントの主な点は以下のとおり。
- 旭化成ファーマの敗因
- 効果の程度についての判断に参酌できる観点
- 進歩性のための明細書記載要件
- 特許庁は進歩性を認めていた
- 主張立証責任を負う出願人は比較試験の妥当性を慎重に検討すべき
(2)欧州特許庁での審査
欧州ファミリーとして現在登録されている特許は以下の3つである。
例えば、EP2682125B1の審査においては、出願人(旭化成ファーマ)は、進歩性の主張のため解析データ等を提出し、提出された実験データが選択された患者グループに伴うクレームの効果をサポートしていないとする拒絶理由に対して反論することにより特許許可を勝ち取っている(登録後の異議申立て無し)。
(1) age 65 years or older;
(2) prevalent bone fractures;
(3) bone density less than 80% of the young adult mean and/or a degree of bone atrophy of l or higher.
(1) age 65 years or older;
(2) prevalent bone fractures;
(3) bone density less than 80% of the young adult mean and/or a degree of bone atrophy of I or higher.
最近、欧州特許庁審判部は、ある別事件(T0116/18)において、進歩性の判断における技術的効果の「plausibility(「もっともらしさ」、「信頼性」、「妥当性」と訳される場合がある。)」と、出願後に得られた実験データをその技術的効果の証明として使用できるかどうか、との関係について、拡大審判部に照会して判断を仰ぐべきであると決定した。
参考:
- 2021.08.10 D YOUNG&CO Potential EPO Enlarged Board of Appeal referral: post-published data to support inventive step?
- 2021.09.20 創英国際特許事務所 「進歩性の判断における技術的効果の『妥当性』と、この技術的効果を立証するための『“post-published“ data』との関係についてのEPO拡大審判部への照会」
テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る本件事件において、知財高裁は、当該発明の効果が「予期できない顕著な」ものであることを出願明細書の記載から理解できること、いわば、「予期できない顕著な」ものであることが出願明細書の記載から「plausibile」であること、を求め、そうでない以上、原則「後出しデータ」を参酌することはできないと判断したともいえる。
このような日本の判断が、上記別事件での拡大審判部による結論も含めた欧州特許庁の「plausibility」についての一般判断基準と違いがあるのかどうか、比較してみることは進歩性判断を検討するうえで実務上有用かもしれない。
5.おわりに
骨粗鬆症治療剤テリボン®は旭化成ファーマの主力品である。
ジェネリック参入の障壁となっていると考えられる本件特許について発明の進歩性を認めた審決を取消した今回の知財高裁判決は、まだ判決が出されていない他の4つのファミリー特許で争われている進歩性の判断、さらにそれらの結果次第ではジェネリック参入可能性に極めて大きなインパクトを与えることになるかもしれない。
残り4つの裁判の行く末も目が離せない。
次回記事「骨粗鬆症治療剤テリボン®(テリパラチド酢酸塩)の週1回投与特許を巡る裁判④」


コメント