・・・パリエット®のPPI抵抗性逆流性食道炎に対する維持療法に関する用法・用量特許を無効とする判断。臨床試験の結果を頼りとする特許出願のタイミングについて ー特許取得可能性の観点とジェネリックへの対抗力の観点からー
1.パリエット®の「PPI抵抗性逆流性食道炎に対する維持療法に関する用法・用量」追加とジェネリックの参入
エーザイは、2017年9月22日にパリエット®錠5mg/10mg(一般名: ラベプラゾールナトリウム(Rabeprazole Sodium))について、プロトンポンプ阻害剤抵抗性逆流性食道炎(プロトンポンプ阻害剤の1日1回投与による従来の治療で効果不十分な逆流性食道炎)に対する維持療法に関して、ラベプラゾールナトリウムとして1回10mg、1日2回投与の用法・用量追加の承認(以下、「本件用法・用量追加承認」という。)を取得している。この用法・用量について、エーザイの子会社であるEAファーマ(株)は日本特許第6283440号(以下、「本件特許」という。満了日2037年4月4日。)を保有している。
2016年10月28日に本件用法・用量追加承認申請が行われ、その前日に、EAファーマにより当該用法・用量についての本件特許に係る出願(優先権の基礎となる出願)がされている。この申請日前日の出願というタイミングから、申請ギリギリまで待っての出願という計画的なものだったと想像できる。しかし、1年を待たずに優先権を主張して出願、早期審査請求を行い、登録(2018年2月2日)させることができたものの、その特許登録よりも前に、パリエット®の本件用法・用量追加承認に至ってしまい(2017年9月22日)、結果、沢井製薬等からのジェネリックにも本件特許の登録前に同用法・用量について追加承認を許すこととなっしまった。当該用法・用量をクレームしている本件特許に対して沢井製薬が無効審判を請求しており、先発(エーザイ/EAファーマ)と後発(沢井製薬)の特許攻防がどうなるか注目されていた(2019.10.16 記事: パリエット®(ラベプラゾール)逆流性食道炎の再発抑制に関する用法・用量特許を巡るジェネリックメーカーの動き)。
2.パリエット®の「PPI抵抗性逆流性食道炎に対する維持療法に関する用法・用量」特許の無効を巡る裁判
(1)背景
本件(知財高裁令和2年(行ケ)10094)は、原告EAファーマが特許権の設定登録を受けた「逆流性食道炎の再発抑制剤」に関する特許第6283440号(本件特許)に対して沢井製薬がした無効審判請求(無効2019-800035号事件、被告大原薬品は特許法148条1項参加)についての特許無効審決(2020.08.16 記事: パリエット®のプロトンポンプ阻害剤抵抗性逆流性食道炎維持療法に関する特許、特許庁が無効判断)の取消訴訟である。主たる争点は、進歩性についての認定判断の誤りの有無である。
本件特許に係る請求項1と引用発明(甲1発明)との一致点及び相違点1(唯一の相違点)を表1に示した。要は、引用文献(甲1)には、臨床試験計画(プロトコル)の記載に留まり、その試験結果までは記載されていないというものである。
| 請求項1(訂正後) | 引用発明(甲1発明) | 一致点 | 相違点1 |
|---|---|---|---|
| ラベプラゾールナトリウムを有効成分とし,維持療法を行う前の治療により治癒したプロトンポンプ阻害剤抵抗性逆流性食道炎患者に対する維持療法のために,ラベプラゾールナトリウム10mgを1日2回,4週間以上投与されることを特徴とする,プロトンポンプ阻害剤抵抗性逆流性食道炎の再発抑制剤。 | PPI抵抗性逆流性食道炎患者に対する維持療法における,E3810 10mg 1日2回投与の有効性と安全性を検討するための第Ⅲ相臨床試験に供されるE3810であって,前記第Ⅲ相臨床試験は,PPI抵抗性逆流性食道炎患者に,維持療法期間中,E3810 10mgを1日2回52週間投与するものであり,前記患者は,治療期間中は E3810 10mgを1日2回投与された患者である,E3810。 | 維持療法を行う前の治療により治癒したプロトンポンプ阻害剤抵抗性逆流性食道炎患者に対して,維持療法期に,10mgを1日2回,4週間以上投与される,ラベプラゾールナトリウム | 本件発明1は,「ラベプラゾールナトリウム」を有効成分とする,「維持療法のために」投与される「プロトンポンプ阻害剤抵抗性逆流性食道炎の再発抑制剤」であるのに対して, 甲1発明は,「PPI抵抗性逆流性食道炎患者に対する維持療法における」「有効性と安全性を検討するための第Ⅲ相臨床試験に供されるラベプラゾールナトリウム(E3810)」である点。 |
(2)裁判所の判断
裁判所は、原告が主張する取消事由1(甲1に基づく進歩性欠如における判断の誤り)は認められないから、その余の点について判断することなく、原告の請求を棄却した。
以下に、裁判所の判断の一部を抜粋した。
ア 相違点1に係る構成の容易想到性について
(ア) 本件優先日当時の技術常識として,①逆流性食道炎の治療について,ラベプラゾールナトリウムは,治療期と維持療法期のいずれにおいても,酸分泌抑制作用という共通の作用によって,治療効果や再発防止効果をもたらすものとみられたこと(前記ア(ア)a,c),②胃酸分泌の抑制効果は,ラベプラゾールナトリウムの投与量や投与回数と正の相関関係にあり(同(ウ)a),治療期における用法・用量もそのような理解に沿うものとなっていたこと(同(イ)a),③胃酸分泌抑止作用の強さは,維持療法における再発率とも関連していると考えられていたこと(同(ウ)a),④PPI抵抗性逆流性患者の治療期において,20mgの1日1回投与より,10mgの1日2回投与の抑制効果の優越性が認められていたこと(同(ウ)b)を指摘することができる。
上記の点を踏まえると,本件優先日当時,当業者においては,PPI抵抗性逆流性食道炎患者の維持療法期におけるラベプラゾールナトリウムの利用について,従来の逆流性食道炎患者に対する維持療法期における「1回10mgを1日1回」という用法・用量を,特にそのうちPPI抵抗性逆流性食道炎患者については「1日2回」に増やすという方向で,あるいは,PPI抵抗性逆流性食道炎患者の治療期における「1回10mg又は1回20mg(重度の粘膜傷害を有する場合に限る。)を1日2回」という用法・用量を踏まえ,それをPPI抵抗性逆流性食道炎患者の維持療法期にも広げるという方向で,「1回10mgを1日2回」という用法・用量を設定し,もって,PPI抵抗性逆流性食道炎患者に対してより高い再発抑制効果を有する薬剤として利用することを,容易に想到することができたといえる。
(イ) 前記ア(エ)の安全性に関する技術常識を踏まえると,本件優先日当時,ラベプラゾールナトリウムの維持療法における20mg1日1回長期投与の忍容性は,当業者に明らかであった(前記ア(エ)a,b)ところ,1日2回投与と1日1回投与とでは安全性に差異はないと考えられていたこと(前記ア(エ)c)をも考慮すると,「1回10mgを1日2回」「4週間以上」投与することについて,臨床上の安全性の観点から阻害されたといった事情も見受けられない。なお,甲42及び44のガイドラインには,PPIの長期投与の安全性に関する懸念についての記載があるが,「いずれの懸念もPPI投与との直接的な因果関係が明らかとはいいがたい」(甲42)などとされており,上記判断を左右するものではないし,甲23及び29~31の各PPIの添付文書における注意書きも,薬剤の添付文書における一般的な副作用等についての記載にすぎず,上記判断を左右するものではない。
(ウ) そうすると,甲1発明のラベプラゾールナトリウムを,PPI抵抗性逆流性食道炎患者の維持療法期に投与する再発抑制剤として用い,相違点1に係る本件発明1の発明特定事項を採用することは,当業者が容易に想到することができたものということができる。
(エ) ラベプラゾールナトリウムを有効成分とするパリエット錠10mgの維持療法期における投与に係る審査の際,申請者において,10mg投与では胃酸分泌抑制が十分でないために一定の場合には20mgを投与することが妥当であるとの見解を示したところ,20mg投与による胃酸分泌抑制効果が10mg投与によるものより高い可能性は示唆されているが,再発に関わる胃酸分泌抑制にその程度の胃酸分泌抑制が必要かどうかに疑問があるとされ,1日1回20mgの申請が取り下げられたという経緯(前記3(6)イ(ア)及びウ(ア)[甲9])は,本件優先日当時,当業者において,PPI抵抗性逆流性食道炎患者を含めた逆流性食道炎患者の維持療法期におけるラベプラゾールナトリウムの利用について,「1回20mgを1日1回」という用法・用量を設定し,もって,PPI抵抗性逆流性食道炎患者に対してより高い再発抑制効果を有する薬剤として利用することを容易に想到することができたことを示す事情ということができ,それを分割投与する「1回10mgを1日2回」という用法・用量の設定による再発抑制効果の向上も,同様に,当業者において容易に想到することができたとみることに沿う事情であるといえる。
イ 本件発明1の効果について
本件明細書の段落【0015】には,本件発明に係る再発抑制剤について,従来の維持療法よりも有意に高い再発抑制効果を奏することができること及び臨床上比較的安全に服用することができることの記載があり,同【0051】~【0067】においても,顕著に優れた再発抑制効果が得られること及び長期投与の安全性が記載されている。
しかし,前記ア(ア)~(ウ)の技術常識及びこれから認められる前記イ(ア)①~④の点を踏まえると,上記各段落に記載された再発抑制効果が,本件優先日当時,PPI抵抗性逆流性食道炎患者の維持療法期にラベプラゾールナトリウムについて「1回10mgを1日2回」という用法・用量で用いることによって達成され得るであろうと当業者において予測し得た範囲の再発抑制効果を超える顕著な効果であったとは認められない。また,前記ア(エ)の技術常識を踏まえると,上記各段落に示された安全性に係る効果が,本件優先日当時,PPI抵抗性逆流性食道炎患者の維持療法期にラベプラゾールナトリウムについて「1回10mgを1日2回」という用法・用量で用いることによってもなお達成され得るであろうと当業者において予測し得た範囲の安全性を上回る顕著な効果であったとも認められない。
したがって,本件発明1の効果が,当業者が予測し得ない顕著なものということはできない。
エ よって,本件発明1は,甲1発明及び技術常識に基づいて,当業者が容易に発明をすることができたものであるといえる。
ウ 原告が引用する判決について
原告は、
平成29年判決を踏まえると,本件発明のように用法・用量に特徴のある医薬の用途特許発明の容易想到性の判断においては,当業者が想到する発明の構成として,用法・用量に加え,その効果が必要不可欠な要素として含まれており,そして,その効果については,臨床効果を確認しない限り,知ることが困難である。・・・具体的な根拠を示すことなく本件発明1の効果について顕著な作用効果の存在を否定した本件審決の判断は,令和元年最判(最高裁平成30年(行ヒ)第69号令和元年8月27日第三小法廷判決・裁判集民事262号51頁)の判断内容に反するものである。
と主張した。
- 平成29年判決については、記事「2017.02.28 「ザ・ヘンリー・エム・ジャクソン・ファンデイション v. 特許庁長官」 知財高裁平成28年(行ケ)10107」参照。
- 令和元年最判については、記事「2019.08.27 「アルコン・協和キリン v. X」 最高裁平成30年(行ヒ)69」参照。
しかし、裁判所は、以下のとおり、原告の主張を認めなかった。
原告は,平成29年判決を引用して主張するが,同判決は「新規性」について判断したもので「進歩性」について判断したものではないから,事案を異にすることは明らかである。また,以上の本件発明1の進歩性についての判断が令和元年最判に反するものではないことも明らかである。
エ 原告がその他主張する点について
原告は,臨床試験情報の公開の制度との関係や医薬品の用法・用量に係る特許の意義などについて主張するが,本件発明1は,既に判示したとおり,甲1発明及び技術常識に基づいて進歩性を否定されるものであって,そのことが不合理であるとか,我が国の患者の選択肢を不当に狭めるものであるなどということはできない。
(3)コメント・・・裁判所は新規性について判断せず、進歩性について容易想到性及び効果の顕著性を否定
本判決では新規性について判断しなかったが、原審(審決)では、沢井製薬による甲1に基づく新規性欠如(無効理由1)の主張について、
甲1には,第Ⅲ相の臨床試験計画が記載されているのみで,当該計画を実施した結果については,全く記載されていない。また,本件優先日当時,PPI抵抗性逆流性食道炎患者に対する維持療法としてラベプラゾールナトリウム10mgを1日2回投与することについて,何らかの技術常識があったとはいえない。そうすると,甲1の記載及び本件優先日当時の技術常識からは,甲1発明に係る第Ⅲ相臨床試験に供されるラベプラゾールナトリウムを,PPI抵抗性逆流性食道炎患者の再発抑制剤として用いることができることが,明らかであるとはいえないから,相違点1は,実質的な相違点である。したがって,本件発明1は,甲1発明と同一ではない。
として、甲1に臨床試験結果の記載がないことを理由に新規性ありと特許庁が判断している点は興味深い。
引用文献における臨床試験結果の記載の有無が特許性の判断に大きな影響を与えた事例として、例えば、以下の判決がある。
- 2017.02.28 「ザ・ヘンリー・エム・ジャクソン・ファンデイション v. 特許庁長官」 知財高裁平成28年(行ケ)10107(臨床効果が記載されていないから引用発明の認定を否定)
- 2013.10.16 「沢井製薬 v. 第一三共」 知財高裁平成24年(行ケ)10419(医薬発明が開示されているといえるためには薬理試験が医薬用途を合理的に推論できる試験であれば足りる)
- 2007.03.01 「ブリストルマイヤーズスクイブ v. 日本ケミカルリサーチ」 知財高裁平成17年(行ケ)10818(臨床試験プロトコルの記載により新規性を否定)
原告は、
平成29年判決(2017.02.28 「ザ・ヘンリー・エム・ジャクソン・ファンデイション v. 特許庁長官」 知財高裁平成28年(行ケ)10107)を踏まえると,本件発明のように用法・用量に特徴のある医薬の用途特許発明の容易想到性の判断においては,当業者が想到する発明の構成として,用法・用量に加え,その効果が必要不可欠な要素として含まれており,そして,その効果については,臨床効果を確認しない限り,知ることが困難である。
と主張したが、裁判所は、
同判決は「新規性」について判断したもので「進歩性」について判断したものではないから事案を異にすることは明らかである。
として、「進歩性」判断における引用発明の適格性の議論にも繋がり得るかもしれない「新規性」判断における引用発明の適格性が争われた平成29年判決に基づく原告の主張に踏みこむことなく、「事案を異にする」と一刀両断した。
上記平成29年判決との関係で揉めるかもしれない引用文献(甲1)からの新規性の有無の判断、さらには引用発明の適格性に踏みこまずに、容易に判断可能な進歩性の有無について裁判所は判断したわけである。
医薬用途発明の特許性判断について、引用文献に当該用途を試験する記載があったとしてもその効果を示す結果が記載されていない場合(本件がその例)に、果たしてその引用文献は用途発明が完成したものとして記載されているといえるのか(引用発明と本願発明の用途発明の完成(成立性)に違いはあるのか)、引用発明として認定できるのか(新規性は欠如し得るのか)できないのか、新規性判断で引用発明として適格性が無ければ進歩性判断でも同様に適格性は無いことになるのかそれとも進歩性判断では引用適格性のハードルは低くなるのか、新規性は欠如しないとしたら進歩性は認められ得る余地はあるのだろうか(本件のように極めて容易想到であることがほとんどではないだろうか)、など古くからの疑問は湧いてくる。
なお、進歩性の判断では、相違点1に係る構成の容易想到性の観点と、発明の効果の観点、両方とも判断し、いずれも原告の主張は認められなかった。
発明の効果の顕著性を判断するにあたり、容易想到な構成と判断された以上、引用発明と比較してそれを超える効果であったかどうかを見るのではなく、容易想到な構成としての効果が達成され得るであろうと予測し得た範囲の効果を超える効果であったかどうかを決め手とした裁判所の判断は、妥当であったと思う。
3.臨床試験の結果を頼りとする特許出願のタイミング
(1)特許取得可能性の観点からのタイミング
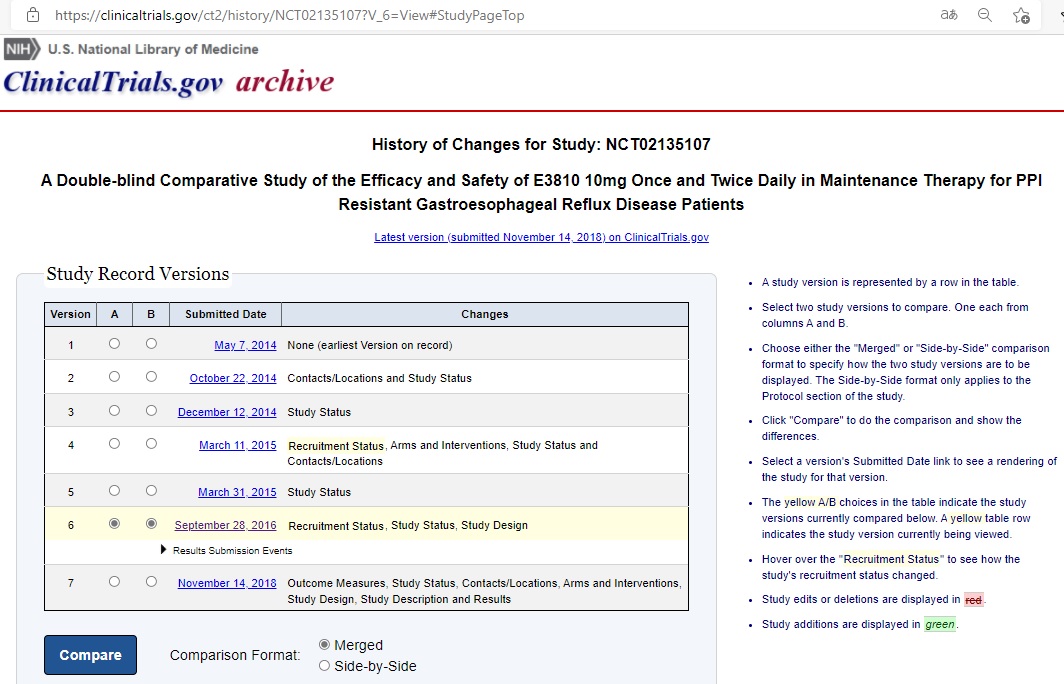
引用文献(甲1)は、本件優先日(2016.10.27)前に、エーザイが実施する臨床試験計画について作成した情報を米国のClinicalTrials.govが公開したもの(識別ID: NCT02135107)である。
本件の進歩性の問題は、エーザイが、自らの臨床試験情報(甲1)が公開される前に出願しておけば良かっただけではないのか・・・
事情はそう単純ではない。
ClinicalTrials.govに公開されている上記臨床試験(NCT02135107)のStudy Record Versionsを辿ると、これから開始しようとする臨床試験計画についてのVersion 1は2014年5月7日に提出され、臨床試験の結果が記載された最新のVersion 7は2018年11月14日に提出されている。ちなみに引用文献(甲1)は2016年9月28日に提出されたVersion 6の公開情報である(URL: https://clinicaltrials.gov/ct2/history/NCT02135107?V_6=View#StudyPageTop)。
臨床試験を実施する者(企業)には、公衆衛生上の利益として臨床試験の透明性を約束するため、臨床試験情報について自由にアクセス可能なインターネット上の登録簿に一定の臨床試験情報を、決められた時期までに、登録し公開することが求められている。この登録・公開は、臨床試験の結果が得られてから初めて行うものではなく、試験を開始する時点から求められている。つまり、臨床試験は開始段階で一定の情報が公開される。
頭を抱える(かもしれない)問題がここにある。
本件のように、臨床試験の結果を頼りにして医薬用途発明(新たな効能・効果または用法・用量など)を特許出願したい場合に、その出願タイミングをどうするか、すなわち、
- その臨床試験計画情報が公開される前に(つまり臨床試験結果を得る前に)特許出願をする(結果が得られていないため実施可能要件違反のリスクを負う)・・・選択肢1
- 臨床試験結果を得てから特許出願をする(試験計画情報公開後の出願になるため新規性・進歩性欠如のリスクを負う)・・・選択肢2
のいずれかの選択を迫られることになる。
米国であればグレースピリオド、日本では新規性喪失の例外の適用もあるから、選択肢2という可能性もあり得るが、臨床試験は数年に及ぶ場合がほとんどであり、通常、そのような適用は期待できない。
日本市場より欧米市場を優先とするなら、審査中のいわゆる「後出しデータ」での主張が功を奏することを期待して、選択肢1という考え方もあるだろう。
日本市場にのみ考えるのなら、審査中での「後出しデータ」の採用は厳しいかもしれないだろうから試験結果が得られてからそれを明細書に記載して出願して挑戦する(選択肢2)という考え方もあるだろう。本件は日本以外の国に出願していないようであるから、エーザイ・EAファーマは選択肢2を採用したと想像される。
肝となる発明の構成の詳細まで臨床試験情報として公開されない場合であったり、臨床試験結果を頼りにしなくても既に非臨床データから目的の医薬用途発明に係る特許を取得できる見込みである場合であったりするならば、臨床試験情報公開タイミングと出願タイミングにあまり悩む必要はないかもしれないが、臨床試験結果に裏付けられ、狭くともジェネリックが回避できないラベルの内容に一致させた強固なクレームを取得することができれば、製品を保護するためのセカンダリー特許としてはベストであり、理想である。特に用法・用量に関する発明となるとやはり臨床試験結果を頼りにせねばならず、出願タイミングは上記のような選択を迫られるケースは多いのではないだろうか。
以下のとおり、原告の持っていき場の無い思いが、国策・患者利益に反するとの主張に繋がっている。
原則として治験計画を事前に公開することが事実上義務付けられている状況下で,通常の医薬品の承認申請のために臨床試験計画(治験プロトコル)を公開した場合に,その臨床試験の結果を待たなければ医薬品発明が完成しないにもかかわらず,公開された試験計画を根拠として特許発明の進歩性が否定されるのであれば,極めて不合理な結論となる。
加えて,上記のような判断は,医薬品の用法・用量に特徴のある発明を物の発明として特許の保護対象とすることで,医薬品の研究開発への投資に対するインセンティブを高め,革新的な医薬品の開発促進を図るという我が国の知財及び医薬品開発戦略に反するものであり,製薬企業のみならず,革新的な医薬品の治療効果を享受できないという我が国の多くの患者にとってもデメリットを生ずるものである。
また,医薬品の用法・用量特許については,事前に作成した試験計画に基づき実施した臨床試験において,その効果が確認されて,初めて,発明が完成したといえるのであり,臨床試験で得られた結果を踏まえて,発明が完成され,その後に出願を行うより他に選択肢はない。他方で,前記アのように,現在制度上,医薬品の臨床試験の計画は原則として事前に公開することとなっている。
したがって,本件審決のように,未完成の発明でしかない臨床試験の計画の公表により,医薬品の用法・用量特許発明の進歩性が容易に否定されることになるのであれば,我が国における革新的な医薬品の開発は阻害され,結果として,我が国の患者の治療の選択肢が狭まるという不当な結果に至ることとなる。このような観点からも,本件審決に判断の誤りがあることは明らかである。
(2)ジェネリックへの対抗力の観点からのタイミング
本件のように、上市品について既にジェネリックの参入を許している状況で効能・効果や用法・用量等の追加承認(以下、「追加承認」という。)を計画している場合において、その追加承認のために得た臨床試験結果を頼りにした特許出願も行い、ジェネリックの同追加承認に対する障壁を築きたい(ジェネリックの効能・効果または用法・用量を既承認ののまま、いわゆる「虫食い」状態に抑えたい)戦略を練る場合には、少なくとも以下の点も検討する必要があるだろう。
- 追加承認に基づいて新たな再審査期間は設定されるか(いつジェネリックは同追加承認申請が可能となるのか)
- その特許出願はパテントリンケージの対象特許となりうるか
- ジェネリックが同追加承認の申請前に、その特許を取得できるか
本件では、パリエット®の本件用法・用量追加承認に基づいて新たな再審査期間は設定されず、従って、当該追加承認後、ジェネリックも同追加承認申請が速やかに可能となった。しかし、肝心の本件特許出願はまだ登録に至っておらず、従って、パテントリンケージは働かず、結果、ジェネリックの同追加承認を許してしまった。表2にそれらのタイムラインを示した。
| 年 | パリエット® | 本件特許ヒストリー | ジェネリックの動き |
|---|---|---|---|
| 2016 | 10/28 本件用法・用量追加承認申請 | 10/27 優先日 | |
| 2017 | 9/22 本件用法・用量追加承認 | 4/4 出願日 | 12/13 同追加承認 |
| 2018 | 2/2 特許登録 12/17【謹告】ラベプラゾールナトリウムの用法・用量に関する特許権について | ||
| 2019 | 4/15 本件特許無効審判請求 |
パリエット®の本件用法・用量追加承認申請(2016年10月28日)の翌日に本件特許に係る特許出願(優先日)が行われ、1年を待たずにその優先権を主張して出願、そして早期審査請求をして特許査定・登録を急いだが、本件特許は本件用法・用量追加承認を取得する(2017年9月22日)よりも前に登録することはできなかった(登録は2018年2月2日)。エーザイ・EAファーマは、2017年12月13日の沢井製薬の同追加承認の知らせに落胆したに違いない。パリエット®の本件用法・用量追加承認を取得する前に、本件特許を登録させ、パテントリンケージによる障壁を作り上げるために、もう少し早く出願しておくべきだったと考えられる。
パテントリンケージについては下記記事参照:



コメント
治験の登録については従来の課長通知での運用から、令和2年の薬機法施行規則改正で義務化されました。これに伴い、令和2年8月31日に「治験の実施状況等の登録について」が改正され、治験実施の透明性の確保及び国民の治験への参加の選択に資する事項の公表を目的に臨床試験情報登録センターの一本化や登録する情報の変更が行われました。
令和2年8月31日薬生薬審発0831第9号 厚生労働省医薬・生活衛生局医薬品審査管理課長 通知「治験の実施状況等の登録について」
参考:
【引用ありがとうございます】
宮崎 賢司 「進歩性判断において,主引用例を判断の起点とすることの容易性は必要か
~後知恵排除の一方向性は終焉を迎えるか~」 特許庁技術懇話会 特技懇 303号 2021.11.26
http://www.tokugikon.jp/gikonshi/303/303kiko3.pdf