Biogen ADUHELM Launch Jun 08, 2021より
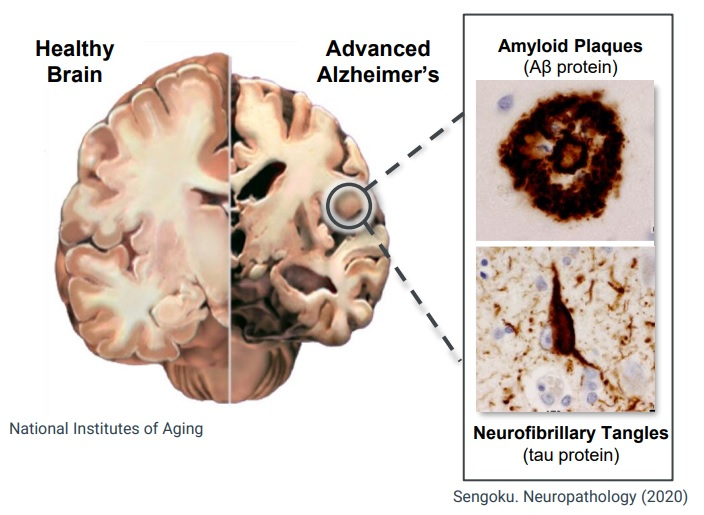
2021年6月7日(米国時間)、FDAは、ADUHELM™(一般名:アデュカヌマブ(aducanumab))を、患者のアミロイドβプラークの減少に基づき、アルツハイマー病(Alzheimer’s disease)治療薬として承認しました。
エーザイのプレスリリースによると、アデュカヌマブは、2007年にNeurimmune社から導入されたヒトモノクローナル抗体で、2017年10月より、バイオジェンとエーザイは全世界的にADUHELMの開発ならびに製品化を共同で実施しています。今回、FDAにより、今後検証試験による臨床的有用性を確認していくことを条件として、アルツハイマー病の治療を適応症として迅速承認されたとのことです。
参照:
- 2021.06.07 Biogen press release: A Letter from Biogen’s CEO on ADUHELM
- 2021.06.08 エーザイ press release: ADUHELM™(アデュカヌマブ) アルツハイマー病の病理に作用する初めてかつ唯一の治療薬として米国FDAより迅速承認を取得
- 2021.06.07 Neurimmune press release: FDA Approval of Aducanumab
- 2014.03.05 エーザイ/バイオジェン・アイデック・インク press release: エーザイ株式会社とバイオジェン・アイデック・インクがアルツハイマー型認知症治療剤に関する共同開発・共同販促契約を締結 -アルツハイマー型認知症の病態進行を抑制する薬剤創出力を強化-
アデュカヌマブ(aducanumab)という一般名が決定するまで使用されていた開発コードネームは「BIIB037」であることが知られています。そこで、特許出願の明細書中に「BIIB037」が記載され且つ「Biogen」が出願人である特許出願ファミリーをEspacenetを利用して検索した結果、以下のPCT出願ファミリーの存在がわかりました。
| No. | PCT Publication number | Title | Applicants | US status |
| 1 | WO2014089500A1 | A METHOD OF REDUCING BRAIN AMYLOID PLAQUES USING ANTI-Aß ANTIBODIES | ・BIOGEN IDEC INTERNAT NEUROSCIENCE GMBH | Abandoned |
| 2 | WO2015006475A1 | GENETIC AND IMAGE BIOMARKERS ASSOCIATED WITH DECLINE IN COGNITIVE MEASURES AND BRAIN GLUCOSE METABOLISM IN POPULATIONS WITH ALZHEIMER’S DISEASE OR THOSE SUSCEPTIBLE TO DEVELOPING ALZHEIMER’S DISEASE | ・BIOGEN IDEC INTERNAT NEUROSCIENCE GMBH | Abandoned |
| 3 | WO2015117033A2 | METHODS OF INCREASING PROTEIN PRODUCTION IN MAMMALIAN CELLS | ・BIOGEN MA INC | Abandoned |
| 4 | WO2016037082A1 | SYSTEMS AND METHODS FOR ASSESSING THERAPEUTIC PROTEINS | ・BIOGEN MA INC | Abandoned |
| 5 | WO2016087944A2 | METHOD FOR TREATING ALZHEIMER’S DISEASE | ・BIOGEN INTERNAT NEUROSCIENCE GMBH | US10,842,871B2 |
| 6 | WO2017079637A1 | CONJUGATION METHODS FOR MODIFYING OR IMMOBILIZING PROTEINS | ・BIOGEN MA INC | Abandoned |
| 7 | WO2017211827A1 | METHODS FOR TREATING ALZHEIMER’S DISEASE | ・BIOGEN INT NEUROSCIENCE GMBH | US 2020-0308259 A1 Non Final Action Mailed |
| 8 | WO2018023036A1 | METHODS OF TREATING OR PREVENTING AMYLOID RELATED IMAGING ABNORMALITIES ASSOCIATED WITH ALZHEIMER’S DISEASE TREATMENT | ・BIOGEN CHESAPEAKE LLC | US 2019-0167611 A1 Non Final Action Mailed |
| 9 | WO2019040612A1 | PHARMACEUTICAL COMPOSITIONS CONTAINING ANTI-BETA AMYLOID ANTIBODIES | ・BIOGEN MA INC | – |
| 10 | WO2021081101A1 | ANTI-BETA-AMYLOID ANTIBODY FOR TREATING ALZHEIMER’S DISEASE | ・BIOGEN MA INC ・NEURIMMUNE AG | – |
例えば、上表の最先(No.1)のPCT出願(WO2014089500)について、PatentScopeやPublic PAIR中のdocumentから、Biogen社が出願した後にNeurimmune社を共同出願人とする手続がなされた形跡がありますが、PCTから移行したいずれの国でも成立することなく放棄されているようです。その他、No. 2、3、4及び6の各ファミリー米国出願は成立することなく放棄されています。No.7及び8はUSPTOで審査中の状況であり、No.9及び10は未だ米国への出願情報はありません。
・・・ということは、残るNo.5の米国特許10,842,871が、アデュカヌマブ(aducanumab)を保護する大本命の特許なのでしょうか(もちろん、上記検索で拾いきれていない特許がかなりあるとも思われますが。)。この特許権は、出願日が2015年であり、存続期間はまだ十分あることになります。
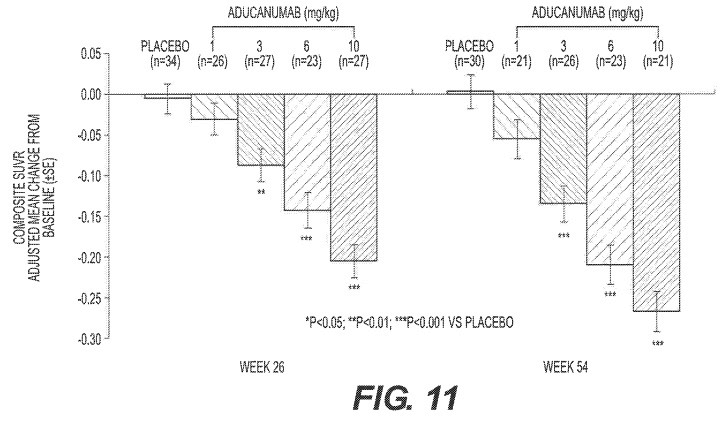
Claim 1. A method for treating Alzheimer’s disease in a human patient in need thereof, comprising: sequentially administering multiple doses of a recombinant, fully human, anti-amyloid beta monoclonal antibody in increasing amounts over a period of time to the human patient, wherein multiple doses of 1 mg antibody/kg of body weight of the human patient are administered to the human patient at intervals of about 4 weeks, multiple doses of 3 mg antibody/kg of body weight of the human patient are administered to the human patient at intervals of about 4 weeks, multiple doses of 6 mg antibody/kg of body weight of the human patient are administered to the human patient at intervals of about 4 weeks, and multiple doses of 10 mg antibody/kg of body weight of the human patient are administered to the human patient at intervals of about 4 weeks, wherein the antibody comprises a heavy chain variable region (VH) and a light chain variable region (VL), wherein the VH comprises a complementarity determining region1 (VHCDR1) with the amino acid sequence set forth in SEQ ID NO:3, a VHCDR2 with the amino acid sequence set forth in SEQ ID NO:4, and a VHCDR3 with the amino acid sequence set forth in SEQ ID NO:5, and wherein the VL comprises a VLCDR1 with the amino acid sequence set forth in SEQ ID NO:6, a VLCDR2 with the amino acid sequence set forth in SEQ ID NO:7, and a VLCDR3 with the amino acid sequence set forth in SEQ ID NO:8.
Purple Bookが稼働すれば、ADUHELM™(aducanumab)を保護する米国特許が明示される時がくるかもしれません(オレンジブック・パープルブックに関連する法改正)。



コメント
2024.01.31 Biogen news release: Biogen to Realign Resources for Alzheimer’s Disease Franchise
https://investors.biogen.com/news-releases/news-release-details/biogen-realign-resources-alzheimers-disease-franchise
Biogen社は、ADUHELM®(一般名:aducanumab-avwa)静注100mg/mLの開発および商業化を中止すると発表した。2023年1月、バイオジェンは、ADUHELMに関する提携先候補や外部資金調達の可能性を模索するなど、研究開発活動の戦略的見直しを開始していたが、潜在的な戦略的パートナーや外部資金を特定することができなかた。Biogen社はNeurimmune社からaducanumabのライセンスを受けていたが、このライセンスを終了した。aducanumabの権利はNeurimmune社に戻る。