Summary
- 乳癌治療剤フェソロデックス®筋注250mg(一般名:フルベストラント)の製剤発明に関連するアストラゼネカの特許第3713237号を巡る無効請求不成立審決の取消訴訟で、知財高裁は、原告(サンド)の主張(新規性欠如、進歩性欠如、実施可能要件違反、サポート要件違反)をいずれも認めず、原告の請求を棄却する判決を下した。
- 知財高裁は、特に進歩性の判断において、先行文献(甲1)には本件訂正発明1と同様のフルベストラント製剤の組成物が記載されていることを認めつつ、その内容がフルベストラントを作用機序検証のための試験用組成物としてマウスに皮下投与したものであるに過ぎない点を重視した。そのため、この組成物を、乳癌治療のためにヒトに筋肉内投与するフルベストラント(先行文献甲4)に用いる動機付けがあるとは言えないと判断し、進歩性を肯定した審決を支持した。
- 欧米においても、同じ先行文献を基に特許性が争われたが、アストラゼネカが必ずしも勝訴したわけではない。本件特許の出願前に甲1著者にフルベストラント製剤を提供したのはアストラゼネカであり、その製剤を用いた研究成果の公表が、本件発明の特許性に疑義を生じさせる原因となった。この事例は、社内の情報共有体制の重要性を再認識する必要性を示しているとも言える。
1.背景
本件訴訟(知財高裁令和5年(行ケ)10090)は、発明の名称を「フルベストラント製剤」とする発明に関するアストラゼネカ(AstraZeneca:被告)の特許第3713237号(本件特許)に対してサンド(Sandoz:原告)がした無効審判請求(無効2021-800025号事件)について、本件訂正を認めた上で請求項18ないし34に係る発明(本件各訂正発明)についての請求は成り立たないとした審決の取消訴訟である。
サンド(原告)が主張した取消事由は、①甲1(Clinical Cancer Research, 1998, Vol.4, pp.687-711)発明に対する新規性、②甲1発明に対する進歩性、③甲4(British Journal of Cancer, 1996, Vol.74, pp.300-308)発明に対する進歩性、④実施可能要件違反及び⑤サポート要件違反の有無に関する判断の誤りである。
本件特許に係る本件訂正後の特許請求の範囲のうち、請求項1、18及び29は、以下のとおりである。
【請求項1】(訂正発明1)
筋肉内注射によりヒトに投与するための医薬製剤であって、少なくとも45mg/mlのフルベストラント、製剤の容積当たり30重量%以下の医薬的に許容できるアルコール類、製剤の容積当たり少なくとも1重量%の安息香酸ベンジル、および少なくとも45mg/mlのフルベストラントの製剤を調製するのに十分な量のヒマシ油を含む、筋肉内注射に適する医薬製剤。
【請求項18】(訂正発明18)
筋肉内注射によりヒトに投与するための医薬製剤であって、少なくとも45mg/mlのフルベストラント、製剤の容積当たり15~25重量%の医薬的に許容できるアルコール類、製剤の容積当たり10~25重量%の、ヒマシ油中の安息香酸ベンジル、および少なくとも45mg/mlのフルベストラントの製剤を調製するのに十分な量のヒマシ油を含み、医薬的に許容できるアルコール類がエタノールおよびベンジルアルコールの混合物であり、エタノールおよびベンジルアルコールが製剤の容積当たりほぼ等しい重量%で存在する、筋肉内注射に適する医薬製剤。
【請求項29】(訂正発明29)
筋肉内注射によりヒトに投与するための医薬製剤であって、少なくとも45mg/mlのフルベストラント、製剤の容積当たり17~23重量%の医薬的に許容できるアルコール類、製剤の容積当たり12~18重量%の安息香酸ベンジル、を含み、医薬的に許容できるアルコール類がエタノールとベンジルアルコールの混合物であり、製剤の容積当たり10重量%のエタノール、製剤の容積当たり10重量%のベンジルアルコール、製剤の容積当たり15重量%の安息香酸ベンジル、および少なくとも45mg/mlのフルベストラントの製剤を調製するのに十分な量のヒマシ油を含み、筋肉内注射に適する医薬製剤。
フルベストラント(fulvestrant)は、アストラゼネカ株式会社が製造販売している乳癌治療剤「フェソロデックス®筋注250mg」の有効成分であり、英国ICI社(現、アストラゼネカ)にて創製されたステロイド性抗エストロゲン剤である。欧米では「FASLODEX® injection」の製品名で販売されている。
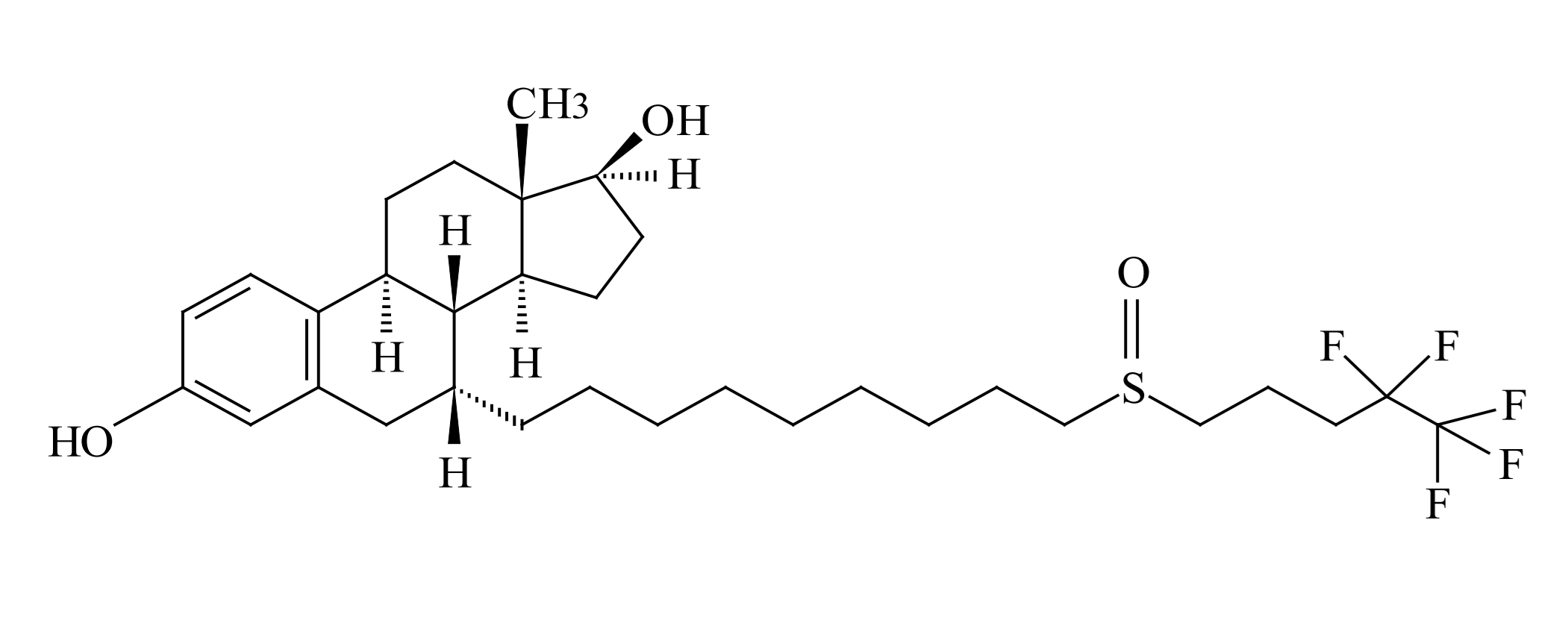
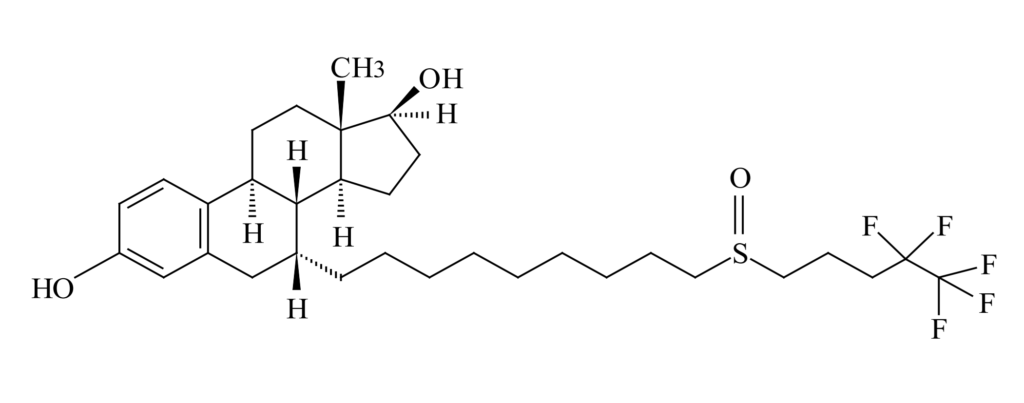 本件特許の明細書の記載によれば、フルベストラントを油性溶剤であるヒマシ油のみに溶解して低容積の注射で患者に投与するのに十分な高濃度を達成しかつ療法的に有意の放出速度を達成するのは困難であったところ、本発明者らは、ヒマシ油及びアルコール類に混和性である非水性エステル系溶剤の導入によりフルベストラントを少なくとも50mg/mlの濃度に可溶化できることを見出し、本発明の製剤が筋肉内注射後、長期間にわたって十分なフルベストラントを放出することを見出したとある。
本件特許の明細書の記載によれば、フルベストラントを油性溶剤であるヒマシ油のみに溶解して低容積の注射で患者に投与するのに十分な高濃度を達成しかつ療法的に有意の放出速度を達成するのは困難であったところ、本発明者らは、ヒマシ油及びアルコール類に混和性である非水性エステル系溶剤の導入によりフルベストラントを少なくとも50mg/mlの濃度に可溶化できることを見出し、本発明の製剤が筋肉内注射後、長期間にわたって十分なフルベストラントを放出することを見出したとある。
フルベストラントを有効成分とする「フェソロデックス®筋注250mg」は、2011年9月26日に効能又は効果を「閉経後乳癌」として製造販売承認を取得し、その後一部変更承認(2017年9月27日)により、効能又は効果を「閉経後乳癌」から「乳癌」に変更している。注射剤であり、ガラス製シリンジ1筒(5mL)中に、有効成分(活性成分)としてフルベストラント250mgを含有し、添加物として、エタノール500mg、ベンジルアルコール500mg、安息香酸ベンジル750mg、及びヒマシ油適量を含有する。
本件特許については、同剤の承認に基づいて特許権の存続期間の延長登録がなされていることから(特願2011-700291号及び特願2017-700432号)、本件特許は、「フェソロデックス®筋注250mg」を保護するものである。
2.裁判所の判断
知的財産高等裁判所 第3部(以下「裁判所」)は、サンド(原告)が主張する取消事由(新規性欠如、進歩性欠如、実施可能要件違反、サポート要件違反)にはいずれも理由がなく、本件審決のうち請求項18ないし34に係る部分について、これを取り消すべき違法はないとして、原告の請求は棄却されるべきであると判決した。
(1)甲1発明に対する新規性・進歩性(取消事由1及び2)
甲1(Clinical Cancer Research, 1998, Vol.4, pp.687-711)には、フルベストラントと同一の化合物である「ICI 182,780」を含む10%エタノール、10%ベンジルアルコール、及び15%安息香酸ベンジルの、ヒマシ油で容量調整した媒体中、ICI 182,780が50mg/mlとなるように予備製剤化した組成物を、乳癌モデルマウスに皮下投与した試験が記載されていた。
裁判所は、訂正発明1と甲1発明とは、
「少なくとも45mg/mlのフルベストラント、製剤の容積当たり30重量%以下の医薬的に許容できるアルコール類、製剤の容積当たり少なくとも1重量%の安息香酸ベンジル、および少なくとも45mg/mlのフルベストラントの製剤を調製するのに十分な量のヒマシ油を含む、製剤。」
で一致していることを認めつつ、
少なくとも相違点1:
訂正発明1は、「筋肉内注射によりヒトに投与するための医薬製剤であって、」「筋肉内注射に適する医薬製剤」であるのに対し、
甲1発明は、「線維芽細胞成長因子(FGF)をトランスフェクトした乳癌細胞(MCF-7細胞)を注入された卵巣切除担癌マウスに対し皮下投与される、タモキシフェン抵抗性の乳癌の機序としてFGFオートクリン活性を検証するための試験用組成物である点
は実質的な相違点であり、訂正発明1は甲1発明とは異なる発明であって新規性を有するものであると認められると判断し、また、甲1に記載された発明に基づき、他の文献に記載された事項、周知技術又は技術常識を考慮して、当業者が容易に訂正発明1をすることができたものではないとした本件審決は相当であると判断した。
したがって、裁判所は、本件各訂正発明についても、訂正発明1と同様に、相違点1に係る訂正発明1の構成を有する又は相違点1を更に特定した発明特定事項を有するから、当業者が容易に発明をすることができたものではないとした本件審決の判断は相当であると判断した。
原告は、技術常識が存在し、これらの技術常識又は技術水準が、訂正発明1が甲1発明に対する進歩性を欠くことの根拠となる旨主張したが、裁判所は、原告主張の技術常識が存在すると認めることはできず、また、仮にある程度の技術常識が存在したとしても、訂正発明1に至る動機付けがあったとは認められないと判断した。例えば、以下のように説示した。
「フルベストラントを含有する医薬製剤は、本件優先日当時、臨床試験中であったのであって、いずれの国においてもいまだ承認されていなかったから(乙1、9)、フルベストラントが乳がん治療薬として確立していたとは認められない。したがって、技術常識Ⅰ(フルベストラントの筋肉内注射関係)が存在したとは認められない。
もっとも、本件優先日当時実施されていたフルベストラントに関する薬物動態の試験(PK試験)及び臨床試験の結果(甲4~6)によれば、本件優先日当時、フルベストラントが、乳がん治療薬として使用される可能性があるものとして治験中であり、治験においては筋肉内注射により投与されていることが技術常識であったという余地はある。
しかし、このような技術常識があるとしても、甲1の文献において抗エストロゲン薬としてマウスに投与された組成物を、その組成のまま、直ちにヒトに対して筋肉内注射により投与する医薬製剤として用いることができると、当業者が容易に認識するとは認められない。」
(2)甲4発明に対する進歩性(取消事由3)
裁判所は、訂正発明1と甲4(British Journal of Cancer, 1996, Vol.74, pp.300-308)発明とは、少なくとも相違点2:
訂正発明1は、「製剤の容積当たり30重量%以下の医薬的に許容できるアルコール類、製剤の容積当たり少なくとも1重量%の安息香酸ベンジル」を含むのに対し、
甲4発明は、そのような特定がない点
において相違しており、また、フルベストラント製剤の共溶媒の配合割合には技術的意義があると認められ、その配合割合は設計的事項にとどまるとはいえないことから、甲4に記載された発明に基づき、当業者が容易に訂正発明1をすることができたものではないと判断した本件審決は相当であると判断した。
したがって、裁判所は、本件各訂正発明についても、訂正発明1と同様に、相違点2に係る訂正発明1の構成を有する又は相違点2を更に特定した発明特定事項を有するから、当業者が容易に発明をすることができたものではないとした本件審決の判断は相当であると判断した。
(3)実施可能要件・サポート要件(取消事由4及び5)
裁判所は、実施可能要件違反もサポート要件違反も認められないと判断した。
3.コメント
本件では、新規性や進歩性の引用文献として、甲1と甲4が問題となった。
甲4には、進行乳癌を治療するためにフルベストラントを筋肉内投与し、その長期有効性と毒性に関する臨床試験の成功データが記載されていたが、具体的な製剤処方までは特定されていなかった。一方、甲1には、訂正発明1と同様のフルベストラント製剤の組成物が記載されていたが、動物実験において乳癌の機序を検証するための試験用組成物として用いられていたに過ぎなかった。
乳癌を治療するためにフルベストラントを筋肉内投与した結果を記載している甲4と、フルベストラントを含有する具体的組成物を記載している甲1を組み合わせたら、訂正発明1となるわけであるが、これらを組み合わせる動機付けの有無が判断の分かれ目になったといえる。
裁判所は、甲1ではフルベストラントが作用機序検証のための試験用組成物としてマウスに皮下投与されているに過ぎないことから、この組成物を、甲4のように乳癌を治療するためにヒトに対して筋肉内投与するフルベストラントに用いる動機付けがあるとは認められないとして、訂正発明1の構成を有するものとすることを当業者が容易に発明することはできないと判断した審決を支持した。
しかし、以下に紹介するとおり、必ずしも欧米では、アストラゼネカ(特許権者)が本件特許の有効性を勝ち取ったわけではなさそうだ。
なお、PMDAウェブサイトにて公開されているフェソロデックス®に関する申請資料概要資料「起原又は発見の経緯及び開発の経緯」(アストラゼネカ株式会社)の以下の記載からも、フルベストラントを筋肉内投与製剤として開発した理由がうかがえる。
「一方、筋肉内投与経路では、初回通過効果を回避し、高いバイオアベイラビリティを得ることが可能である。また、筋肉内投与の場合、使用する製剤成分を種々検討することにより、投与部位からの薬物の放出を調製することも可能であり、全身クリアランスが大きな薬物の全身暴露を長期間維持することも比較的容易であると考えられた。以上から、乳癌治療における効果、忍容性及び簡便性も考慮し、長時間作用性の筋肉内投与製剤を開発した。」
(1)欧米での特許性
フルベストラントの製剤特許と後発医薬品参入を巡って、アストラゼネカとサンドはグローバルで紛争となった。
ア 欧州
欧州では本件特許ファミリーとして、①EP1250138、②EP2266573、③EP2286818が特許となった。
①EP1250138は、欧州特許庁(EPO)において、異議申立てが提出され、さらに審判部での審理を経て(T0336/09)、異議部に差し戻されたが、最終的には特許維持の判断が下された。
しかし、その後、例えば、ドイツでは、連邦特許裁判所(Federal Patent Court of Germany)により特許を無効とする決定が下された(Case No.: 3 Ni 17/15 (EP)、2017年1月12日発行)。
注目すべきは、EPO審判部が異議部に考慮するよう命じたのと全く同じ先行技術、すなわち、本件で問題となった甲1(NIK10)及び甲4(NIK16)が、ドイツでは連邦特許裁判所での手続きに決定的な影響を与えたことである。
この判決に対して、アストラゼネカは、以下のクレームの予備的請求を提出するとともに上訴した。
Claims 1. Use of fulvestrant in the manufacture of a pharmaceutical formulation for the treatment of breast cancer by intramuscular administration to a human in need of such treatment, said formulation comprising dissolved fulvestrant, 10 weight percent ethanol, based on the volume of the formulation, 10 weight percent benzyl alcohol based on the volume of the formulation, 15 weight percent benzyl benzoate based on the volume of the formulation, and a sufficient amount of castor oil to produce a formulation containing at least 45 mgml-1 fulvestrant.
2. the use as claimed in claim 1, wherein the total amount of fulvestrant in the formulation is 250 mg and the total volume of the formulation is 5 ml.
しかし、ドイツ連邦裁判所(Federal Court of Justice)は、2019年4月16日、原審の判断を支持し、当業者は、甲4(NiK16)と甲1(NiK10)に基づいて、何らの進歩性もなく、クレーム1の主題に到達することができたと判断し、アストラゼネカの訴えを退ける判決を下した(Case No.: X ZR 59/17)。
このように、ドイツと日本で、全く同じ先行文献(甲1及び甲4)に基づく進歩性の判断に違いが生じたことは興味深い。
②EP2266573も、EPOにおいて、異議申立てが提出され特許取消しの決定が下されたが、審判を経て、2019年3月に特許維持決定が下された。ドイツでは、無効訴訟は提起されず、この特許権は予定どおり20年の存続期間を経て2021年1月8日に満了した。しかし、アストラゼネカのAnnual report 2018-2019(Form 20-F)によると、フランス、イタリア、スペインでは特許無効が争われたようである。
③EP2286818は、審査中にThird-party observationにより甲1(先行文献D9)が提出されたが、2020年3月に登録に至った。EPOにおいて異議申立ては提出されなかった。ドイツでは、無効訴訟は提起されず、この特許権は予定どおり20年の存続期間を経て2021年1月8日に満了した。
イ 米国
米国では、フルベストラントを有効成分として含有するFASLODEX® injectionの後発医薬品についてサンドがした簡略新薬承認申請(ANDA)に対して、2014年6月、アストラゼネカは、ニュージャージー州連邦地方裁判所に特許権侵害訴訟(AstraZeneca. v. Sandoz et al. Case No. 1:14-cv-03547-RMB-KMW(D.N.J.))を提起した。
争われた対象特許は、本件特許の米国特許ファミリーであるUS6,774,122、US7,456,160、US8,329,680、US8,466,139であった(いずれの特許権も存続期間満了日は小児延長も含めて2021年7月9日)。
当該訴訟は、2016年に和解に至ったため終結し、和解契約に従い、2019年になってからサンドは後発医薬品の販売を開始している。
- 2016.07.13 AstraZeneca press release: AstraZeneca enters into agreement to resolve Faslodex patent litigation in the US
FASLODEX®は、2018年に初めてグローバルでの売上が10億ドルを超え、ブロックバスターの仲間入りを果たしたが、その1年後、米国で初めての後発医薬品の市場参入を受け、その売上げを落とすこととなった。
(2)出願前の製剤提供が招いた特許性への疑義
甲1において、フルベストラント(fulvestrant)と同一の化合物である“ICI 182,780”を含む製剤が乳癌の機序を検証するための試験用組成物として用いられている点は注目に値する。
実は、この製剤を同論文の著者であるGeorgetown University Medical Centerの研究者らに提供したのが特許権者であるアストラゼネカであったという事実は、本件特許及びその欧米ファミリー特許の有効性を判断する背景を考察するうえで重要な意味を持つのではないだろうか。
本件特許第3713237号の優先日が2000年1月10日である一方で、甲1に該当する論文の発表は1998年3月1日に行われている。この時間的な経緯を踏まえると、アストラゼネカが本件発明を出願する可能性を認識していたのであれば、特許性に影響するリスク回避の観点から論文発表に先んじて出願手続きを行うべきであったとの指摘は妥当と思われる。
しかしながら、同社が本件発明の製剤を出願前に社外の研究者に提供し、さらには論文発表を許可した背景には、以下のような複数の可能性が考えられる。
- 出願の意図が存在しなかった可能性:出願の時点では、本件発明を特許出願することを計画していなかった可能性がある。この場合、当時の研究活動の重点は科学的成果の共有や学術的評価の獲得に置かれていたと考えられるだろう。
- 特許性に影響しないとの判断:アストラゼネカは、甲1に記載された内容が本件発明の特許性に致命的な影響を及ぼさないと考え、公開を進めた可能性がある。
- 特許保護期間の最大化を優先した判断:アストラゼネカは、甲1の公表が特許性に影響するリスクよりも、可能な限り製品保護期間を最大化するベネフィットに価値があると考え、公表後に出願することを選んだのかもしれない。
- 情報共有における内部的なミス:知財部門と研究開発部門の間で適切な情報共有が行われていなかった可能性も否定できない。作用機序検証のための試験用組成物の提供から、その組成物の具体的な製剤組成まで論文に記載されてしまった点まで目が行き届いていなかった可能性がある。この場合、論文発表が特許戦略に及ぼす潜在的な影響が十分に評価されなかった結果、現状のような状況が生じたと考えられる。
日本以外の主要国においても甲1(および甲4)が無効理由の根拠として既に争点となっていた点を考えると、これらの文献が特許の有効性に影響を及ぼす可能性が広く認識されていたことが伺える。しかし、日本では、アストラゼネカ(特許権者)が本件特許の有効性を何とか確保する判決を得るに至った。
以上を踏まえ、本件特許に関するこのようなアカデミアへの開発製剤提供の目的や時間的背景を考慮すると、特許出願戦略と研究活動のバランス、ならびに社内の情報共有体制の在り方について、より深い注意が求められるといえるだろう。
(3)日本におけるフルベストラント製剤の後発医薬品開発の障壁
本件特許第3713237号については、フェソロデックス®に関して特許権の存続期間延長登録が2件、具体的には、「閉経後乳癌」の承認に基づいて5年(存続期間満了日は2026年1月8日)(特願2011-700291)及び「閉経前乳癌」の効能追加承認(効能又は効果を「閉経後乳癌」から「乳癌」とする一部変更承認)に基づいて4年1月26日(特願2017-700432)の存続期間の延長をそれぞれ獲得している。
また、フェソロデックス®については、本件特許以外にも、2つの特許権(分割出願の親子)について計3件の存続期間延長登録(最長で存続期間満了日は2025年12月5日)が存在する。いずれも製造方法に関するものであり、フルベストラントを製造するにあたり回避することのできない発明を保護する特許権なのかどうか、すなわち後発医薬品の参入障壁として有効に働いているのかどうかは不明である。現時点において、これら特許に対する無効審判は請求されていない。
- 特許4363846号に係る特許権存続期間延長登録:①「閉経後乳癌」の承認に基づいて2年28日(特願2017-700433)及び②「閉経前乳癌」の効能追加承認に基づいて4年1月26日(存続期間満了日は2025年12月5日)(特願2011-700292)の存続期間延長
- 特許5133937号に係る特許権存続期間延長登録:③「閉経前乳癌」の効能追加承認に基づいて4年1月26日(存続期間満了日は2025年12月5日)(特願2017-700434)の存続期間延長
サンドが本件訴訟を提起してきたことは、少なくとも本件特許第3713237号がフェソロデックス®の後発医薬品の参入障壁として立ちはだかっていると想像できる。
しかし、本件特許に対して無効審判を請求したのはサンドのみであり、サンファーマ株式会社がサンド側として当該無効審判に参加したものの(審決の予告前に参加を取下げ)、本件特許に対する内資系後発医薬品メーカーの動きは消極的である。
欧米では既にフェソロデックス®(FASLODEX®)の後発医薬品は承認され、特に米国では2019年から販売されているが、日本では2023年2月に大原薬品工業株式会社が後発医薬品「フルベストラント筋注250mgシリンジ『オーハラ』」の承認を取得したものの未だに薬価収載・販売には至っていない。
その理由は、本件特許の存在だけでなく、日本における製造原価に見合わない予想薬価、すなわち利益確保の困難性、にも大きな理由がありそうだ。
フルベストラントを有効成分とするフェソロデックス®の後発医薬品は、開発に際して、臨床試験費用が高額であり、またホルモン様の原薬を含む油性無菌注射製剤であるため専用製造設備が必要であり、製造原価も高いにも関わらず、予想薬価は、通常の抗がん剤よりも約1/3と大幅に安いことが想定されるため、利益確保が難しく、後発医薬品の参入は困難である、と日本エスタブリッシュ医薬品研究協議会は「後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会」で説明している。
参考:
- 2023.12.25 第7回 後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会(https://www.mhlw.go.jp/stf/newpage_37039.html) : 資料2-3 日本エスタブリッシュ医薬品研究協議会 「ジェネリックドラッグ・ロスの解消について ~複雑なジェネリック医薬品に関する考察~」 https://www.mhlw.go.jp/content/10807000/001181726.pdf
- 2023.12.05 日本エスタブリッシュ医薬品研究協議会 「ジェネリックドラッグ・ロスの解消とドラッグ・リポジショニングについて ~複雑なジェネリック医薬品とドラッグ・リポジショニングに関する考察~」https://www.establish.jp/activity/pdf/231205_2.pdf


コメント