1.はじめに
抗PCSK9抗体に関する特許権(特許第5705288号及び第5906333号)を有するアムジェンが抗PCSK9抗体製剤プラルエント®を販売するサノフィを特許権侵害で提訴した前訴判決では、アムジェンが勝訴し、販売差止めを命じる同判決は確定していた。本件(東京地裁令和2年(ワ)8642)は、アムジェンが、サノフィに対し、同侵害行為に基づく損害賠償の支払を求めた事案である。
アムジェンとサノフィの抗PCSK9抗体製剤を巡るグローバルな特許紛争が同時進行するなか、日本における関連事件は、本件特許の無効審判請求事件も含めて紆余曲折の経緯を辿っている。
本記事では、これまでの経緯をおさらいし、前訴判決から一転してアムジェン敗訴とした本件東京地裁判決を紹介する。
本件発明を構成要件に分節すると以下のとおりであり、プラルエント®(被告製品)は全ての構成要件を充足する。
B PCSK9との結合に関して、21B12抗体又は31H4抗体(併せて「参照抗体」という)と競合する、
C 単離されたモノクローナル抗体
D を含む、医薬組成物。
本件は、機能的に表現された抗体(を含む医薬組成物)クレームの実施可能要件及びサポート要件がどのように判断さたのかが注目点であるが、グローバルな特許紛争のなかで新たに取得された証拠が前訴判決を覆す一因となったという点で、社内文書管理の重要性の観点でも学びのある事案である。
※本記事では、原告側及び被告側について、親会社及び子会社を区別せずにアムジェン又はサノフィと略す。
2.経緯
(1)プラルエント®(被告製品)の製造販売承認の取得等
サノフィは、ヒトプロタンパク質転換酵素サブチリシン/ケキシン9型(PCSK9)に対する遺伝子組換えヒトIgG1モノクローナル抗体であるアリロクマブ(alirocumab)を有効成分とするヒト抗PCSK9抗体製剤プラルエント®(被告製品)について、2016年7月4日付けで医薬品製造販売承認を取得し、遅くとも同年9月5日より輸入し、販売し、販売の申出をした。
抗PCSK9抗体製剤として、アムジェンはレパーサ®(英語名: Repatha®)皮下注を、サノフィはプラルエント®(英語名: Praluent®)皮下注を製造販売しており、両社はグローバルにおいても抗PCSK9抗体製剤について競合関係にある。
(2)前訴・特許権侵害差止請求事件(サノフィの敗訴)
アムジェン(原告)は、2017年に、サノフィ(被告)に対し、本件特許権に基づきプラルエント®(被告製品)の販売の差止めを求める訴訟(東京地裁平成29年(ワ)第16468号特許権侵害差止請求事件。以下「前訴」という)を提起した。これについて、東京地裁は、2019年1月17日、サノフィに対し、プラルエント®の販売の差止めを命じる判決を言い渡した。
これに対してサノフィが控訴したところ(知財高裁平成31年(ネ)第10014号特許権侵害差止請求控訴事件)、知財高裁は、2019年10月30日、サノフィの控訴を棄却した。

これに対するサノフィの上告受理申立事件につき、2020年4月24日、最高裁が上告不受理決定をしたことにより、東京地裁の上記判決は確定した。
(3)サノフィによる本件特許の無効請求(サノフィの敗訴)
サノフィは、本件特許の無効請求不成立審決につき、審判請求は成り立たないとした部分の取消しを求める訴訟(知財高裁平成29年(行ケ)第10225号審決取消請求事件及び同第10226号審決取消請求事件。以下、これらを併せて「別件審決取消訴訟」という)を提起した。
しかし、知財高裁は、2018年12月27日、サノフィが主張する取消事由(進歩性の判断の誤り、サポート要件の判断の誤り、実施可能要件の判断の誤り)の存在を否定し、サノフィの請求をいずれも棄却する判決を言い渡した。


サノフィは、同判決を不服として上告受理申立てをしたが、最高裁は、2020年4月24日、上告不受理決定をし、同判決は確定した。
(4)サノフィがプラルエント®の日本撤退を発表
サノフィは、最高裁により上記決定がなされことを受け、プラルエント®の販売が差し止められ、国内において、今後プラルエント®を販売できなくなったとして、2020年5月7日、プラルエント®を日本において販売停止すると発表した。
- 2020.05.08 ブログ記事参照: サノフィがプラルエント®の販売停止発表 アムジェンとの特許侵害訴訟で最高裁上告棄却決定受け

アムジェンもそのウェブサイトでコメントを発信した。
- 2020.05.08 Amgen Perspectives : PCSK9特許侵害訴訟の最高裁決定について
(5)リジェネロンによる本件特許の無効請求(アムジェンの敗訴)
リジェネロン・ファーマシューティカルズ・インコーポレイテッド(以下「リジェネロン」)は、2020年2月12日、本件特許について特許無効審判(無効2020-800011号及び無効2020-800012号)を請求した。
プラルエント®の有効成分であるアリロクマブ(alirocumab)を創製し、サノフィと共同でプラルエント®を開発したのがリジェネロンであった。
特許庁は、2021年4月7日、上記各事件につき、いずれも、無効審判請求は成り立たない旨の審決をした。
これに対し、リジェネロンは、上記各審決の取消しを求める訴訟(知財高裁令和3年(行ケ)第10093号審決取消請求事件及び同第10094号審決取消請求事件)を提起した。
これについて、知財高裁は、2023年1月26日、本件発明はいずれもサポート要件に適合するものとは認められないとして、サノフィとの「別件審決取消訴訟」でアムジェン勝訴とした判決から一転して、上記各審決につき、それぞれ、審決を取り消す旨の判決(アムジェン敗訴)を言い渡した。
- ブログ記事参照: 2023.01.26 「リジェネロン v. アムジェン」 知財高裁令和3年(行ケ)10093 ―「参照抗体と競合する」抗体クレームのサポート要件充足性と発明特定事項の意義―(『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p53-84)
アムジェンは、同判決を不服として上告受理申立てをしたが、最高裁は、上告不受理決定をし、審決の取消しの判決が確定した。現在、同審判事件(無効2020-800011号及び無効2020-800012号)の審理が特許庁で再開されている。
(6)本訴・特許権侵害損害賠償請求事件
アムジェンは、2020年3月31日、プラルエント®(被告製品)の販売等は本件特許権をいずれも侵害する行為であると主張して、サノフィに対し、損害賠償の支払を求めて本件訴訟を東京地裁に提起した。
それと前後する形で、リジェネロンから本件特許に対する無効審判の請求はあったものの、サノフィとの「前訴」及び「別件審決取消訴訟」によるアムジェン勝訴は確定し、サノフィがプラルエント®を日本において販売停止するとの発表もあり、その時点では、まさか、2年半以上後の2023年1月26日、リジェネロンとの審決取消訴訟で、一転、アムジェン敗訴になろうとは(前述のとおり)・・・アムジェンは予想していなかったかもしれない。
本件において、東京地裁は、リジェネロンによる審決取消訴訟の知財高裁判決を待っていたのだろうか、実施可能要件違反及びサポート要件違反の無効理由を有することを理由としてアムジェン敗訴という結論を下した。
(7)海外での特許紛争
ここで、本件特許の米欧ファミリー特許は現時点でどのように判断されているのかについても紹介する。
アムジェンの米欧の特許クレームは、日本ファミリーの本件特許のような「参照抗体と競合する」という発明特定事項をもつクレームではなく、その抗体を、(a)PCSK9の特定のアミノ酸残基(エピトープ)に結合する及び(b)PCSK9とLDLRの結合をブロック又は抑制するという構成により、機能的に表現するものであった。
米国では、2023年5月18日、米国最高裁判所は、全会一致の意見として、アムジェンの抗PCSK9抗体に関する米国特許8,829,165及び8,859,741は実施可能要件を満たさないから無効であるとした米国連邦巡回区控訴裁判所(CAFC)の判決を支持した。
- ブログ記事参照: 【速報】2023.05.18 「Amgen v. Sanofi」 米国最高裁No. 21–757 - Amgenの抗PCSK9抗体特許 実施可能要件非充足を理由に無効としたCAFC判決を米国最高裁も支持 -(『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p180-182)

欧州では、2024年7月16日、欧州統一特許裁判所(Unified Patent Court、以下「UPC」)の中央部(ミュンヘン支部)は、アムジェンの特許EP3666797B1は進歩性を欠くとして無効との判決を下した。この決定を受けて、UPCミュンヘン支部で並行して審理されている同特許に基づく侵害訴訟(ACT_459916/2023)がどのように進展するか注目されている。
米国と同じ無効という結論に至ったものの、その理由は、米国では実施可能性を満たさないと判断されたのに対し、UPCでは進歩性を欠くと判断されたという点に注目すべきかもしれない。
機能的に表現された抗体クレームによる特許を取得したい出願人にとって、米国では実施可能要件を満たすために当業者の技術常識に基づいて過度な負担なくクレームに包含されるそれら抗体を取得できると主張することが、欧州UPCでは、先行文献に基づいて過度な負担なくクレームに包含されるそれら抗体を取得できる、すなわち、自ら進歩性を否定することを認めているかのような、特許性主張のジレンマに陥る可能性がある。
米国でも欧州(UPC)でも、機能的に表現された抗体クレームが実施可能要件又は進歩性のいずれもクリアすることは非常に困難といえそうだが、それでも特許取得にチャレンジする出願人は、米国と欧州(UPC)で特許性の主張の力点を使い分ける戦術が必要だろう。
3.裁判所の判断
東京地方裁判所民事第47部(以下、「裁判所」と略す)は、以下(1)~(3)によれば、その余の争点について判断するまでもなく、アムジェン(原告)は、サノフィ(被告)に対し、本件特許権侵害の不法行為に基づく損害賠償請求権を有しないと判断し、アムジェンの請求は理由がないから棄却することとして、主文のとおり判決した。
1 原告の請求を棄却する。
2 訴訟費用は原告の負担とする。
3 この判決に対する控訴のための付加期間を 30 日と定める。
(1)サポート要件違反及び実施可能要件違反の有無
裁判所は、以下のとおり認定した。
- 「EGFaミミック抗体」という用語は、本件発明の発明者自身によっても使用されており、PCSK9タンパク質の15個のコア残基の大部分に結合する中和抗体として定義されるものであり、「EGFaミミック抗体」も本件発明に含まれる。
- しかしながら、本件特許明細書に記載された抗体は、「EGFaミミック抗体」とは認められず、さらに、出願時点でこの抗体を作製するための技術的知識が存在したことを示す証拠もない。
- また、「EGFaミミック抗体」は、特許権者が本件出願日の後においても未だ取得できておらず、その取得が困難であると認識されている抗体である。
これに基づき、裁判所は、本件発明が発明の詳細な説明に記載されたものとは認められず、さらに、発明の詳細な説明がその技術分野における通常の知識を有する者が実施可能な程度に明確かつ十分に記載されたものともいえないと判断した。
すなわち、本件特許はサポート要件および実施可能要件に違反しており、特許無効審判により無効とされるべきものであるとされ、したがって、アムジェン(原告)は、サノフィ(被告)に対して本件特許権を行使することはできないと判断された。
以下に、裁判所の判断の該当部分を一部抜粋する。
「(5) 「EGFa ミミック抗体」について
ア 証拠(甲 2、4、乙 4、50)及び弁論の全趣旨によれば、以下の事実が認められる。
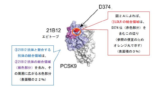
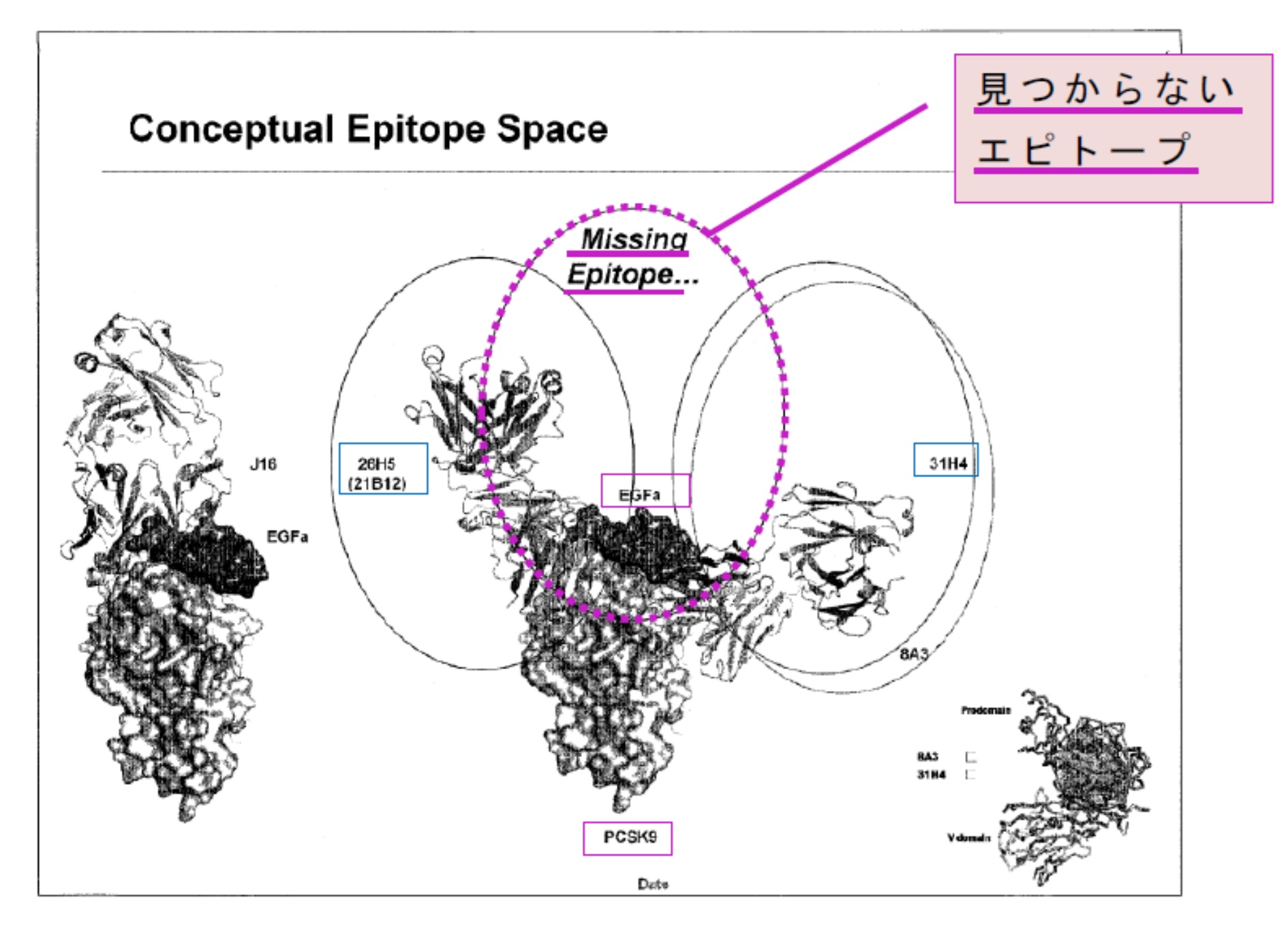
本件発明の発明者の 1 人は、本件特許の優先日から約 5 年後、出願日から約 4 年後の 2012 年(平成 24 年)の電子メール(以下「本件メール」という。)に、「我々は、現在、EGFa ミミック抗体を取得できていない、しかし、ファイザーは有しているから、それは可能なはずである〔(RN316)〕…EGFa ミミック抗体は、我々が現在有する抗体の 2 つの一部重複するエピトープのちょうど中間に位置することから、EGFa ミミック抗体を見つけることは一筋縄ではいかないだろう。」と記載していた。また、原告が 2012 年(平成 24 年)に作成した資料には、次の「Conceptual Epitope Space(概念的なエピトープスペース)」と題する図(以下「本件プレゼンテーション資料」という。)が含まれている。これには、21B12 抗体及び 31H4 抗体を示す各楕円形の中間に’Missing Epitope…’(見つからないエピトープ)との記載がある。
前記((1)ウ)のとおり、15 個の PCSK9 のコア残基、すなわち LDLR の EGFaドメインとの相互作用界面の特異的コア PCSK9 アミノ酸残基(S153、I154、P155、R194、D238、A239、I369、S372、D374、C375、T377、C378、F379、V380 及び S381)と相互作用し、又は遮断する抗体は、PCSK9/LDLR 相互作用の阻害のために有用であり得る。本件明細書の各実施例抗体と、それらが認識し、結合するPCSK9 のコア残基との対応関係は、結合部位対照表のとおりである。なお、同表中に「アムジェンの抗体」と示される抗体が本件明細書記載の各実施例抗体である。
また、同表の「J16」は、ファイザー社の抗体であり、本件メールに「RN316」、本件プレゼンテーション資料に「J16」と記載されているものと同一の抗体である(以下「J16 抗体」という。)。
イ 「EGFa ミミック抗体」の意味
上記アのとおり、「EGFa ミミック抗体」なる語は、本件発明の発明者自身が使用したものである。そこで、その意味について検討する。
(ア) 「EGFa ミミック抗体」との用語は、「ミミック(mimic)」の語義(「模倣する」、「擬態する」等)に照らせば、「模倣」ないし「擬態」といい得る程度に、LDLRの EGFa ドメインが結合する部位である PCSK9 の表面上のアミノ酸を多く認識する抗体を意味するものと理解できる。
(イ) 本件発明の発明者は、本件メールにおいて、EGFa ミミック抗体は、原告が有する 2 つの抗体(21B12 抗体及び 31H4 抗体)の一部重複するエピトープのちょうど中間に位置するとしている。原告が作成した本件プレゼンテーション資料においても、PCSK9 に結合する 21B12 抗体と 31H4 抗体の間の、「EGFa」と記載された PCSK9 上のスペースが「見つからないエピトープ」とされ、当該部分に J16 抗体が結合した図が示されている。また、「エピトープ」につき、本件明細書には、「エピトープは、その抗原を標的とする抗原結合タンパク質によって結合される抗原の領域であり、抗原がタンパク質である場合、抗原結合タンパク質に直接接触する特定のアミノ酸を含む。」との記載がある(【0142】)。これらの事情を踏まえると、原告は、「EGFa ミミック抗体」につき、「見つからないエピトープ」とされている特定の結合部位に結合する抗体を示す意味で用いていたものと理解される。
加えて、本件メール及び本件プレゼンテーション資料によれば、原告は、J16 抗体を EGFa ミミック抗体と認識していたとみられるところ、結合部位対照表によれば、同抗体は、15 個の PCSK9 のコア残基のうち 14 個を認識する抗体である。
そうすると、本件発明の発明者を始めとする原告側において、「EGFa ミミック抗体」の語は、15 個の PCSK9 のコア残基の大部分を認識する、すなわち、LDLR のEGFa ドメインが結合する部位である PCSK9 表面上の各アミノ酸を覆うように直接的に結合する抗体を意味するものとして使用されていたことがうかがわれる。
(ウ) これらの事情を総合的に考慮すると、「EGFa ミミック抗体」とは、15 個のPCSK9 のコア残基の大部分を認識する結合中和抗体を意味するものと理解される。
(エ) これに対し、原告は、EGFa ミミック抗体は 21B12 抗体と 31H4 抗体の両方と競合する抗体を指すとか、9C9 抗体が EGFa ミミック抗体であるかのような主張をする。
しかし、原告は、本件メールにおいて「EGFa ミミック抗体」をいかなる文脈において用いていたのか明らかにしない。その点を措くとしても、21B12 抗体と 31H4抗体の両方と競合する抗体も 9C9 抗体も本件明細書に記載されているところ(【0138】、実施例 37、【表 17】、【0494】)、これらが EGFa ミミック抗体であるとすれば、本件発明の発明者が、本件特許の出願日から約 4 年後に、本件メールにおいて、EGFa ミミック抗体を取得できていないとしていることとおよそ整合しない。
・・・(略)・・・
(7) サポート要件違反及び実施可能要件違反の有無
・・・ところで、EGFa ミミック抗体とは、15 個の PCSK9 のコア残基の大部分を認識する結合中和抗体である。本件明細書の記載によれば、参照抗体である 21B12 抗体はそのうち 6 個のアミノ酸残基を、31H4 抗体はそのうち 3 個のアミノ酸残基を認識するに過ぎないから(前記(1)ウ)、参照抗体はいずれも EGFa ミミック抗体ではない。また、結合部位対照表に記載されている本件明細書の各実施例抗体は、最大でも 8 個のアミノ酸残基を認識するにとどまるから(1A12 抗体)、これらはいずれも EGFa ミミック抗体とはいえない。他に本件明細書の各実施例抗体が EGFa ミミック抗体であることを認めるに足りる証拠はない。そうすると、本件明細書には、EGFa ミミック抗体が取得できたことが記載されているとはいえない。
当業者が、本件明細書の記載に基づき、一連の手順を最初から繰り返し行うことによって、本件明細書に具体的に記載された参照抗体と競合する中和抗体(ビン 1に含まれる 21B12 抗体と競合する 15 個の抗体、ビン 3 に含まれる 31H4 抗体と競合する 7 個の抗体)以外に、参照抗体と競合する中和抗体を作製できると仮定しても、A教授の第 2 鑑定書(乙 43)では、「特定のマウスが特定の抗体を生成するかどうかは運に支配されるため、候補となり得る抗体を全て生成しスクリーニングすることは不可能である」とされるところ、この点につき疑義を抱くべき合理的な事情は見当たらない。そうすると、本件明細書記載の抗体の作製過程を経たとしても、免疫化されたマウスの中で PCSK9 のどの位置に結合する抗体が得られるかは「運に支配される」ものといえることになる。しかるに、EGFa ミミック抗体を含め、特定の位置に結合する抗体を作製する方法が本件特許の出願時における技術常識であったことを認めるに足りる証拠はない。
これらの事情を踏まえると、本件明細書に記載された抗体の作製方法に関する記載をもって、本件明細書の発明の詳細な説明が、本件発明に含まれる EGFa ミミック抗体を当業者が作製できるように記載されているということも、また、本件発明に含まれる EGFa ミミック抗体が本件明細書の発明の詳細な説明に記載されているということもできない。
そもそも、原告は、本件特許の出願日から約 4 年後の 2012 年(平成 24 年)に至っても、EGFa ミミック抗体を取得できていないことを自認している上、EGFa ミミック抗体を見つけることは一筋縄ではいかないだろうと述べている(前記(5)ア)。
このように、EGFa ミミック抗体は、特許権者が本件出願日の後にあっても取得できておらず、取得困難と認識している抗体である。
以上によれば、本件明細書には EGFa ミミック抗体及びその具体的な作製方法は記載されておらず、当業者において、本件明細書の記載及び本件特許出願当時の技術常識によっては、これを作製できないものと認められる。
したがって、本件発明は、いずれも発明の詳細な説明に記載されたものとはいえず、また、発明の詳細な説明が、その発明の属する技術の分野における通常の知識を有する者がその実施をすることができる程度に明確かつ十分に記載されたものともいえない。すなわち、本件特許は、サポート要件及び実施可能要件に違反し、特許無効審判により無効にされるべきものである。」
(2)訂正の再抗弁の成否
本件発明からEGFaミミック抗体が除外されない限り上記無効理由が解消されることはないとして、裁判所は、本件発明からEGFaミミック抗体を除外するものとはいえない本件再訂正によってはサポート要件違反(及び実施可能要件違反)の無効理由は解消されておらず、訂正の再抗弁は成り立たないと判断した。

こうなると、どう訂正しても、EGFaミミック抗体であるアリロクマブを含む被告製品を包含させるのは難しい状況・・・
(3)サノフィによる無効理由の主張と信義則違反の有無
アムジェン(原告)は、別件審決取消訴訟を経て不成立審決が確定していることを踏まえ、特許法167条の趣旨や前訴の存在に照らせば、サノフィが本訴においてサポート要件及び実施可能要件違反の無効理由の主張を行うこと自体紛争の蒸し返しであり、信義則に反して許されないと主張した。
しかし、裁判所は、本件において、サノフィは、EGFaミミック抗体に係るサポート要件及び実施可能要件違反の無効理由の主張に当たり、前訴及び別件審決取消訴訟では提出されなかった「本件メール」及び「本件プレゼンテーション」資料に主に依拠しており、これらの証拠を前訴又は別件審決取消訴訟の事実審の口頭弁論終結日以前に提出できたことをうかがわせる具体的な事情はないことに鑑みると、この点に関するサノフィの主張をもって信義則に反して許されないとまではいえないと判断した。

特許法167条は、特許無効審判や延長登録無効審判の審決が確定した場合、当事者や参加人は同一の事実や証拠に基づいてその審判を請求することができないことを規定しています。これを「一事不再理効」といいます。
4.コメント
本件における判決の基礎となったのは、技術的思想として定義された「EGFaミミック抗体」の概念が発明の技術的範囲に含まれるものの、その抗体の作成に関して明細書の記載が不十分であり、また技術常識も存在しないため、サポート要件及び実施可能要件が満たされていないと裁判所が判断した点にある。
さらに、裁判所の判断に大きな影響を与えたのは、新たな証拠として、アムジェン(原告)が出願後においても「EGFaミミック抗体」を取得できておらず、その取得が困難であると自認する資料(「本件メール」及び「本件プレゼンテーション」)が提出されたことである。
この結果、前訴判決でサポート要件及び実施可能要件の違反が認められなかった判断とは異なり、本件においては、両要件を満たしていないとする判決を得ることにサノフィは成功した。
本件特許の出願日から約4年後の2012年の本件発明の発明者の 1 人からの電子メール(本件メール)には、
「我々は、現在、EGFaミミック抗体を取得できていない、しかし、ファイザーは有しているから、それは可能なはずである〔(RN316)〕…EGFaミミック抗体は、我々が現在有する抗体の 2 つの一部重複するエピトープのちょうど中間に位置することから、EGFaミミック抗体を見つけることは一筋縄ではいかないだろう。」
“We currently do not have an EGFa mimic antibody identified, but Pfizer does [have one] so it should be possible [(RN316)] … It will be tricky to find the EGFa mimic because it is in the middle of two overlapping epitopes we currently have antibodies sitting on.”
と記載されていた事実や、アムジェンが2012年に作成した「本件プレゼンテーション」資料は、米国での特許権侵害訴訟(におけるディスカバリー手続きの中でサノフィが入手したものであるようだ(CourtListener参照: 2019.09.11 MEMORANDUM ORDER; Law360.com参照URL: https://www.law360.com/articles/1299636/attachments/2)。
本件は、特許出願後においても、発明者や特許権者が本件発明に関して「発明の実施が困難である」と解釈されかねない発言を文書に残すことのリスクを改めて示した判決といえる。
このような文書が米国の特許権侵害訴訟におけるディスカバリー手続きにより被告側に開示された場合、当該文書が特許無効の重要な証拠として認識され、米国のみならず日本を含む他国における訴訟での裁判所の判断に大きな影響を与える可能性がある。
この事例から得られる教訓として、発明者や特許権者は、特許出願後も極めて慎重に発言し、特にその発明に関する実施可能性や有効性について否定的なコメントを文書に残さないよう、十分な注意が求められる。
たとえ社内の非公開の場であっても、当該文書がディスカバリー手続きにより開示され、特許無効の証拠として訴訟に使用されるリスクがあるためである。

具体的な教訓としては以下の点を意識し、特許訴訟に備えた文書管理や内部コミュニケーションが求められます。
- 社内文書の管理と慎重な言動:社内で発明や特許に関して議論する際も、常にその内容が外部に出る可能性を念頭に置き、特に発明の有効性や実施可能性を否定するような記録を残さないようにする。
- ディスカバリーの影響を認識する:米国の訴訟ではディスカバリー手続きで幅広い情報が開示されるため、発明に関する文書や発言が不利に働く可能性がある。これが他国の訴訟にも影響を及ぼす場合があるため、慎重な対応が必要。
- 特許の一貫性と信頼性の確保:特許を守るためには、出願前後を問わず発明の実施可能性を一貫して主張することが重要。発明者や関係者は、その立場を曖昧にするような行動や発言を避けるべきである。
しかしながら、提出された新証拠をそのまま解釈すれば、実際のところ、アムジェンが裁判所により認定された「EGFaミミック抗体」を入手できていなかった事実は否定し難いだろう。
また、社内の研究活動において、これに関する事実を一切記録に残さないよう厳密に管理することは、現実的には極めて困難である。
むしろ、こうした状況下で、実務上どのような対策を講じるべきかが重要な課題となるだろう。

ご指摘の通り、アムジェンの事例のように、研究開発の過程で発明が期待通りに進まなかったり、特許発明の実施が困難であったり・・・といった状況に直面することは現実的にはよくあります。そして、そのような状況を全く記録に残さないというのは、研究活動を円滑に進める上でも不適切です。そこで、現実的な対策として、以下のようなアプローチが考えられます。
- 正確であると同時に、誤解を招かない表現を心がけること。「できない」「不可能」という断定的な表現ではなく、「現段階ではこれこれの条件下で課題が存在する」といった形で、限定的な文脈での説明にとどめる方がよい。
- 定期的に内部文書の内容を法的観点から見直し、不利な影響が及ばないようにするレビューする体制を整える。
- 社内の教育とリスク意識の向上。特にディスカバリー手続きに関するリスクを理解し、自分たちの発言や記録が法的な影響を及ぼすことを意識させることが重要。
現実的には、研究開発において発生する問題や課題を完全に記録から排除することはできない。
しかし、言葉遣いに気を付け、内部レビューを徹底し、文書管理のプロセスを慎重にすることで、特許訴訟におけるリスクを大幅に軽減することができるかもしれない。

問題となった電子メールで、発明者は、
「我々は、現在、(弱いながらEGFaミミック抗体が得られているものの、一定の条件下では)EGFaミミック抗体を取得できていない、しかし、ファイザーは有しているから、それは(当業者なら)可能なはずである。・・・(15個のPCSK9のコア残基の大部分を弱いながらも認識する抗体は、一定の条件下で得られているものの、ここから医薬品の承認に至るまでの道程は)一筋縄ではいかないだろう。」
と言いたかった・・・と主張してもダメかな?

A教授の第2鑑定書の「運に支配される」という証言も裁判所の判断に影響しているようですね。裁判所は「免疫化されたマウスの中で PCSK9 のどの位置に結合する抗体が得られるかは「運に支配される」ものといえることになる」と認定していますよ~。ピポ先輩!

・・・
5.おわりに
「別件審決取消訴訟」においては、審決取消しの判決が確定し、これによりアムジェンの敗訴が確定した。
その結果として、当該審判事件の審理は現在、特許庁において再開されている。
本件についても、おそらく知的財産高等裁判所への控訴が行われていると推察され、現時点では本件特許に関する紛争が最終的に解決しているとはいえない。
アムジェンは現状、不利な立場にあると考えられるが、今後の訴訟手続において形勢を逆転することが可能か否かについては、引き続き注視する必要がある。
アシスタント:
Robot icons created by Freepik – Flaticon; Robot icons created by Freepik – Flaticon: Robot cat icons created by Freepik – Flaticon




コメント