アクトス(ACTOS)併用発明の新規性判断: 知財高裁平成23年(行ケ)10148
【背景】
武田薬品(被告)の特許(第3148973号)に対する沢井製薬(原告)の特許無効審判の請求について、請求は成り立たないとした審決(無効2010-800087)(参照: 2011.03.22 「沢井製薬 v. 武田薬品」 特許無効審判事件 2010-800087, 2010-800088)の取消訴訟。
請求項(本願発明):
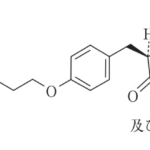
1. (1)ピオグリタゾンまたはその薬理学的に許容しうる塩と,(2)アカルボース,ボグリボースおよびミグリトールから選ばれるα-グルコシダーゼ阻害剤とを組み合わせてなる糖尿病または糖尿病性合併症の予防・治療用医薬
2. (1)ピオグリタゾン又はその薬理学的に許容しうる塩と,(2)アカルボース,ボグリボースおよびミグリトールから選ばれるα-グルコシダーゼ阻害剤とを組み合わせてなる,副作用の軽減された糖尿病または糖尿病性合併症の予防・治療薬
3. 副作用が消化器障害である請求項2記載の医薬
4. 消化器障害が下痢である請求項3記載の医薬
5. α-グルコシダーゼ阻害剤がボグリボースである請求項1記載の医薬
6. ピオグリタゾン又はその薬理学的に許容しうる塩1重量部に対し,α-グルコシダーゼ阻害剤を0.0001~0.2重量部用いる請求項1記載の医薬
7. (1)ピオグリタゾンまたはその薬理学的に許容しうる塩と,(2)アカルボース,ボグリボースおよびミグリトールから選ばれるα-グルコシダーゼ阻害剤とを組み合わせてなる,これらの薬剤の単独投与に比べて血糖低下作用の増強された糖尿病または糖尿病性合併症の予防・治療用医薬
8. α-グルコシダーゼ阻害剤がボグリボースである請求項7記載の医薬
9. ピオグリタゾンまたはその薬理学的に許容しうる塩1重量部に対し,α-グルコシダーゼ阻害剤を0.0001~0.2重量部用いる請求項7記載の医薬
10. (1)ピオグリタゾンまたはその薬理学的に許容しうる塩と,(2)アカルボース,ボグリボースおよびミグリトールから選ばれるα-グルコシダーゼ阻害剤とを組み合わせてなる,これらの薬剤の単独使用の場合と比較した場合,少量を使用することを特徴とする糖尿病または糖尿病性合併症の予防・治療用医薬
11. α-グルコシダーゼ阻害剤がボグリボースである請求項10記載の医薬
12. インスリン感受性増強剤1重量部に対し,α-グルコシダーゼ阻害剤を0.0001~0.2重量部用いる請求項10記載の医薬
【要旨】
主文
特許庁が無効2010-800087号事件について平成23年3月22日にした審決を取り消す。(他略)
1. 取消事由1(引用例3に基づく本件発明1等の新規性に係る判断の誤り)について
裁判所は下記のとおり判断した。
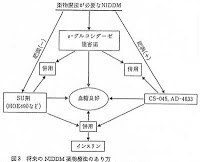
「以上のとおり,引用例3の図3には,「ピオグリタゾン又はその薬理学的に許容し得る塩と,アカルボース,ボグリボース及びミグリトールから選ばれるα-グルコシダーゼ阻害剤とを組み合わせてなる糖尿病又は糖尿病性合併症の予防・治療薬」という構成の発明が記載されているものと認められ,当業者は,本件優先権主張日当時の技術常識に基づき,当該発明について,両者の薬剤の併用投与によるいわゆる相加的効果を有するものと認識する結果,ピオグリタゾン等の単独投与に比べて血糖低下作用が増強され,あるいは少量を使用することを特徴とするものであることも,当然に認識したものと認められるほか,下痢を含む消化器症状という副作用の軽減という作用効果を有することも認識できたものと認められる。
したがって,引用例3の図3には,本件発明1等の構成がいずれも記載されており,本件優先権主張日当時の技術常識を参酌すると,その作用効果又は作用効果に関わる構成もいずれも記載されているに等しいというべきであって,これらの発明は,いずれも特許出願前に頒布された刊行物に記載された発明(特許法29条1項3号 )であるというほかない。
よって,本件審決は,引用例3の図3に記載の発明についての認定を誤り,ひいては本件発明1等に関する特許法29条1項3号 の適用を誤るものであって,取消事由2(引用例4に基づく本件発明1等の新規性に係る判断の誤り)について判断するまでもなく,取消しを免れない。」
2. 取消事由3(本件各発明の容易想到性に係る判断の誤り)
裁判所は以下のとおり判断した。
「以上によれば,引用例3の図3に記載の発明において,ピオグリタゾン又はその薬理学的に許容し得る塩とα-グルコシダーゼ阻害剤とを併用投与するに当たって,各用量をどのように特定するかは,投与者がそれにより得ようとするいわゆる相加的効果の内容に応じて適宜設計すれば足りる事項であるというべきであって,本件発明6,9及び12の前記相違点に係る構成は,実質的な相違点とはいえないか,せいぜい当業者が容易に想到することができるものであるといえる。
~よって,当業者が本件各発明(特に,本件発明6,9及び12)を容易に想到できないとした本件審決の判断は,特許法29条2項 の適用を誤るものであり,本件審決は,取消しを免れない。」
【コメント】
新規性判断において、特許庁は、
「図3には,肥満患者(肥満+)においてα-グルコシダーゼ阻害剤とピオグリタゾン(AD-4833)とを併用することについて示されているが(3c),ピオグリタゾンとα-グルコシダーゼ阻害剤であるアカルボース,ボグリボース又はミグリトールとを併用することにより実際に糖尿病治療が行われたことや,その併用について糖尿病治療に係る薬理効果を実際に確認したことについては何ら記載がない。」
と認定し、ピオグリタゾンとα-グルコシダーゼ阻害剤であるアカルボース、ボグリボース又はミグリトールとの組み合わせに係る薬理効果の実証を伴わない記載のみからでは、刊行物において本件発明が記載されているとは認められないと判断していた(参照: 2011.03.22 「沢井製薬 v. 武田薬品」 特許無効審判事件 2010-800087, 2010-800088)。
被告(武田薬品)も、併用医薬発明は併用効果を奏する場合に初めて発明として完成するものであるから優先権主張日当時に技術的思想として確立されていたとはいえず、引用例に本願発明が記載されていたということはできないと主張した。
しかし、結局、裁判所は新規性なしと判断した。優先権主張日当時の技術常識から、引用発明としての併用効果がどのように認識できるかどうかという点も含め、刊行物に記載された引用発明の認定において特許庁と裁判所の判断が割れた形となった。
「物」または「医薬用途」の発明の新規性判断において、引用発明の適格性にその効果の記載は必須か、必須でなくても明細書の記載や技術常識からどのように認識され、判断されるのか、過去の事例とともに参考になる事案である(参考: 記載要件/引例適格/データは必要か)。
また、本件発明2ないし4には「副作用の軽減された」との作用効果に関わる構成があり、これらも、当時の技術常識を参酌すれば引用発明に記載されているに等しいと裁判所は判断した。
発明の作用効果に関するクレームの構成が引用発明との一致点・相違点の認定においてどのように判断されるのかということを検討する上で参考になる事例といえる(以下参考)。
- 審査基準第Ⅱ部 第2章 新規性・進歩性 1.5.2 特定の表現を有する請求項における発明の認定の具体的手法
(1) 作用、機能、性質又は特性(以下、「機能・特性等」という。)を用いて物を特定しようとする記載がある場合②ただし、その機能・特性等が、その物が固有に有しているものである場合は、その記載は物を特定するのに役に立っておらず、その物自体を意味しているものと解する。
- 審査基準第Ⅱ部 第2章 新規性・進歩性 1.5.5 新規性の判断
(3) 機能・特性等による物の特定を含む請求項についての取扱い②以下に、一応の合理的な疑いを抱くべき場合の例を示す。
・引用発明と請求項に係る発明との間で、機能・特性等により表現された発明特定事項以外の発明特定事項が共通しており、しかも当該機能・特性等により表現された発明特定事項の有する課題若しくは有利な効果と同一又は類似の課題若しくは効果を引用発明が有しており、引用発明の機能・特性等が請求項に係る発明の機能・特性等に含まれる蓋然性が高い場合 - 2008.02.29 「ティロッツ・ファルマ v. 特許庁長官」 知財高裁平成19年(行ケ)10236
- 2011.01.31 「X v. デビオファーム」 知財高裁平成22年(行ケ)10122
- 2011.01.18 「X v. 特許庁長官」 知財高裁平成22年(行ケ)10055
- 2011.03.23 「アイノベックス v. アプト」 知財高裁平成22年(行ケ)10256
- 2011.10.31 「X v. 特許庁長官」 知財高裁平成23年(行ケ)10189
また、特許庁は、進歩性判断において、
「本件特許明細書の実験例1において示される併用効果が相加効果又は相乗効果のいずれであるのかまでは直ちには判断し得ないとしても,ピオグリタゾンとα-グルコシダーゼ阻害剤であるボグリボースとの併用による本件発明1の効果は,甲第1~4号証における記載からは当業者が予測できない格別顕著なものであると言うべきである。」
とし、本件発明に係る糖尿病治療薬は、これら刊行物の記載から当業者が容易に想到することができたとは認められないと判断していた。しかし、裁判所は、 取消事由1(新規性に係る判断の誤り)についての判決文中で、
「本件明細書は,塩酸ピオグリタゾンとα-グルコシダーゼ阻害剤であるボグリボースとの併用投与による作用効果についても,当業者が想定するであろういわゆる相加的効果を明らかにする余地があるにとどまり,当業者の予測を超える顕著な作用効果(いわゆる相乗的効果)や,あるいは原告の主張に係る「併用効果」なるものを立証するに足りるものではない。したがって,本件明細書には,本件各発明の作用効果の顕著性を判断するに当たり,被告が援用する乙20ないし23(被告所属の技術者が作成した実験成績証明書等)の記載を参酌すべき基礎がないというほかない。」
と言及しており、出願後に提出された実験成績証明書の参酌を認めなかった(別事案も参照: 2012.04.11 「沢井製薬 v. 武田薬品」 知財高裁平成23年(行ケ)10146, 10147)。出願後の実験データの参酌が認められる要件について整理される必要があるのではなかろうか。
参考:

コメント