公知ラセミ体を構成する一方の光学異性体の新規性・進歩性: 知財高裁平成24年(行ケ)10206
【背景】
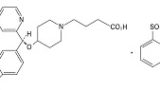
被告らが保有する「光学活性ピペリジン誘導体の酸付加塩及びその製法」に関する特許(第4562229号)について、原告がした無効審判を請求不成立とした審決(無効2011-800097号)に対する取消訴訟。公知ラセミ体を構成する一方の光学異性体の新規性・進歩性が争点。
原審参照: 2012.04.23 「遼東化学 v. 宇部興産・田辺三菱」特許無効審判事件 2011-800097, 2011-800098
【要旨】
主 文
1 原告の請求を棄却する。
2 訴訟費用は原告の負担とする。
裁判所の判断
1 取消事由1(新規性についての判断の誤り)について
原告は、
「東京高裁平成3年判決(*1991.10.01 東京高裁平成3年(行ケ)8)及び運用指針(*特許庁の運用指針「物質特許制度及び多項制に関する運用基準」(昭和50年10月特許庁策定))を根拠として,ラセミ体が開示されていれば,(R)体及び(S)体がそれぞれ開示されていると見るべきであり,特に本件化合物については,光学異性体の存在が甲2公報に明記されているのであるから,(S)体を対象とする本件特許発明が新規性を欠くことは明らかである」
と主張した。
しかし、裁判所は、
「東京高裁平成3年判決は,昭和53年1月31日を優先日として特許出願された発明の新規性を否定した審決の取消しを求める審決取消訴訟において,一対の光学異性体から成るラセミ体が刊行物に記載されている場合,その一方を単独の物質として提供する発明の新規性を有するか否かが争われた事案について,光学異性体は,一般に,旋光性の方向以外の物理的化学的性質においては差異がないから,ラセミ体の開示をもって光学異性体が開示されているというべきであるとして上記発明の新規性を否定した判決であり,本件特許の優先日(平成8年12月26日)の技術常識を参酌したものでないことは明らかであるから,同判決を本件について適用すべき裁判例ということはできない。
すなわち,先に説示したとおり,本件特許の優先日における技術常識に照らせば,ある化学物質の発明について光学異性体の間で生物に対する作用が異なることを見出したことを根拠として特許出願がされた場合,ラセミ体自体は公知であるとしても,それを構成する光学異性体の間で生物に対する作用が異なることを開示した点に新規性を認めるべきであって,本件特許の優先日における判断として,ラセミ体の開示をもって光学異性体が開示されているとして新規性を否定するのは誤りである。
また,運用指針については,確かに,原告の主張する規定(「立体異性体の存在が自明でない化学物質の発明と,その立体異性体の発明とは,原則として別発明とする。(なお,ここでいう自明とは単純な光学異性体のように,不整炭素原子の存在により,その光学異性体の存在が明らかである場合をいう。)」(特-13頁))があり,この規定は,不斉炭素原子の存在により,その光学異性体の存在が明らかである場合については,立体異性体の存在が自明であるとして,ラセミ体の開示をもって光学異性体の開示があると見るべきである旨を述べているものと見る余地がなくはない。
しかし,上記のとおり,本件特許の優先日における技術常識は,昭和53年当時には未だ技術常識として確立していなかったのであるから,昭和50年当時にも技術常識として確立していなかったことは明らかである。本件特許発明の新規性の有無については,本件特許の優先日における技術常識に照らして判断すべきであり,運用指針の規定を根拠とするのは誤りである。したがって,東京高裁平成3年判決及び運用指針を根拠とする原告の上記主張は採用することができない。」
と判断した。
また、原告は、
「本件特許の優先日当時,甲8記載の方法で使用されたカラムを使用して実際に分割に成功した例は多数存在している(甲25,35)として,本件化合物を光学分割する方法として甲8記載の方法は当業者にとって自明であったというべきであり,甲2公報には甲8記載の方法で本件化合物を光学分割する方法が記載されているに等しい」
と主張した。
しかし、裁判所は、
「甲8記載の方法で使用されたカラムを使用して分割できる物質が多数存在するとしても,当該カラムを使用して本件化合物ないしこれと化学構造が類似した化合物を光学分割できる例が知られていない以上,本件特許の優先日当時において,本件化合物を光学分割する方法として甲8記載の方法は当業者にとって自明であり,甲2公報には甲8記載の方法で本件化合物を光学分割する方法が記載されているに等しいということはできない。したがって,原告の上記主張は理由がない。」
と判断した。
2 取消事由2(進歩性についての判断の誤り)について
裁判所は、以下のとおり判断した。
「本件特許発明1の進歩性に係る審決の判断は,本件化合物をHPLC法により光学分割する際にキラル固定相としてCHIRALCEL ODやCHIRALPAK ADを採用することは当業者が最初に検討するとした点に誤りはないものの(前記(3)),本件化合物の光学分割を行う際に当業者がジアステレオマー法をまず最初に検討するとした点及び本件化合物の光学分割に当たりヘキサン/イソプロパノール/トリフルオロ酢酸(0.1%)を含む移動相を選択することは当業者が容易に想到できるとはいえないと判断した点に誤りがあり(前記(1),(2)),したがって,実質的に(R)体を含有しない,(S)体である本件化合物は,本願出願時の技術常識を考慮しても,当業者が容易に得ることができなかったものであるとしたことは誤りであるけれども(前記 (4)),本件特許発明1の実質的に(R)体を含有しない,(S)体である本件化合物は,審決が認定した甲2発明における本件化合物と比較して当業者が予測することのできない顕著な薬理効果を有するものであると認定判断した点に誤りはなく(前記(5)),結局のところ,本件特許発明は甲2発明に対して進歩性を有するものとした審決の判断は,結論において誤りはない。よって,原告主張の取消事由2は理由がない。」
【コメント】
裁判所は、公知ラセミ体を構成する一方の光学異性体の進歩性について、構成の観点からは当業者が容易に想到可能としながらも、顕著な効果を有するから進歩性を肯定できると判断した。
では、本件化合物((S)体)の効果とはどのようなものだったかというと・・・
- ヒスタミンショック死抑制作用試験において(S)-エステルが(R)-エステルよりED50値として約43倍強い活性を示したこと
- homologousPCA反応抑制作用試験において(S)-エステルが(R)-エステルよりED30値として約100倍以上強い作用を示したこと
- モルモットから摘出した回腸におけるヒスタミン誘発収縮に対する薬理試験において本件化合物の(S)体がそのラセミ体に対して約7倍の活性を示したこと
- ヒスタミンショック死抑制作用試験において本件化合物の(S)体がラセミ体に対して約3倍の生存率を示したこと
この点から、裁判所は、本件化合物の(S)体は、その(R)体と比較して、当業者が通常考えるラセミ体を構成する2種の光学異性体間の生物活性の差以上の高い活性を有するものということができると結論付けている。
しかし、審決の内容によれば、上記の比較のうち、本件化合物の(S)体とラセミ体とを比較した実験成績証明書では、ID50、IC50等によって比較されていたわけではなく1点のみでしか比較されていなかったようである。
(R)体の薬理活性が低ければ、(S)体が(R)体に比べてpotencyが強い結果になることや、用量反応曲線がシグモイドを示すことは一般的であり、薬理効果を示す閾値付近であれば、ある特定の用量での(S)体がラセミ体(つまり半分の(S)体の量)に比べて2倍以上の効果を示すこともあり得るということは当業者なら通常考えるのではないだろうか。
(例)
- グルタミン酸 (L)うま味あり;(D)うま味なし
- アスパルテーム (S,S)砂糖の200倍甘い;(R,R)苦い
- ペニシリンG (+)抗菌活性あり;(-)抗菌活性なし
- エストロン (+)女性ホルモン作用;(-)活性なし
- ドーパ (L)抗パーキンソン病薬;(D)活性なし
- メントール (-)体のにおい、清涼感が(+)体の約3.5倍、10倍以上
- プロポキシフェン (+)鎮痛作用;(-)鎮咳作用
- ナプロキセン (S)鎮痛・抗炎症作用;(R)副作用あり
- エスゾピクロン(S体) GABAA 受容体複合体Cl−チャネルに対する結合親和性Ki=10nM;ゾピクロン(ラセミ体)Ki=25nM;(R)-ゾピクロン親和性なし
- レボセチリジンは、もう1 つのエナンチオマーであるデキストロセチリジンと比べ、ヒトヒスタミンH1受容体に対する親和性が30倍高く、解離速度は緩徐である(解離半減時間はデキストロセチリジンの7分に対してレボセチリジンでは115分)
- エソメプラゾールは、オメプラゾールを光学分割したS-エナンチオマー。S体はR体に比べ、肝臓での初回通過効果を受けにくく、未変化体のAUCはオメプラゾールに比べおよそ1.7倍で推移するため、より強い酸分泌抑制効果を示す。S体とR体の酸分泌抑制作用には差はない(Wikipediaより)。
裁判所はそもそも公知のラセミ体から一方の光学異性体は容易に想到可能と判断しているのだから、効果の顕著性の判断は、その一方は薬理活性が高いという前提に立って、それでも効果が顕著だといえるのかそれとも顕著とはいえないのかという議論を基に判断されるべきだったのは。
参考:


コメント