Summary
- 知財高裁は、ToolGen社のCRISPR-Cas9によるゲノム編集に関する発明はCharpentier博士とDoudna博士が2012年のScience誌にて発表したCRISPR-Cas9によるゲノム編集に関する論文によって進歩性を欠くとした拒絶審決を支持する判決を言い渡した。
- ToolGen社は、米国において、CRISPR-Cas9によるゲノム編集に関する先発明を争っている。
1.背景
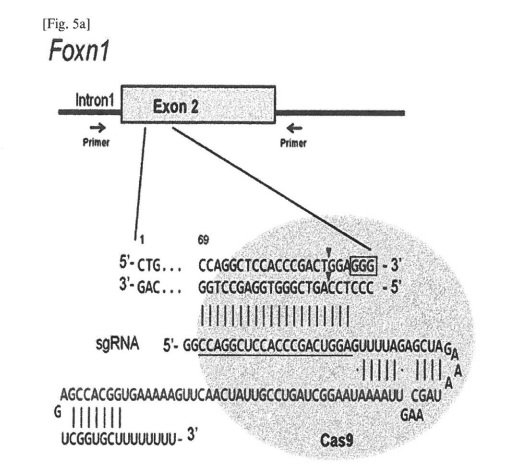
本件(知財高裁令和3年(行ケ)10129)は、発明の名称を「標的DNAに特異的なガイドRNAおよびCASタンパク質コード核酸またはCASタンパク質を含む、標的DNAを切断するための組成物、ならびにその使用」とするツールゲン インコーポレイテッド(ToolGen社)の特許出願(特願2017-155410号; 第1優先日: 2012年10月23日)について、本願発明は引用文献1に記載の発明(引用発明)と周知技術に基づいて当業者が容易に発明することができたものであるから進歩性(特許法29条2項)を欠くとして拒絶すべきとした審決(不服2020-000013号事件)の取消訴訟である。
本願発明に係る特許請求の範囲の記載は、次のとおりである。
(i)Cas9ポリペプチドおよび核局在化シグナルをコードする核酸、または核局在化シグナルを有するCas9ポリペプチド、および
(ii)真核細胞中の標的DNAにハイブリダイズするガイドRNAまたは該ガイドRNAをコードする核酸、
を含み、ガイドRNAがトランス活性化crRNA(tracrRNA)配列に融合したCRISPR RNA(crRNA)配列を含むキメラガイドRNAであり、該crRNA配列が該tracrRNA配列に対して5′末端側にある、上記組成物。
本願発明と引用発明との相違点は、次のとおりである。
- 相違点1
本願発明は、「真核細胞」における標的DNAを切断するための組成物であって、Cas9ポリペプチドが「核局在化シグナル」を有しているのに対して、引用発明は、「緩衝液中」の標的DNAを切断するための組成物であって、Cas9ポリペプチドが「核局在化シグナル」を有していない点。
- 相違点2
本願発明は、Cas9ポリペプチド及びガイドRNAが、それらをコードする核酸である態様も含まれているのに対し、引用発明は、そのような態様が含まれていない点。
2.裁判所の判断
裁判所(知財高裁・第4部)は、「相違点1の構成は容易に想到することができ、そして、原告は、相違点2の構成が容易に想到できるとする本件審決の判断を争うものではなく、さらに、本願発明は予測できない顕著な効果を奏するものでもないから、本願発明は容易に発明することができたものである」と判断し、よって、取消事由は理由がないから、原告の請求を棄却すると判決した。
取消事由(引用発明に基づく本願発明の進歩性判断の誤り)の有無についての裁判所の判断を以下に抜粋する。
(1)相違点1の容易想到性判断の誤りの有無について
本願第1優先日当時、ゲノム編集の主たる対象は真核細胞であって、ZFNやTALENが真核細胞中の標的DNAすなわち核内のゲノムを切断するものであることは技術常識である・・・また、本願第1優先日当時、タンパク質や核酸を真核細胞へ送達する各種手段は周知技術である・・・点を踏まえれば、引用文献1の記載に接した当業者は、引用文献1にいう「ゲノム編集」は「真核細胞」におけるゲノム編集をも意図するものと認識し、本願第1優先日当時の周知技術に基づいて、引用発明のCRISPR/Cas9系を、真核細胞のゲノム上の標的DNAの切断に用いようと試みるものといえる。
・・・真核細胞のゲノムが核内に存在することは当業者にとって自明の事項であるところ、タンパク質を真核細胞の核内に移行させるために核局在化シグナルを付加することは、本願第1優先日当時の常套手段である・・・。
そうすると、上記・・・のとおりに引用発明のCRISPR/Cas9系を真核細胞のゲノム上の標的DNAの切断に用いようと試みる当業者は、Cas9ポリペプチドに核局在化シグナルを付与することを常套手段として当然に行うと認められるから、核局在化シグナルの付与に独自の創意工夫を挟ませる余地はないといえる。
以上からすると、相違点1は容易に想到できるといえる。
(2)予測できない顕著な効果について
原告は、前記・・・のとおり、本願発明には、真核細胞内のゲノムDNAを切断し、編集することができるという予測できない顕著な効果がある旨主張する。
しかしながら、発明の効果が予測できない顕著なものであるかについては、当該発明の特許要件判断の基準日当時、当該発明の構成が奏するものとして当業者が予測することのできなかったものか否か、当該構成から当業者が予測することのできた範囲の効果を超える顕著なものであるか否かという観点から検討する必要がある(最高裁判所平成30年(行ヒ)第69号令和元年8月27日第三小法廷判決・集民262号51頁参照)。
そして、本願発明の構成は、真核細胞における標的DNAを切断するための組成物であるから、そのような組成物が真核細胞内のゲノムDNAを切断し、編集することができるのは当然に予想されるといい得るところ、原告が予測できない顕著な効果として主張するものは、いずれも、真核細胞における標的DNAを切断するための組成物であれば当然に備えることが予想される範囲内の効果をいうにすぎないから、本願発明に予測できない顕著な効果を認める余地はない。
参考:
3.コメント
原告(出願人)は、「真核細胞において使用するためのタイプIIのCRISPR-Casシステムを初めて作製し、真核細胞の標的配列中に部位特異的な二本鎖切断を導入することに成功したことを初めて実証した(拒絶理由通知に対する応答より)」と主張し、進歩性の判断において種々の阻害要因が存在する旨の主張を繰り返した。
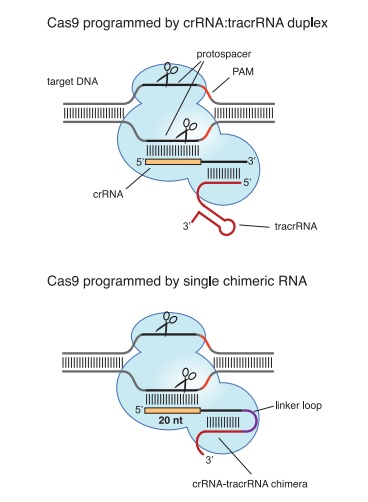
しかし、引用文献1(Jinek M. et al. Science 337, 816-21 (2012): A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial)は、CRISPR-Cas9によるゲノム編集技術の発見で2020年ノーベル化学賞を受賞したEmmanuelle Charpentier博士とJennifer A. Doudna博士が2012年6月28日に発表した共著論文としてあまりにも有名である。
真核細胞で実証したのは初めてだったのかもしれないが、引用文献1に接した当業者であれば、引用発明を真核細胞のゲノム上の標的DNAの切断に用いようと試みるといえるだろうと判断され、進歩性欠如の拒絶理由は解消できなかった。
本件出願は、元をたどるとPCT出願(PCT/KR2013/009488; WO2014/065596)経由の日本出願からの分割出願であり、その日本出願ファミリーのうち、特許6517143号は登録に至っている(以下がその請求項1)。
(i)真核細胞中の標的DNAに特異的なガイドRNAもしくはガイドRNAをコードするDNA、および(ii)Cas9タンパク質をコードする核酸もしくはCas9タンパク質、を含有する、真核細胞中の標的DNAを切断するための組成物であって、ガイドRNAがCRISPR RNA(crRNA)およびトランス活性化crRNA(tracrRNA)を含むデュアルRNAまたは一本鎖ガイドRNAであり、一本鎖ガイドRNAがtracrRNA配列に融合したcrRNA配列を含み、ガイドRNAが、更に、一本鎖ガイドRNA、またはデュアルRNAのcrRNAの5’末端に2つの付加的なグアニンヌクレオチドを含み、2つの付加的なグアニンヌクレオチドと一本鎖ガイドRNAまたはデュアルRNAのcrRNAの5’末端との間に更なるヌクレオチドがない、上記組成物。
そして、本件出願の米国出願ファミリー(No.14/685,510)は、CRISPR-Cas9の先発明を争う一連のインターフェレンス手続きの対象のひとつとなっており、その審理が、現在、米国商標特許庁特許審判部(PTAB)に係属中である。
- Broad研究所、Harvard大学、MIT(以下、総称して「Broad研究所」)とToolGen社との間で先発明を争っているインターフェアレンス第106,126号事件
- California大学、Vienna大学、Emmanuelle Charpentier氏(以下、総称して「CVC」)とToolGen社との間で先発明を争っているインターフェアレンス第106,127号事件
CVCとBroad研究所との間で先発明を争っているインターフェアレンス第106,115号事件が米国連邦巡回控訴裁判所(CAFC)で審理中であることから、2022年9月28日、PTABは、上記ToolGen社が関わる2つのインターフェアレンス事件の審理を一時的に停止した。
CVCとBroad研究所との間で争われいる事件の結果が、ToolGen社が関わるインターフェアレンス事件の審理に大きく影響を与えることになりそうである。


コメント